课题1 生活中常见的盐(共22张PPT)
图片预览







文档简介
第11单元 盐 化肥
生活中常见的盐
第一课时
生活中常见的盐
1.了解氯化钠、碳酸钠、碳酸氢钠和碳酸钙的组成及其在生活中的主要用途。
2.学习分离、提纯固体混合物的方法。
4.会判断复分解反应的类型。
3.掌握碳酸根离子的检验方法。
生活中常见的盐
判断:食盐属于化学中的盐吗?为什么?
盐是由 和 构成的一类化合物。
食盐是由Na+ 和Cl-构成的化合物;
金属离子
酸根离子
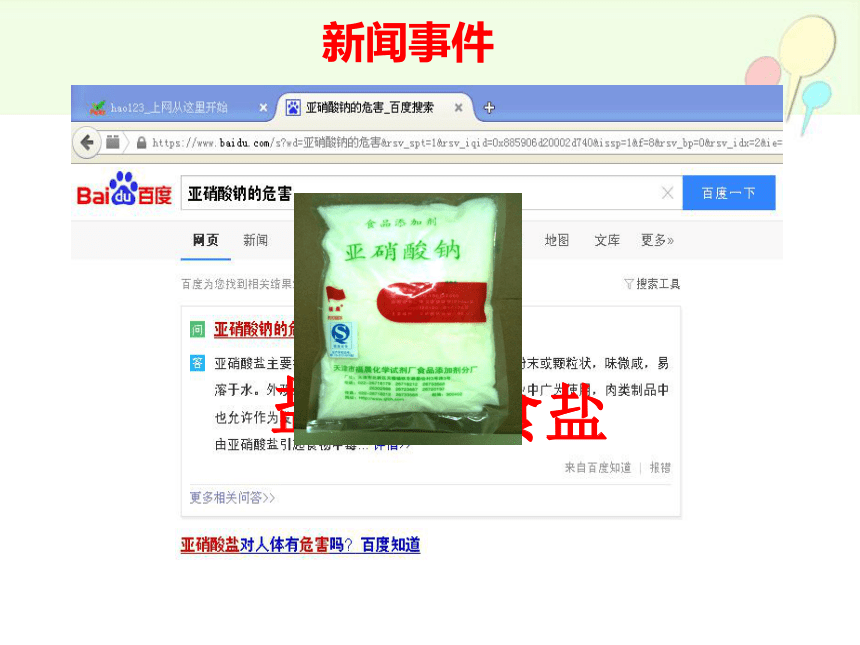
厨师将工业用盐误作食盐工人进医院
石家庄37人中毒
新闻事件
碳酸钙
碳酸氢钠
碳酸钠
Na2CO3
CaCO3
NaHCO3
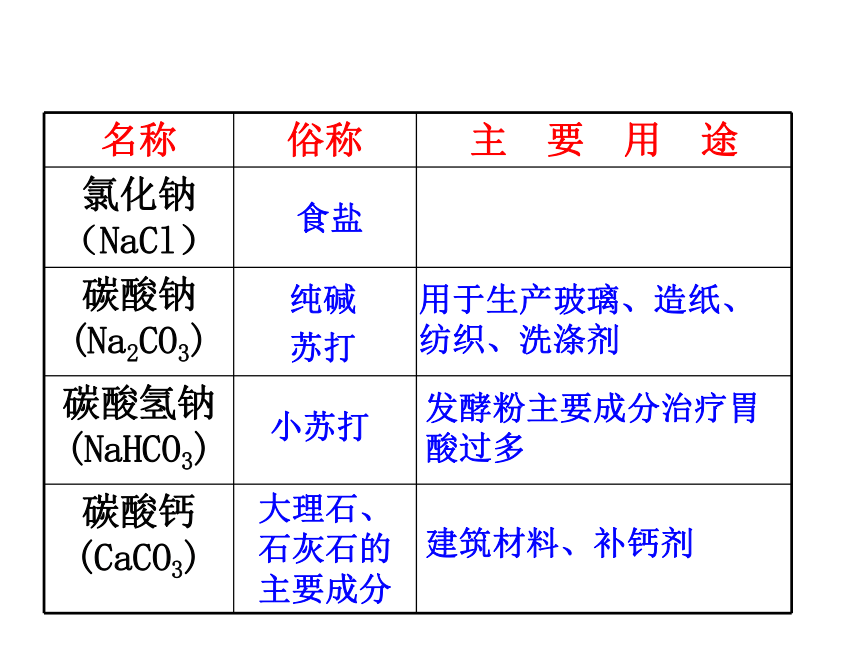
苏打
用于生产玻璃、造纸、纺织、洗涤剂
发酵粉主要成分治疗胃酸过多
建筑材料、补钙剂
小苏打
纯碱
苏打
食盐
名称 俗称 主 要 用 途
氯化钠(NaCl)
碳酸钠(Na2CO3)
碳酸氢钠(NaHCO3)
碳酸钙(CaCO3) 大理石、石灰石的主要成分
4、食盐的晒制:
5、粗盐的提纯
[讨论与交流]
粗盐中含有较多的可溶性杂质(氯化镁、氯化钙)和不溶性杂质(泥沙等)。其中的不溶性杂质怎么除去呢?
5、粗盐的提纯
粗盐
(NaCl、CaCl2、MgCl2、泥沙)
①
加水溶解
②
过滤
滤纸
泥沙
滤液
蒸发
③
NaCl、CaCl2、MgCl2
NaCl、CaCl2、MgCl2
二、碳酸钠用途
碳酸氢钠用途
碳酸钙用途
纯碱
苏打
小苏打
大理石
石灰石
用于生产玻璃、造纸、纺织、洗涤剂
发酵粉的主要成分之一,
治疗胃酸过多症的药剂
可作补钙剂,用于实验室制取二氧化碳,石灰石、大理石用作建筑材料
小结:碳酸钠 、碳酸氢钠、碳酸钙的用途:
名 称 俗 称
(或主要
成分) 主 要 用 途
碳酸钠
碳酸氢钠
碳酸钙
CaCO3 + 2 HCl ===H2CO3 +CaCl2
实验室制取CO2的反应原理
写出它们反应的化学方程式。
【回顾】
二、碳酸钠、碳酸氢钠和碳酸钙化学性质
(盐酸腐蚀含碳酸钙的建材)
生活中还有哪些盐能与盐酸反应产生二氧化碳气体?
CaCO3与Na2CO3和NaHCO3的组成相似,推断Na2CO3和NaHCO3能否与稀盐酸反应?
实验11-1
白色固体消失,迅速产生大量气泡,澄清的石灰水变浑浊
碳酸钠(或碳酸氢钠)与盐酸反应生成了CO2气体
讨论:
Na2CO3 + 2 HCl == 2NaCl + CO2↑+ H2O
NaHCO3 + HCl == NaCl + CO2↑+ H2O
碳酸钠+盐酸 碳酸氢钠+盐酸
现 象
分 析
上述反应中都有CO2和H2O生成,那么反应物在组成上有什么相同点呢?
结论 凡是含有CO32-的盐都能与盐酸反应,
生成二氧化碳气体。
检验方法:取少量样品,加入少量稀盐酸,若有气体生成,将气体通入澄清石灰水中。观察现象。
现象 澄清石灰水变浑浊
【想一想】
讨论:
Na2CO3+ Ca(OH)2= 2NaOH + CaCO3 ↓
产生白色沉淀
生成了不溶于水的碳酸钙
实验11-2 向盛有少量Na2CO3溶液的试管里滴入澄清石灰水,观察现象。
现象
分析
2、从物质种类和反应的变化方式来看上述反应有什么特点?
1、 反应物通过什么方式变成了生成物? ??? ??
三、复分解反应
1 .定义 两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应 。
2.表达式 A B + C D→ A D+ C B
Na2CO3+ Ca(OH)2= 2NaOH + CaCO3 ↓
思考:
今天我知道了……
我学会了……
我还收获了……
课堂小结:
1、下列关于物质用途的说法中,错误的是( )
A.碳酸钙用作补钙剂
B.碳酸氢钠用于焙制糕点
C.纯碱溶液用于除水垢
D.食盐用作调味品
C
2、将珍珠放入稀盐酸中,有气泡产生,生成的气体能使澄清的石灰水变浑浊,则珍珠中含有下列离子中的( )。
C
A、氯离子 B、硫酸根离子
C、碳酸根离子 D、氢氧根离子
D
3、下列化学反应属复分解反应的是
生活中常见的盐
第一课时
生活中常见的盐
1.了解氯化钠、碳酸钠、碳酸氢钠和碳酸钙的组成及其在生活中的主要用途。
2.学习分离、提纯固体混合物的方法。
4.会判断复分解反应的类型。
3.掌握碳酸根离子的检验方法。
生活中常见的盐
判断:食盐属于化学中的盐吗?为什么?
盐是由 和 构成的一类化合物。
食盐是由Na+ 和Cl-构成的化合物;
金属离子
酸根离子
厨师将工业用盐误作食盐工人进医院
石家庄37人中毒
新闻事件
碳酸钙
碳酸氢钠
碳酸钠
Na2CO3
CaCO3
NaHCO3
苏打
用于生产玻璃、造纸、纺织、洗涤剂
发酵粉主要成分治疗胃酸过多
建筑材料、补钙剂
小苏打
纯碱
苏打
食盐
名称 俗称 主 要 用 途
氯化钠(NaCl)
碳酸钠(Na2CO3)
碳酸氢钠(NaHCO3)
碳酸钙(CaCO3) 大理石、石灰石的主要成分
4、食盐的晒制:
5、粗盐的提纯
[讨论与交流]
粗盐中含有较多的可溶性杂质(氯化镁、氯化钙)和不溶性杂质(泥沙等)。其中的不溶性杂质怎么除去呢?
5、粗盐的提纯
粗盐
(NaCl、CaCl2、MgCl2、泥沙)
①
加水溶解
②
过滤
滤纸
泥沙
滤液
蒸发
③
NaCl、CaCl2、MgCl2
NaCl、CaCl2、MgCl2
二、碳酸钠用途
碳酸氢钠用途
碳酸钙用途
纯碱
苏打
小苏打
大理石
石灰石
用于生产玻璃、造纸、纺织、洗涤剂
发酵粉的主要成分之一,
治疗胃酸过多症的药剂
可作补钙剂,用于实验室制取二氧化碳,石灰石、大理石用作建筑材料
小结:碳酸钠 、碳酸氢钠、碳酸钙的用途:
名 称 俗 称
(或主要
成分) 主 要 用 途
碳酸钠
碳酸氢钠
碳酸钙
CaCO3 + 2 HCl ===H2CO3 +CaCl2
实验室制取CO2的反应原理
写出它们反应的化学方程式。
【回顾】
二、碳酸钠、碳酸氢钠和碳酸钙化学性质
(盐酸腐蚀含碳酸钙的建材)
生活中还有哪些盐能与盐酸反应产生二氧化碳气体?
CaCO3与Na2CO3和NaHCO3的组成相似,推断Na2CO3和NaHCO3能否与稀盐酸反应?
实验11-1
白色固体消失,迅速产生大量气泡,澄清的石灰水变浑浊
碳酸钠(或碳酸氢钠)与盐酸反应生成了CO2气体
讨论:
Na2CO3 + 2 HCl == 2NaCl + CO2↑+ H2O
NaHCO3 + HCl == NaCl + CO2↑+ H2O
碳酸钠+盐酸 碳酸氢钠+盐酸
现 象
分 析
上述反应中都有CO2和H2O生成,那么反应物在组成上有什么相同点呢?
结论 凡是含有CO32-的盐都能与盐酸反应,
生成二氧化碳气体。
检验方法:取少量样品,加入少量稀盐酸,若有气体生成,将气体通入澄清石灰水中。观察现象。
现象 澄清石灰水变浑浊
【想一想】
讨论:
Na2CO3+ Ca(OH)2= 2NaOH + CaCO3 ↓
产生白色沉淀
生成了不溶于水的碳酸钙
实验11-2 向盛有少量Na2CO3溶液的试管里滴入澄清石灰水,观察现象。
现象
分析
2、从物质种类和反应的变化方式来看上述反应有什么特点?
1、 反应物通过什么方式变成了生成物? ??? ??
三、复分解反应
1 .定义 两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应 。
2.表达式 A B + C D→ A D+ C B
Na2CO3+ Ca(OH)2= 2NaOH + CaCO3 ↓
思考:
今天我知道了……
我学会了……
我还收获了……
课堂小结:
1、下列关于物质用途的说法中,错误的是( )
A.碳酸钙用作补钙剂
B.碳酸氢钠用于焙制糕点
C.纯碱溶液用于除水垢
D.食盐用作调味品
C
2、将珍珠放入稀盐酸中,有气泡产生,生成的气体能使澄清的石灰水变浑浊,则珍珠中含有下列离子中的( )。
C
A、氯离子 B、硫酸根离子
C、碳酸根离子 D、氢氧根离子
D
3、下列化学反应属复分解反应的是
同课章节目录
