第一节质量守恒定律课件 (共49张PPT)
文档属性
| 名称 | 第一节质量守恒定律课件 (共49张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-02 09:21:11 | ||
图片预览





文档简介
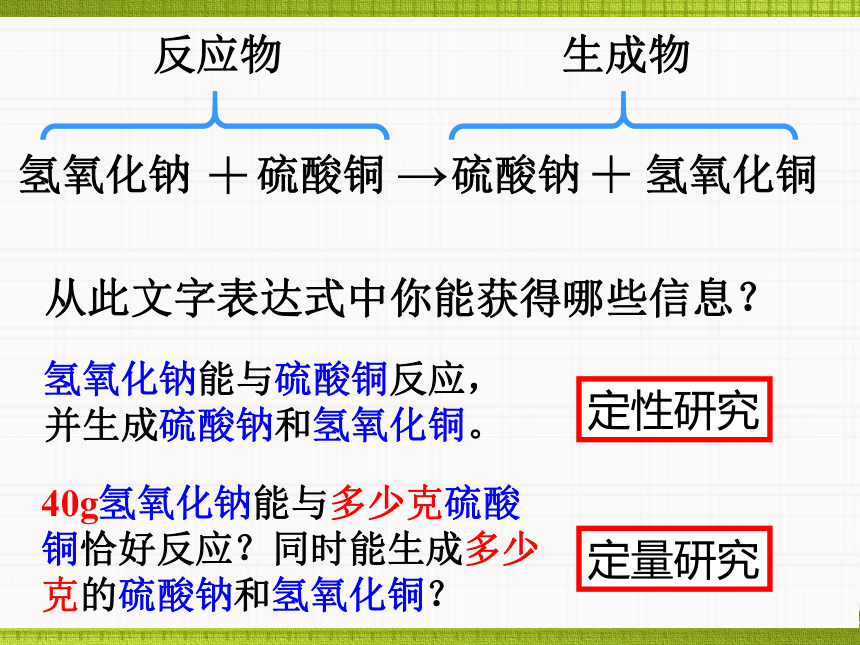
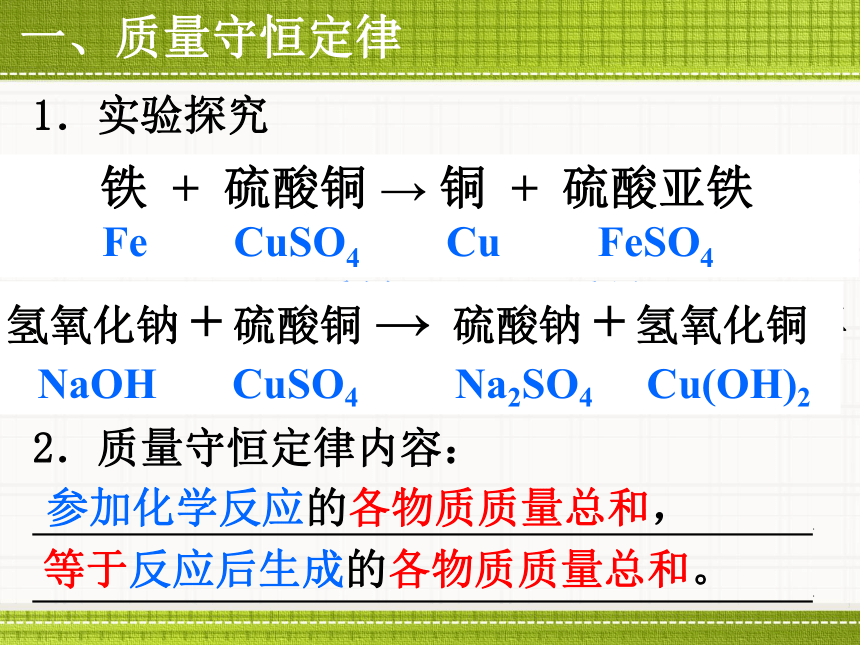
课件49张PPT。氢氧化钠 硫酸铜 硫酸钠 氢氧化铜反应物生成物从此文字表达式中你能获得哪些信息?氢氧化钠能与硫酸铜反应,并生成硫酸钠和氢氧化铜。定性研究定量研究40g氢氧化钠能与多少克硫酸铜恰好反应?同时能生成多少克的硫酸钠和氢氧化铜?第7章 化学反应的定量研究11.通过观察实验,思考分析,能说明常见化学反应中的质量关系,能利用化学反应中的质量关系计算其中某物质质量。
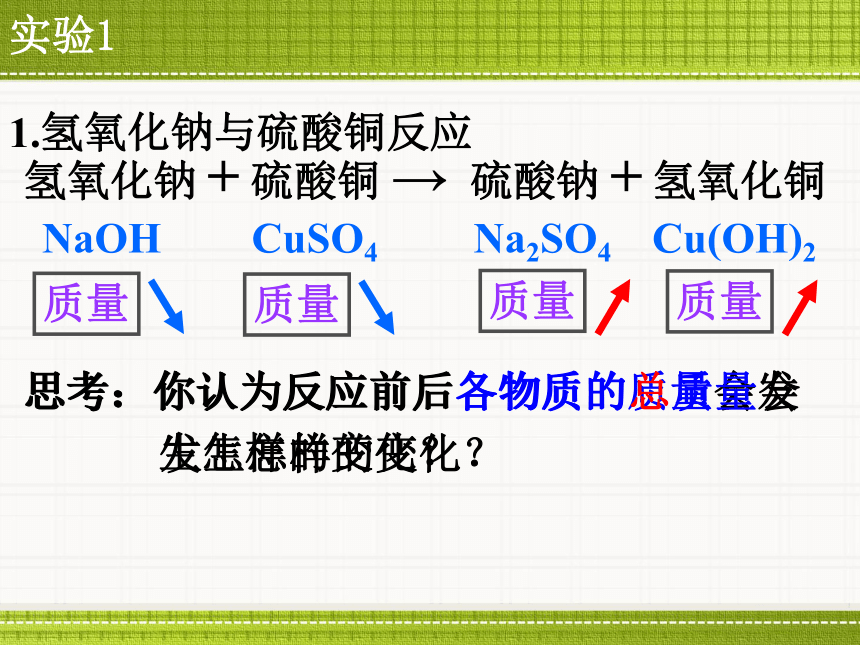
课时目标思考:你认为反应前后各物质的质量会发生怎样的变化?NaOHCuSO4Na2SO4Cu(OH)21.氢氧化钠与硫酸铜反应质量质量质量质量思考:你认为反应前后各物质的总质量会发生怎样的变化?实验1观察反应前后所称量质量的变化NaOHCuSO4Na2SO4Cu(OH)2 1.氢氧化钠与硫酸铜反应观察实验反应前后各物质的质量关系:参加反
应的
NaOH
质量NaOHCuSO4Na2SO4Cu(OH)2反应生
成的
Na2SO4
质量参加反
应的
CuSO4
质量反应生
成的
Cu(OH)2
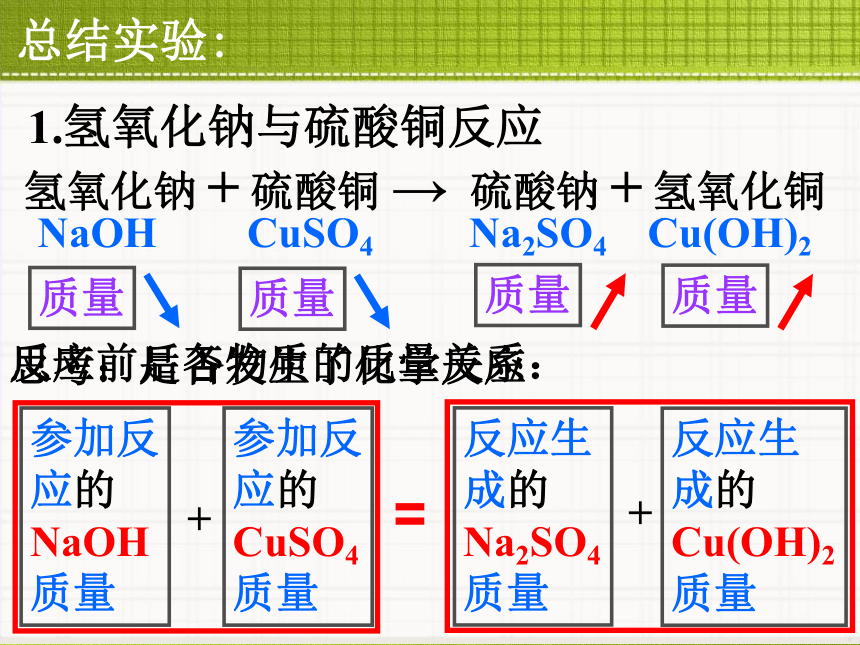
质量总结实验:
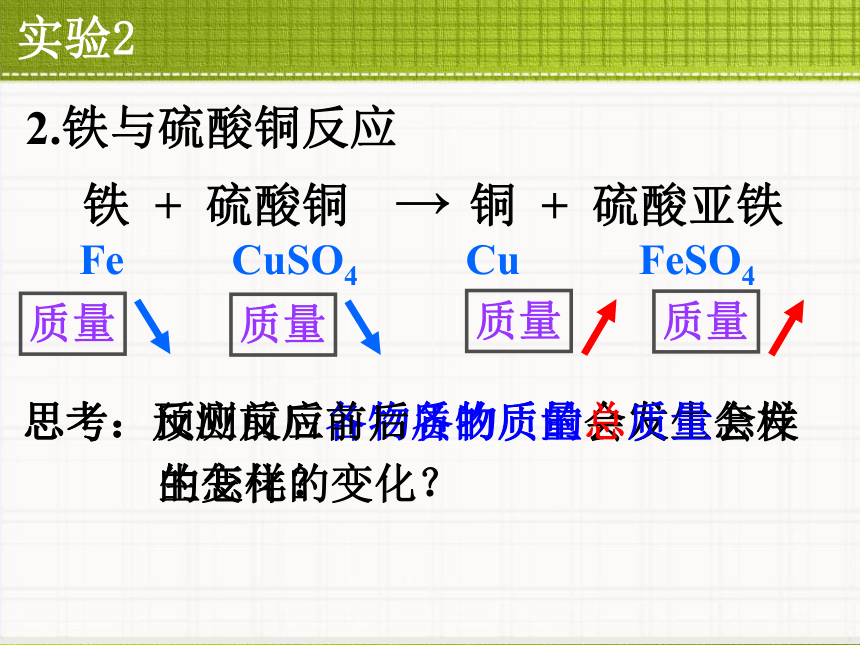
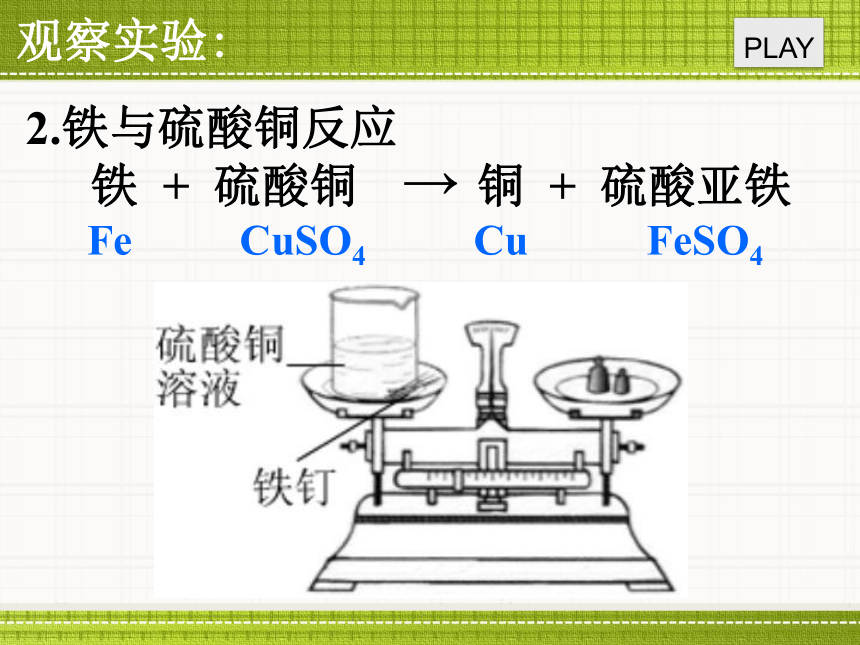
1.氢氧化钠与硫酸铜反应思考:是否发生了化学反应质量质量质量质量实验22.铁与硫酸铜反应Fe CuSO4 Cu FeSO4质量质量质量质量思考:反应前后各物质的质量会发生怎样的变化?思考:预测反应前后各物质的总质量会发生怎样的变化?观察实验:
PLAY2.铁与硫酸铜反应Fe CuSO4 Cu FeSO4参加反应的 反应生
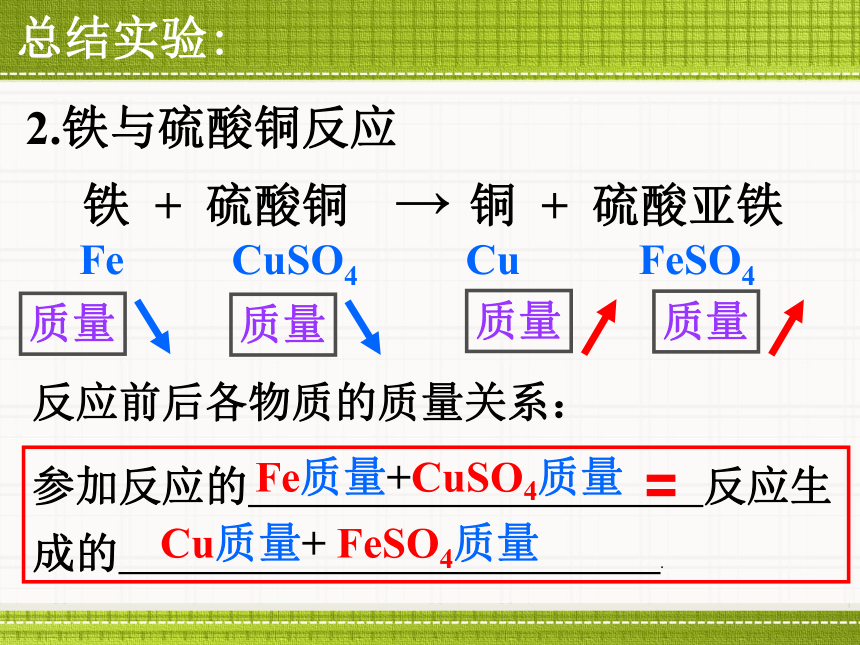
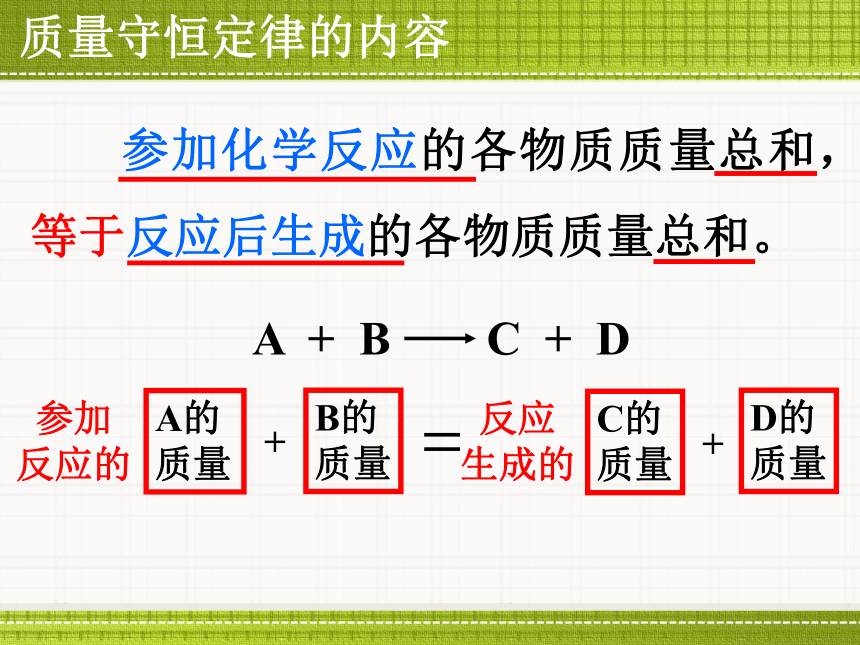
成的 .总结实验:2.铁与硫酸铜反应反应前后各物质的质量关系:Fe质量+CuSO4质量Fe CuSO4 Cu FeSO4Cu质量+ FeSO4质量质量质量质量质量第7章 化学反应的定量研究第1节 质量守恒定律质量守恒定律的内容 参加化学反应的各物质质量总和,等于反应后生成的各物质质量总和。A + B C + DA的
质量参加
反应的B的
质量+ C的
质量+D的
质量反应
生成的(1)参加反应的NaOH质量+CuSO4质量 反应生成的Na2SO4质量+Cu(OH)2质量1.实验探究(2)参加反应的 反应生成的 .Fe质量Cu质量2.质量守恒定律内容:
.
.参加化学反应的各物质质量总和,一、质量守恒定律+ FeSO4质量+CuSO4质量等于反应后生成的各物质质量总和。导学案:独立完成导学案37页:
实验探究
质量守恒定律内容(1)参加反应的NaOH质量+CuSO4质量 反应生成的Na2SO4质量+Cu(OH)2质量1.实验探究(2)参加反应的 反应生成的 .Fe质量+CuSO4质量Cu质量+ FeSO4质量2.质量守恒定律内容:
.
.参加化学反应的各物质质量总和,等于反应后生成的各物质质量总和。练习:完成导学案38页评价习题1、2一、质量守恒定律评价习题1.在氢氧化钠 + 硫酸铜 → 硫酸钠+ 氢氧化铜
的反应中,40g氢氧化钠和一定量的硫酸铜恰好
完全反应,生成71g硫酸钠和49g氢氧化铜,则
硫酸铜的质量是 。
氢氧化钠 + 硫酸铜 → 硫酸钠 + 氢氧化铜2.密闭容器内有A、B、C三种物质, 在一定条件下 充分反应,反应前后各物质质量如下:质量守恒定律的内容A + B + C D + E + Fm(A) + m(B) + m(C) m(D) + m(E) + m(F)m(A) + m(B) + m(C) m(D) + m(E)> 参加化学反应的各物质质量总和,等于反应后生成的各物质质量总和。观察实验PLAY观察实验PLAY思考:
为什么此反应前后称量的总质量不相等?依据质量守恒定律,反应前后质量关系:参加反应的
Na2CO3质量+盐酸质量 反应生成的
NaCl质量+ H2O质量 + CO2质量逸散到空气中NaCl和H2O的总质量总结实验:一切化学反应都遵守质量守恒定律思考:质量守恒定律是否适用于此化学反应?质量守恒定律适用范围: 参加化学反应的各物质质量总和,
等于反应后生成的各物质质量总和。如何改进实验装置,使得能利用此反应来验证质量守恒定律?使用密闭装置思考:为什么上述这两个实验没有使用密闭装置,
反应前后总质量也不变呢?没有气体参加或生成1氢氧化钠 + 硫酸铜 → 硫酸钠 + 氢氧化铜气体质量的推算:反应前后质量关系:CO2质量 =(Na2CO3质量+盐酸质量) -(NaCl质量+H2O质量) =反应前后质量差参加反应的
Na2CO3质量+盐酸质量 反应生成的
NaCl质量+ H2O质量 + CO2质量气体质量的推算:106g 73g 117g 18g ? CO2质量 =(Na2CO3质量+盐酸质量) -(NaCl质量+H2O质量) =反应前后质量差参加反应的
Na2CO3质量+盐酸质量 反应生成的
NaCl质量+ H2O质量 + CO2质量(106g+73g)(117g+18g)44g有气体参与或生成的敞口装置中,反应前后总质量之差=气体质量 都遵循质量守恒定律。
3.质量守恒定律适用范围:反应前后质量关系:
.
.参加反应的Na2CO3质量+盐酸质量 +H2O质量 + CO2质量CO2质量= .
.
..(参加反应的Na2CO3质量+ 盐酸质量) (反应生成的NaCl质量+ H2O质量) -=反应前后质量差一切化学反应导学案:独立完成导学案37页:
3.质量守恒定律适用范围:3.质量守恒定律适用范围: 都遵循质量守恒定律。
反应前后质量关系:
.
.参加反应的Na2CO3质量+盐酸质量 +H2O质量 + CO2质量CO2质量= .
.
..(参加反应的Na2CO3质量+ 盐酸质量) (反应生成的NaCl质量+ H2O质量) -=反应前后质量差一切化学反应小结1.质量守恒定律内容:
.
.参加化学反应的各物质质量总和,等于反应后生成的各物质质量总和。 都遵循质量守恒定律。
2.质量守恒定律适用范围:一切化学反应3.有气体参与或生成的敞口装置中,反应前后总质量之差= 气体质量 以上2个实验能验证质量守恒定律的是
(填序号)2016北京中考点燃蜡烛后,电子秤示数逐渐减小。
蜡烛减小的质量 (填“大于”“等于”或“小于”)燃烧后生成物的总质量。若在某造纸厂废水中加入稀硫酸能反应生成二氧化碳,实验小组做如下实验:
取废水100g,向其中加入稀硫酸50g,反应后所得剩余物质总质量是147.8g。生成二氧化碳的质量是_____g。 思考:你能用质量守恒
定律分析电解水这个化学
反应吗?参加反应的
H2O的质量生成的
H2质量=生成的
O2质量+Why?参加反应的
H2O的质量生成的
H2质量=生成的
O2质量+Why?物质元素组成该元素所有原子统称总质量
?总质量
?宏观微观解释总质量11.通过思考分析,能说出质量守恒定律微观解释,判断反应前后各量关系。
课时目标+例:水通电分解生成氧气和氢气的变化用下图表示水分子
( 个)氢原子
( 个)氧原子
( 个)氧分子
( 个)氢分子
( 个)+48424质量守恒定律微观解释 4H2O2O24H2+例:水通电分解生成氧气和氢气的变化用下图表示质量守恒定律微观解释 反应前反应后4H2O2O24H2+例:水通电分解生成氧气和氢气的变化用下图表示反应前原子种类 .原子个数 .原子质量 .不变不变不变质量守恒定律微观解释 相对原子质量:H O 原子 原子 个反应后 个8氢4氧116相对原子质量:H O 原子 原子 个 个8氢4氧1164H2O2O24H2+例:水通电分解生成氧气和氢气的变化用下图表示反应前原子种类 .原子个数 .原子质量 .不变不变不变质量守恒定律微观解释 相对原子质量:H O 原子 原子 个反应后 个8氢4氧116相对原子质量:H O 原子 原子 个 个8氢4氧116元素种类 .元素质量 .不变不变 元素 元素氢氧质量 质量 4H2O2O24H21×816×4 元素 元素氢氧质量 质量 1×816×4物质总质量 .不变 —氧原子+ —氢原子例:水通电分解生成氧气和氢气的变化用下图表示物质总质量不变不
变不变微观三不变宏观三不变原子质量原子个数原子种类元素种类元素质量不变 ;化学反应前后: ; ; ; ; ; ; 宏观
三不变:微观
三不变:原子质量原子个数原子种类物质总质量元素种类元素质量+水分子氢原子氧原子氧分子氢分子+ ;化学反应前后: ; ; ; ; ; ; 宏观
三不变微观
三不变原子质量原子个数原子种类物质总质量元素种类元素质量+水分子氢原子氧原子氧分子氢分子+ 完成学案37页: —氧原子+ —氢原子例:水通电分解生成氧气和氢气的变化用下图表示水分子
( 个)氢原子
( 个)氧原子
( 个)氧分子
( 个)氢分子
( 个)+48424反应前后:
(填“改变”或“不变”)物质种类 ,分子种类 .改变改变思考:化学反应前后什么改变? —氧原子+ —氢原子例:水通电分解生成氧气和氢气的变化用下图表示水分子
( 个)氢原子
( 个)氧原子
( 个)氧分子
( 个)氢分子
( 个)+48424反应前后:
(填“改变”或“不变”)分子个数 .改变反应前后,分子个数一定改变吗?分子个数可能改变、可能不变此反应前后:
(填“改变”或“不变”)分子个数 .不变+可能改变、可能不变: 。化学反应前后: ; ;一定改变分子种类物质种类分子个数可能改变、可能不变: 。化学反应前后: ; ;一定改变分子种类物质种类分子个数完成导学案38页:完成学案38页:评价习题3、43.化学反应前后一定没有变化的是( )
①物质种类 ②元素种类 ③分子种类
④原子种类 ⑤分子数目
⑥原子数目 ⑦物质的总质量
A.①②⑤⑥⑦ B.②③④⑤⑥
C.②④⑥⑦ D.①②④⑤⑥⑦ 4.植物的光合作用可表示为:
二氧化碳 + 水 淀粉 + 氧气,
则生成的淀粉中一定含有的元素为 ,
可能含有的元素为 。 光叶绿体
课时目标思考:你认为反应前后各物质的质量会发生怎样的变化?NaOHCuSO4Na2SO4Cu(OH)21.氢氧化钠与硫酸铜反应质量质量质量质量思考:你认为反应前后各物质的总质量会发生怎样的变化?实验1观察反应前后所称量质量的变化NaOHCuSO4Na2SO4Cu(OH)2 1.氢氧化钠与硫酸铜反应观察实验反应前后各物质的质量关系:参加反
应的
NaOH
质量NaOHCuSO4Na2SO4Cu(OH)2反应生
成的
Na2SO4
质量参加反
应的
CuSO4
质量反应生
成的
Cu(OH)2
质量总结实验:
1.氢氧化钠与硫酸铜反应思考:是否发生了化学反应质量质量质量质量实验22.铁与硫酸铜反应Fe CuSO4 Cu FeSO4质量质量质量质量思考:反应前后各物质的质量会发生怎样的变化?思考:预测反应前后各物质的总质量会发生怎样的变化?观察实验:
PLAY2.铁与硫酸铜反应Fe CuSO4 Cu FeSO4参加反应的 反应生
成的 .总结实验:2.铁与硫酸铜反应反应前后各物质的质量关系:Fe质量+CuSO4质量Fe CuSO4 Cu FeSO4Cu质量+ FeSO4质量质量质量质量质量第7章 化学反应的定量研究第1节 质量守恒定律质量守恒定律的内容 参加化学反应的各物质质量总和,等于反应后生成的各物质质量总和。A + B C + DA的
质量参加
反应的B的
质量+ C的
质量+D的
质量反应
生成的(1)参加反应的NaOH质量+CuSO4质量 反应生成的Na2SO4质量+Cu(OH)2质量1.实验探究(2)参加反应的 反应生成的 .Fe质量Cu质量2.质量守恒定律内容:
.
.参加化学反应的各物质质量总和,一、质量守恒定律+ FeSO4质量+CuSO4质量等于反应后生成的各物质质量总和。导学案:独立完成导学案37页:
实验探究
质量守恒定律内容(1)参加反应的NaOH质量+CuSO4质量 反应生成的Na2SO4质量+Cu(OH)2质量1.实验探究(2)参加反应的 反应生成的 .Fe质量+CuSO4质量Cu质量+ FeSO4质量2.质量守恒定律内容:
.
.参加化学反应的各物质质量总和,等于反应后生成的各物质质量总和。练习:完成导学案38页评价习题1、2一、质量守恒定律评价习题1.在氢氧化钠 + 硫酸铜 → 硫酸钠+ 氢氧化铜
的反应中,40g氢氧化钠和一定量的硫酸铜恰好
完全反应,生成71g硫酸钠和49g氢氧化铜,则
硫酸铜的质量是 。
氢氧化钠 + 硫酸铜 → 硫酸钠 + 氢氧化铜2.密闭容器内有A、B、C三种物质, 在一定条件下 充分反应,反应前后各物质质量如下:质量守恒定律的内容A + B + C D + E + Fm(A) + m(B) + m(C) m(D) + m(E) + m(F)m(A) + m(B) + m(C) m(D) + m(E)> 参加化学反应的各物质质量总和,等于反应后生成的各物质质量总和。观察实验PLAY观察实验PLAY思考:
为什么此反应前后称量的总质量不相等?依据质量守恒定律,反应前后质量关系:参加反应的
Na2CO3质量+盐酸质量 反应生成的
NaCl质量+ H2O质量 + CO2质量逸散到空气中NaCl和H2O的总质量总结实验:一切化学反应都遵守质量守恒定律思考:质量守恒定律是否适用于此化学反应?质量守恒定律适用范围: 参加化学反应的各物质质量总和,
等于反应后生成的各物质质量总和。如何改进实验装置,使得能利用此反应来验证质量守恒定律?使用密闭装置思考:为什么上述这两个实验没有使用密闭装置,
反应前后总质量也不变呢?没有气体参加或生成1氢氧化钠 + 硫酸铜 → 硫酸钠 + 氢氧化铜气体质量的推算:反应前后质量关系:CO2质量 =(Na2CO3质量+盐酸质量) -(NaCl质量+H2O质量) =反应前后质量差参加反应的
Na2CO3质量+盐酸质量 反应生成的
NaCl质量+ H2O质量 + CO2质量气体质量的推算:106g 73g 117g 18g ? CO2质量 =(Na2CO3质量+盐酸质量) -(NaCl质量+H2O质量) =反应前后质量差参加反应的
Na2CO3质量+盐酸质量 反应生成的
NaCl质量+ H2O质量 + CO2质量(106g+73g)(117g+18g)44g有气体参与或生成的敞口装置中,反应前后总质量之差=气体质量 都遵循质量守恒定律。
3.质量守恒定律适用范围:反应前后质量关系:
.
.参加反应的Na2CO3质量+盐酸质量 +H2O质量 + CO2质量CO2质量= .
.
..(参加反应的Na2CO3质量+ 盐酸质量) (反应生成的NaCl质量+ H2O质量) -=反应前后质量差一切化学反应导学案:独立完成导学案37页:
3.质量守恒定律适用范围:3.质量守恒定律适用范围: 都遵循质量守恒定律。
反应前后质量关系:
.
.参加反应的Na2CO3质量+盐酸质量 +H2O质量 + CO2质量CO2质量= .
.
..(参加反应的Na2CO3质量+ 盐酸质量) (反应生成的NaCl质量+ H2O质量) -=反应前后质量差一切化学反应小结1.质量守恒定律内容:
.
.参加化学反应的各物质质量总和,等于反应后生成的各物质质量总和。 都遵循质量守恒定律。
2.质量守恒定律适用范围:一切化学反应3.有气体参与或生成的敞口装置中,反应前后总质量之差= 气体质量 以上2个实验能验证质量守恒定律的是
(填序号)2016北京中考点燃蜡烛后,电子秤示数逐渐减小。
蜡烛减小的质量 (填“大于”“等于”或“小于”)燃烧后生成物的总质量。若在某造纸厂废水中加入稀硫酸能反应生成二氧化碳,实验小组做如下实验:
取废水100g,向其中加入稀硫酸50g,反应后所得剩余物质总质量是147.8g。生成二氧化碳的质量是_____g。 思考:你能用质量守恒
定律分析电解水这个化学
反应吗?参加反应的
H2O的质量生成的
H2质量=生成的
O2质量+Why?参加反应的
H2O的质量生成的
H2质量=生成的
O2质量+Why?物质元素组成该元素所有原子统称总质量
?总质量
?宏观微观解释总质量11.通过思考分析,能说出质量守恒定律微观解释,判断反应前后各量关系。
课时目标+例:水通电分解生成氧气和氢气的变化用下图表示水分子
( 个)氢原子
( 个)氧原子
( 个)氧分子
( 个)氢分子
( 个)+48424质量守恒定律微观解释 4H2O2O24H2+例:水通电分解生成氧气和氢气的变化用下图表示质量守恒定律微观解释 反应前反应后4H2O2O24H2+例:水通电分解生成氧气和氢气的变化用下图表示反应前原子种类 .原子个数 .原子质量 .不变不变不变质量守恒定律微观解释 相对原子质量:H O 原子 原子 个反应后 个8氢4氧116相对原子质量:H O 原子 原子 个 个8氢4氧1164H2O2O24H2+例:水通电分解生成氧气和氢气的变化用下图表示反应前原子种类 .原子个数 .原子质量 .不变不变不变质量守恒定律微观解释 相对原子质量:H O 原子 原子 个反应后 个8氢4氧116相对原子质量:H O 原子 原子 个 个8氢4氧116元素种类 .元素质量 .不变不变 元素 元素氢氧质量 质量 4H2O2O24H21×816×4 元素 元素氢氧质量 质量 1×816×4物质总质量 .不变 —氧原子+ —氢原子例:水通电分解生成氧气和氢气的变化用下图表示物质总质量不变不
变不变微观三不变宏观三不变原子质量原子个数原子种类元素种类元素质量不变 ;化学反应前后: ; ; ; ; ; ; 宏观
三不变:微观
三不变:原子质量原子个数原子种类物质总质量元素种类元素质量+水分子氢原子氧原子氧分子氢分子+ ;化学反应前后: ; ; ; ; ; ; 宏观
三不变微观
三不变原子质量原子个数原子种类物质总质量元素种类元素质量+水分子氢原子氧原子氧分子氢分子+ 完成学案37页: —氧原子+ —氢原子例:水通电分解生成氧气和氢气的变化用下图表示水分子
( 个)氢原子
( 个)氧原子
( 个)氧分子
( 个)氢分子
( 个)+48424反应前后:
(填“改变”或“不变”)物质种类 ,分子种类 .改变改变思考:化学反应前后什么改变? —氧原子+ —氢原子例:水通电分解生成氧气和氢气的变化用下图表示水分子
( 个)氢原子
( 个)氧原子
( 个)氧分子
( 个)氢分子
( 个)+48424反应前后:
(填“改变”或“不变”)分子个数 .改变反应前后,分子个数一定改变吗?分子个数可能改变、可能不变此反应前后:
(填“改变”或“不变”)分子个数 .不变+可能改变、可能不变: 。化学反应前后: ; ;一定改变分子种类物质种类分子个数可能改变、可能不变: 。化学反应前后: ; ;一定改变分子种类物质种类分子个数完成导学案38页:完成学案38页:评价习题3、43.化学反应前后一定没有变化的是( )
①物质种类 ②元素种类 ③分子种类
④原子种类 ⑤分子数目
⑥原子数目 ⑦物质的总质量
A.①②⑤⑥⑦ B.②③④⑤⑥
C.②④⑥⑦ D.①②④⑤⑥⑦ 4.植物的光合作用可表示为:
二氧化碳 + 水 淀粉 + 氧气,
则生成的淀粉中一定含有的元素为 ,
可能含有的元素为 。 光叶绿体
同课章节目录
- 第1章 走进化学
- 第一节 化学让世界更美好
- 第二节 实验是化学的基础
- 第2章 空气之谜
- 第一节 空气
- 第二节 氧气的制法
- 第三节 氧气的性质
- 第3章 构成物质的微粒
- 第一节 原子
- 第二节 原子核外电子的排布 离子
- 第三节 分子
- 第4章 最常见的液体——水
- 第一节 水的净化
- 第二节 水的变化
- 第三节 水资源的开发、利用和保护
- 第5章 化学元素与物质组成的表示
- 第一节 初步认识化学元素
- 第二节 物质组成的表示——化学式
- 第三节 化合价
- 第6章 燃烧的学问
- 第一节 探索燃烧与灭火
- 第二节 化学反应中的能量变化
- 第三节 化石燃料
- 第7章 化学反应的定量研究
- 第一节 质量守恒定律
- 第二节 化学方程式
- 第三节 依据化学方程式的简单计算
- 第8章 碳的世界
- 第一节 碳的单质
- 第二节 二氧化碳的性质和用途
- 第三节 二氧化碳的实验室制法
