课题3 溶液的浓度(共26张PPT)
图片预览






文档简介
课件26张PPT。课题3:溶液的浓度 你知道下面瓶中标签是什么意思吗?化学纯 500mL
浓盐酸(HCl)
含HCl 37 %
密度为1.18 g/cm3
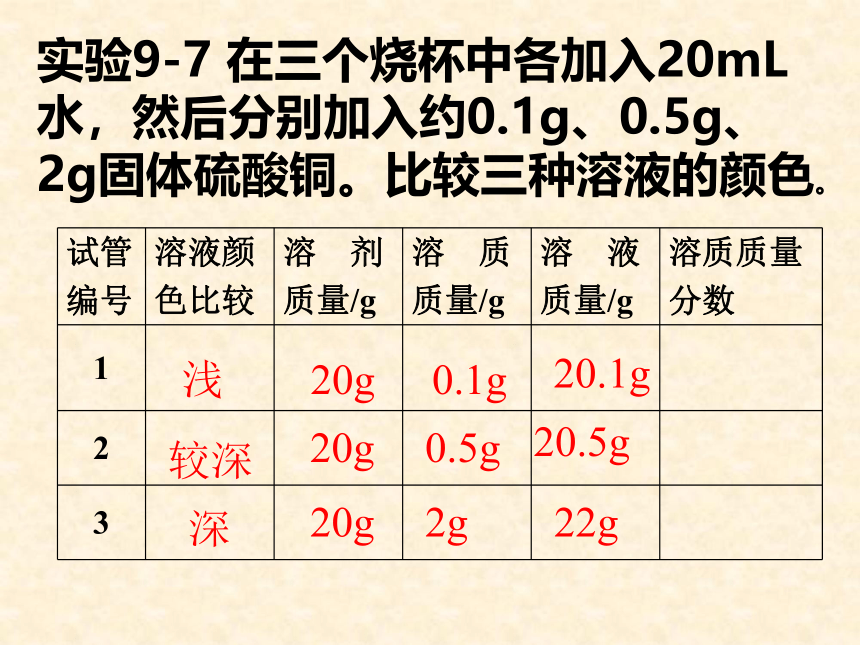
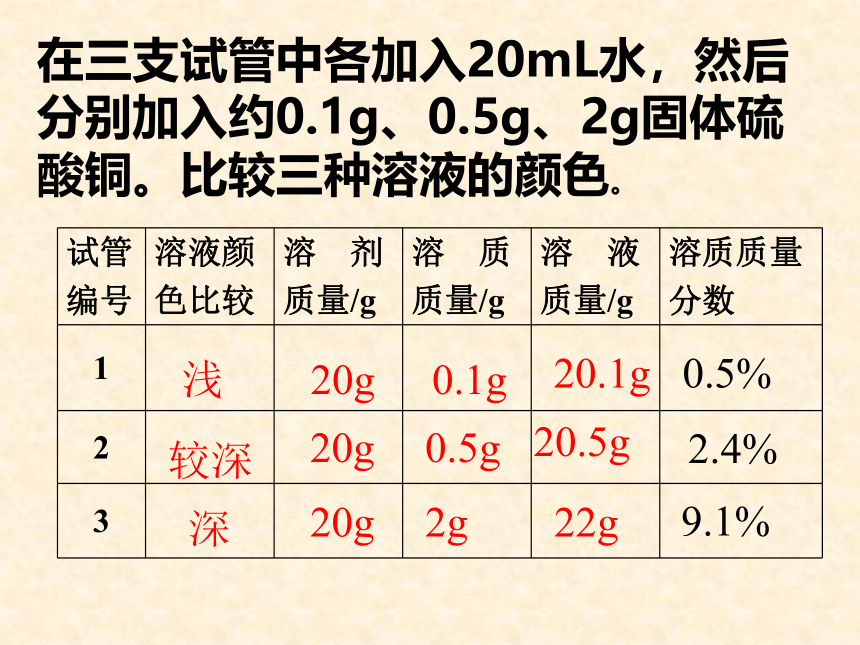
下面我们就来学习溶液组成的表示方法。想一想1、给你两碗白糖水,你如何判断哪个白糖浓度大呢?尝甜度,越甜的浓度越大2、展示三只不同的硫酸铜溶液,哪只试管中硫酸铜浓度大?颜色越深,,硫酸铜浓度越大实验9-7 在三个烧杯中各加入20mL水,然后分别加入约0.1g、0.5g、2g固体硫酸铜。比较三种溶液的颜色。浅较深深20g20g20g0.1g0.5g2g20.1g20.5g22g变式训练(1)溶质质量= 。
溶液质量= 。
(2)溶液质量= 质量+ 质量
溶剂质量= 质量- 质量
(3)如果已知溶液密度ρ和体积V,那么
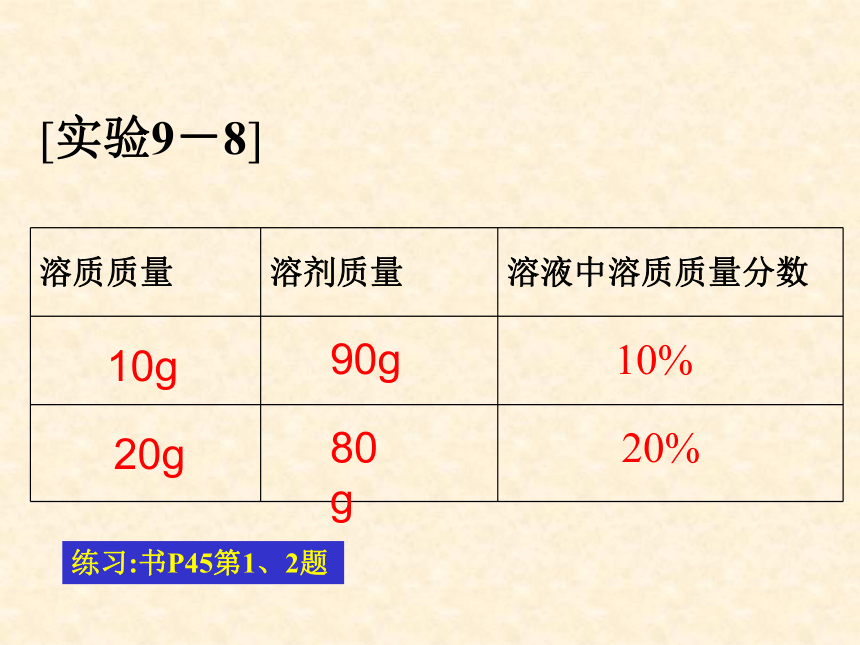
溶液质量= 。溶液质量×溶质的质量分数溶质质量÷溶质的质量分数溶剂溶质溶液溶质ρV在三支试管中各加入20mL水,然后分别加入约0.1g、0.5g、2g固体硫酸铜。比较三种溶液的颜色。浅较深深20g20g20g0.1g0.5g2g20.1g20.5g22g0.5%2.4%9.1%[实验9-8]10g20g90g80g10%20%练习:书P45第1、2题 溶质质量分数的含义: 5 % 的食盐溶液
①.5g食盐溶于95g水形成的溶液。
②.食盐的质量占整个食盐溶液的5%。
③.将100g食盐溶液蒸干可以得到食盐5g。
④.组成:M(食盐):M(水):M(食盐溶液) =
5 : 95 : 100
溶质质量溶液质量 P43讨论、已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。 解:20℃时食盐饱和溶液的溶质质量分数为=26.5%36g100g+36g答:略 例1、在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150Kg这种溶液,需要氯化钠和水的质量各是多少?解:迁移应用5:现有100mL质量分数为38%的浓盐酸溶液(密度1.2g/mL),计算该盐酸中含溶质(氯化氢)的质量是多少?解:溶液的质量=ρV=1.2g/mL×100mL=120g溶质的质量=溶液的质量×溶质的质量分数=120g×38%=45.6g答:该盐酸中含溶质质量为45.6g6、若实验需要20g氢氧化钠来吸收有毒的二氧化硫气体,则至少需要10%的氢氧化钠溶液的质量是多少?解:
溶液的质量=溶质的质量÷溶质的质量分数=20g÷10%=200g答:至少需要10%的氢氧化钠溶液200g导学目标2:有关溶液稀释计算讨论交流:
一杯40g30%浓糖水加入20g水,下列各项内容都会发生变化吗?28g12g40g30%48g12g60g20%结论:
(1)m浓×c浓%= m稀×c稀%
溶液稀释前后溶质的质量不变
(2)m稀溶液-m浓溶液=m加水
即稀释后溶液增加的质量是水的质量。 例题2 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。现有50g质量分数为98%的浓硫酸能稀释为质量分数为20%的硫酸溶液多少克?需加水多少克?分析:解决这道题的关键是什么?解:溶液稀释前后溶质的质量不变设稀释后溶液的质量为x。50g× 98%=X × 20% X=245g 答:能稀释为质量分数为20%的硫酸溶液245g,需要水的195g。需加水的质量=245g- 50g=195g小试牛刀:迁移应用2: 1,2【解】设:稀释后溶液的质量为X。100g × 98% = X × 10%X = 980g需要水的质量 = 980g - 100g = 880g答:需要水的质量为880g。练习:1(课本P45)把100g质量分数为98%的浓硫酸
稀释成10%的稀硫酸,需要水的质量是多少? 注意点:溶液是混合物,溶液的质量不能直接代入
化学方程式中计算,必须换算成溶质的质量。例题4:100g 9.8%硫酸跟多少克锌反应?同时生成多少克氢气?解:100g9.8%硫酸中含纯硫酸的质量为:100g?9.8%=9.8g设参加反应的锌质量为X ,生成氢气的质量为YZn + H2SO4 = ZnSO4 + H2?65 98 2X 9.8g YX=6.5g Y=0.2g答:略[题型三]: 有关化学方程式的计算 【课本P45】1: 100g某硫酸溶液恰好与13g锌完全反应,
试计算这种硫酸中溶质的质量分数。【解】 :设这种硫酸中溶质的质量为XZn + H2SO4 = ZnSO4 + H2↑65 9813g X答:这种硫酸溶液中溶质的质量分数为19.6%。【解】 :盐酸中溶质的质量为:73g×20% = 14.6g练习:2(课本P45)73g质量分数为20%的盐酸与足量
大理石反应,生成二氧化碳的质量是多少?
这些二氧化碳的体积(标准状况)是多少?
(在标准状况下,CO2的密度为1.977g/L。)CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O设生成二氧化碳的质量为X73 4414.6g XX = 8.8g二氧化碳的体积 = 8.8g÷1.977g/L = 17.4L答:CO2的质量为8.8g;CO2的体积为17.4L3:6.5g锌和100g一定质量分数的稀硫酸恰好完全反应,求:(1)生成氢气的质量?(2)稀硫酸中溶质的质量分数?(3)生成的硫酸锌溶液中溶质的质量?解:设生成氢气的质量为x,硫酸的质量为y,生成硫酸锌的质量为z Zn+H2SO4 == ZnSO4+H2↑
65 98 161 2
6.5g y z x X= = 0.2g
y= =9.8g
z= =16.1g4:40g10%NaOH溶液跟多少克10%盐酸完全反应?反应后溶液的溶质的质量分数是多少?解:设稀盐酸的质量为X,反应后生成的NaCl的质量为YNaOH + HCl = NaCl + H2O40g?10% X ?10% Y40 36.5 58.5 X = 36.5gY=5.85gNaCl% = 答:略 (NaOH + HCl = NaCl + H2O)溶 液 的 配 置配置步骤:1、计算 2、称量 3、溶解
4、装瓶储存例1: (溶质为固体)配制50g6%的氯化钠溶液 计算:需氯化钠:50 g× 6% = 3 g 需水: 50 g– 3g= 47 g称量:用托盘天平称量 3 g食盐 用量筒量取47mL水溶解:烧杯、玻璃棒 实验仪器:托盘天平(砝码)、药匙、量筒、
胶头滴管、烧杯、玻璃棒、试剂瓶练习:下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。
溶质质量分数与化学方程式的综合计算讨论交流:
在溶液中进行的反应,往往是其中的 参加反应,所以在根据化学方程式列出有关反应物、生成物的质量比时,要用 的质量列比例,而不能用溶液的质量或体积列比例。溶质溶质例如:锌与100g 20%的硫酸溶液完全反应。和锌发生完全反应的是( )A.100g硫酸溶液 B.20g硫酸 C.100g硫酸B3、配制溶质质量分数一定的溶液⑴计算 ⑵称量 ⑶溶解 ⑷装瓶药匙 天平 烧杯 量筒 滴管 玻璃棒M质M质+M剂
浓盐酸(HCl)
含HCl 37 %
密度为1.18 g/cm3
下面我们就来学习溶液组成的表示方法。想一想1、给你两碗白糖水,你如何判断哪个白糖浓度大呢?尝甜度,越甜的浓度越大2、展示三只不同的硫酸铜溶液,哪只试管中硫酸铜浓度大?颜色越深,,硫酸铜浓度越大实验9-7 在三个烧杯中各加入20mL水,然后分别加入约0.1g、0.5g、2g固体硫酸铜。比较三种溶液的颜色。浅较深深20g20g20g0.1g0.5g2g20.1g20.5g22g变式训练(1)溶质质量= 。
溶液质量= 。
(2)溶液质量= 质量+ 质量
溶剂质量= 质量- 质量
(3)如果已知溶液密度ρ和体积V,那么
溶液质量= 。溶液质量×溶质的质量分数溶质质量÷溶质的质量分数溶剂溶质溶液溶质ρV在三支试管中各加入20mL水,然后分别加入约0.1g、0.5g、2g固体硫酸铜。比较三种溶液的颜色。浅较深深20g20g20g0.1g0.5g2g20.1g20.5g22g0.5%2.4%9.1%[实验9-8]10g20g90g80g10%20%练习:书P45第1、2题 溶质质量分数的含义: 5 % 的食盐溶液
①.5g食盐溶于95g水形成的溶液。
②.食盐的质量占整个食盐溶液的5%。
③.将100g食盐溶液蒸干可以得到食盐5g。
④.组成:M(食盐):M(水):M(食盐溶液) =
5 : 95 : 100
溶质质量溶液质量 P43讨论、已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。 解:20℃时食盐饱和溶液的溶质质量分数为=26.5%36g100g+36g答:略 例1、在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150Kg这种溶液,需要氯化钠和水的质量各是多少?解:迁移应用5:现有100mL质量分数为38%的浓盐酸溶液(密度1.2g/mL),计算该盐酸中含溶质(氯化氢)的质量是多少?解:溶液的质量=ρV=1.2g/mL×100mL=120g溶质的质量=溶液的质量×溶质的质量分数=120g×38%=45.6g答:该盐酸中含溶质质量为45.6g6、若实验需要20g氢氧化钠来吸收有毒的二氧化硫气体,则至少需要10%的氢氧化钠溶液的质量是多少?解:
溶液的质量=溶质的质量÷溶质的质量分数=20g÷10%=200g答:至少需要10%的氢氧化钠溶液200g导学目标2:有关溶液稀释计算讨论交流:
一杯40g30%浓糖水加入20g水,下列各项内容都会发生变化吗?28g12g40g30%48g12g60g20%结论:
(1)m浓×c浓%= m稀×c稀%
溶液稀释前后溶质的质量不变
(2)m稀溶液-m浓溶液=m加水
即稀释后溶液增加的质量是水的质量。 例题2 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。现有50g质量分数为98%的浓硫酸能稀释为质量分数为20%的硫酸溶液多少克?需加水多少克?分析:解决这道题的关键是什么?解:溶液稀释前后溶质的质量不变设稀释后溶液的质量为x。50g× 98%=X × 20% X=245g 答:能稀释为质量分数为20%的硫酸溶液245g,需要水的195g。需加水的质量=245g- 50g=195g小试牛刀:迁移应用2: 1,2【解】设:稀释后溶液的质量为X。100g × 98% = X × 10%X = 980g需要水的质量 = 980g - 100g = 880g答:需要水的质量为880g。练习:1(课本P45)把100g质量分数为98%的浓硫酸
稀释成10%的稀硫酸,需要水的质量是多少? 注意点:溶液是混合物,溶液的质量不能直接代入
化学方程式中计算,必须换算成溶质的质量。例题4:100g 9.8%硫酸跟多少克锌反应?同时生成多少克氢气?解:100g9.8%硫酸中含纯硫酸的质量为:100g?9.8%=9.8g设参加反应的锌质量为X ,生成氢气的质量为YZn + H2SO4 = ZnSO4 + H2?65 98 2X 9.8g YX=6.5g Y=0.2g答:略[题型三]: 有关化学方程式的计算 【课本P45】1: 100g某硫酸溶液恰好与13g锌完全反应,
试计算这种硫酸中溶质的质量分数。【解】 :设这种硫酸中溶质的质量为XZn + H2SO4 = ZnSO4 + H2↑65 9813g X答:这种硫酸溶液中溶质的质量分数为19.6%。【解】 :盐酸中溶质的质量为:73g×20% = 14.6g练习:2(课本P45)73g质量分数为20%的盐酸与足量
大理石反应,生成二氧化碳的质量是多少?
这些二氧化碳的体积(标准状况)是多少?
(在标准状况下,CO2的密度为1.977g/L。)CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O设生成二氧化碳的质量为X73 4414.6g XX = 8.8g二氧化碳的体积 = 8.8g÷1.977g/L = 17.4L答:CO2的质量为8.8g;CO2的体积为17.4L3:6.5g锌和100g一定质量分数的稀硫酸恰好完全反应,求:(1)生成氢气的质量?(2)稀硫酸中溶质的质量分数?(3)生成的硫酸锌溶液中溶质的质量?解:设生成氢气的质量为x,硫酸的质量为y,生成硫酸锌的质量为z Zn+H2SO4 == ZnSO4+H2↑
65 98 161 2
6.5g y z x X= = 0.2g
y= =9.8g
z= =16.1g4:40g10%NaOH溶液跟多少克10%盐酸完全反应?反应后溶液的溶质的质量分数是多少?解:设稀盐酸的质量为X,反应后生成的NaCl的质量为YNaOH + HCl = NaCl + H2O40g?10% X ?10% Y40 36.5 58.5 X = 36.5gY=5.85gNaCl% = 答:略 (NaOH + HCl = NaCl + H2O)溶 液 的 配 置配置步骤:1、计算 2、称量 3、溶解
4、装瓶储存例1: (溶质为固体)配制50g6%的氯化钠溶液 计算:需氯化钠:50 g× 6% = 3 g 需水: 50 g– 3g= 47 g称量:用托盘天平称量 3 g食盐 用量筒量取47mL水溶解:烧杯、玻璃棒 实验仪器:托盘天平(砝码)、药匙、量筒、
胶头滴管、烧杯、玻璃棒、试剂瓶练习:下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。
溶质质量分数与化学方程式的综合计算讨论交流:
在溶液中进行的反应,往往是其中的 参加反应,所以在根据化学方程式列出有关反应物、生成物的质量比时,要用 的质量列比例,而不能用溶液的质量或体积列比例。溶质溶质例如:锌与100g 20%的硫酸溶液完全反应。和锌发生完全反应的是( )A.100g硫酸溶液 B.20g硫酸 C.100g硫酸B3、配制溶质质量分数一定的溶液⑴计算 ⑵称量 ⑶溶解 ⑷装瓶药匙 天平 烧杯 量筒 滴管 玻璃棒M质M质+M剂
同课章节目录
