课题1生活中常见的盐课件(共53张PPT)
文档属性
| 名称 | 课题1生活中常见的盐课件(共53张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-02 10:01:50 | ||
图片预览











文档简介
课件53张PPT。盐:一类 或 (NH4+)与 结合的 。 金属离子铵根离子酸根离子化合物盐=食盐?新 课 导 入课题1生活中常见的盐 盐的分类方法。(P77页)硫酸钠 (Na2SO4) 硫酸镁(MgSO4) 硫酸铜(CuSO4) 硫酸钡(BaSO4)… 碳酸钠 (Na2CO3) 碳酸镁(MgCO3) 碳酸铜(CuCO3) 碳酸钡(BaCO3)…硝酸钠 (NaNO3) 硝酸镁[Mg(NO3)2] 硝酸铜[Cu(NO3)2] 硝酸钡[Ba(NO3)2]氯化钠 (NaCl) 氯化镁(MgCl2) 氯化铜(CuCl2) 氯化钡(BaCl2)按酸根分类硫酸盐碳酸盐硝酸盐盐酸盐……按金属元素分类钠盐镁盐铜盐钡盐……按溶解性分类可溶性盐微溶性盐( CaSO4 、 Ag2SO4 )难溶性盐盐的分类方法铵盐
钾盐
钠盐
硝酸盐
大部分盐酸盐
大部分硫酸盐大部分碳酸盐AgCl
BaSO41.盐的分类①正盐(如NaCl、硫酸钠等)②酸式盐(如硫酸氢钠)③碱式盐(如碱式碳酸铜)酸跟碱完全反应的产物。酸中的氢离子部分被中和的产物。碱中的氢氧根离子部分被中和的产物。)自学课本72—73页完成下列问题1.盐是指一类组成里含有 和 的化合物。氯化钠是由 和 构成的。其中 有促生盐酸、帮助消化和增进食欲的作用。
2.碳酸钠俗称 、 ;碳酸氢钠俗称 。
3.氯化钠的用途:
①生活中作 、 ;②医疗上用来配制 ;③农业上用来 ;④工业上可以用来制取 、 、氯气和盐酸等;⑤公路上用来 。金属离子酸根离子钠离子氯离子氯离子纯碱苏打小苏打调味剂防腐剂生理盐水配制盐水选种碳酸钠氢氧化钠消除积雪原理是什么?4.氯化钠主要蕴藏在 里,此外盐湖、盐井和盐矿中也有分布。
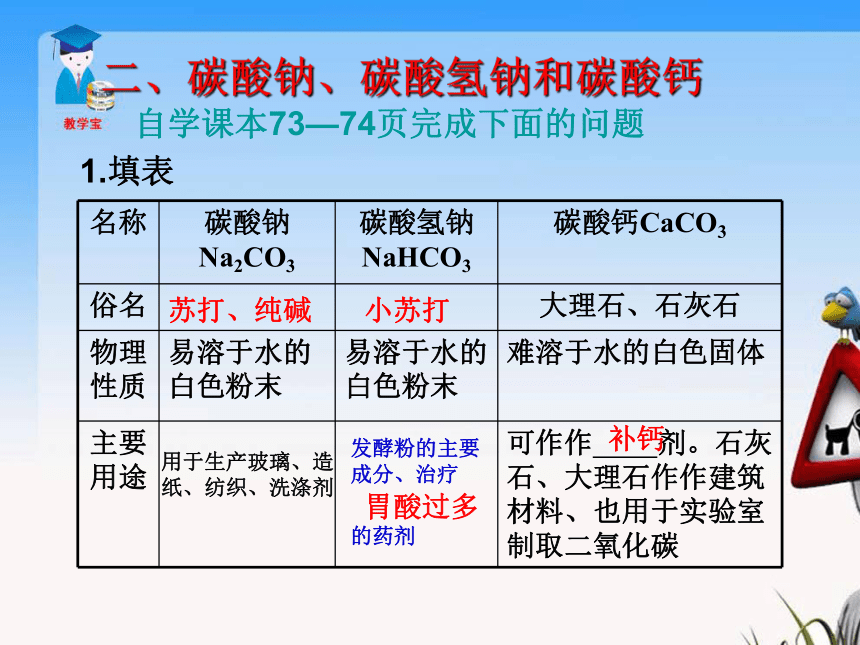
5.制取粗盐的方法是晾晒或煮海水、盐井水、盐湖水,以蒸发除去其中的 。这一过程是 变化。海水水物理1.氯离子(Cl-)的检验①滴加硝酸银,现象:生成白色沉淀②滴加稀硝酸,现象:沉淀不溶解二、碳酸钠、碳酸氢钠和碳酸钙自学课本73—74页完成下面的问题1.填表苏打、纯碱小苏打补钙胃酸过多用于生产玻璃、造纸、纺织、洗涤剂
发酵粉的主要成分、治疗
的药剂
1、下列各组物质名称不代表同一物质的一组是
A.氯化钠、盐
B.氢氧化钠、苛性钠
C.碳酸钠、纯碱
D.碳酸氢钠、小苏打
2、下列关于物质用途的说法中,错误的是
A.碳酸钙用作补钙剂
B.碳酸氢钠用于焙制糕点
C.纯碱溶液用于除水垢
D.食盐用作调味品 AC课堂训练 比较:碳酸钙(CaCO3)、碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)的化学式有何相似之处?都含有CO32-或HCO3-离子 想一想:碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)是否也能和盐酸发生类似的反应呢?产生大量气泡,澄清石灰水变浑浊
更快产生大量气泡,
澄清石灰水变浑浊
含CO32-的盐与盐酸反应产生使澄清石灰水变浑浊的CO2气体含HCO3-的盐与盐酸反应产生使澄清石灰水变浑浊的CO2气体Na2CO3+2HCl=
2NaCl+H2O+CO2↑
NaHCO3+HCl=
NaCl+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑ Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑组成里含有CO32-(或HCO3-)离子的盐,都能跟盐酸反应生成二氧化碳气体,利用此反应可以检验盐的组成中是否含有CO32-(或HCO3-)仔细观察上面三个化学方程式,你有何发现?观察发现5.CO32-、HCO3-的检验 ①检验依据:
组成里含有CO32-或HCO3-的盐都能与盐酸反应,生成二氧化碳气体。 ②检验试剂:稀盐酸、澄清的石灰水。 ③检验方法:取少量待测样品,加入少量稀盐酸,看能否生成使澄清的石灰水变浑浊的气体。知识小结:将珍珠放入稀盐酸中,有气泡产生,生成的气体能使澄清的石灰水变浑浊,则珍珠中含有下列离子中的
C A、氯离子 B、硫酸根离子
C、碳酸根离子 D、氢氧根离子课堂训练实验11—2溶液产生白色沉淀含有CO32-的碳酸盐溶液与石灰水能反应产生白色沉淀CaCO3 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH向盛有少量Na2CO3溶液的试管滴入澄清的石灰水,观察现象。 一、写出两种鉴别氢氧化钠和澄清石灰水的方法:
1、 。 2、 。 二、用石灰石、水、纯碱怎样制取烧碱?
写出有关的化学方程【课后练习】通入CO2加入Na2CO3溶液
;
;
。 CaO + H2O = Ca(OH)2如何鉴别碳酸钠和碳酸氢钠?1.加热固体产生能使澄清石灰水变浑浊的气体的是NaHCO32NaHCO3 Na2CO3+H2O+CO2△2.在溶液中加入相同溶液的盐酸反应剧烈的是NaHCO33.溶解,加入氯化钙.
产生沉淀的是Na2CO3Na2CO3+CaCI2=CaCO3 +2NaCl4、掌握CO32-、HCO3-的检验方法 ①检验依据:
②检验试剂: ③检验方法:知识归纳小结:3、了解碳酸钠、碳酸氢钠和碳酸钙的俗称及在生活中的主要用途。2、氯化钠的性质及用途1、盐的概念H2O+CO2 ↑H2O+CO2 ↑H2O+CO2 ↑导入新课复分解反应的概念: 两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应 。表达式:AB + CD→特 点:双交换,元素价不变AD+ CBNa2CO3+Ca(OH)2=2NaOH+CaCO3↓1、交换位置: Cl+ CO3Na H2、定化学式:NaCl+H2CO3例:3、配 平:2NaCl+H2O+CO2复分解反应:由两种化合物互相交换成分,
生成另外两种化合物的反应。 实质:发生复分解反应的两种物质在水溶液
中相互交换离子,结合成难解离的物
质----沉淀、气体、水,使溶液中离子
浓度降低,反应物:必须可溶;
生成物:必须有沉淀、气体、水三者之一知识归纳小结:复分解反应发生的条件: 酸、碱、盐之间的反应都属复分解反应,但并不是任何酸、碱、盐之间都能发生复分解反应。只有当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时(至少满足上述条件之一),复分解反应才可以发生。
Ca2+、OH- H+、SO4 2 -Ca2+、SO42-反应前反应后溶液中离子种类发生改变 Ca(OH)2+ H2SO4——CaSO4+2H2O——√溶液中反应的离子变化H+、Cl-Na+、CO3 2 -Na+、SO42-反应前反应后溶液中离子种类发生改变 2HCl+Na2CO3 ——Na2SO4+ + H2O——√溶液中反应的离子变化Ca2+、OH- Na+、CO3 2 -Na+、OH-反应前反应后溶液中离子种类发生改变 Ca(OH)2+ Na2CO3—— 2NaOH+——CaCO3↓√溶液中反应的离子变化K2SO4 + NaNO3×Na+、SO42- K+、NO3-K+、SO42-反应前反应后溶液中离子种类没有改变 Na2SO4 + KNO3 ——Na+、NO3-溶液中反应的离子变化想一想:化学方程式是否正确?
KNO3+NaOH=NaNO3+KOH物质溶解性口诀:
1、酸(除硅酸外)都溶:
溶碱有五位:钾、钠、钙、钡、铵.
2、钾、 钠、 铵、硝酸盐都可溶于水中间。
K_ Na_ NH4_ _NO3
3、盐酸盐中(— Cl)氯化银AgCl不可溶。、
4、硫酸盐中(—SO4)硫酸钡BaSO4不可溶。
5、碳酸盐(—CO3)只溶钾、钠、铵、镁,剩下多数不溶这些你都记住了吗?小结四种基本反应类型化合反应:A + B +…→C
分解反应:A → B + C +…
置换反应:A + BC →AC+B
复分解反应:AB + CD → AD + CB不是。例:CO2+2NaOH=Na2CO3+H2O 侯德榜,1890年8月9日生于福建闽侯农村。少年时他学习十分刻苦,就是伏在水车上双脚不停地车水时,仍能捧着书本认真读书。后来在姑母的资助下,他单身来到福州英华书院和闽皖路矿学堂读书。毕业后曾在津浦铁路符离集车站做过工程练习生。在工作之余,他抓紧时间学习,1911年考人清华留美预备学校。经过3年的努力,他以10门功课1000分的优异成绩被保送到美国留学。8年中,他先后在麻省理工学院、柏拉图学院、哥伦比亚大学攻读化学工程,1921年取得博士学位。 侯氏制碱法原理:
(1)NH3+H2O+CO2=NH4HCO3
(首先通入氨气,然后再通入二氧化碳)
(2)NH4HCO3+NaCl=NH4Cl+NaHCO3
(NaHCO3溶解度最小,所以析出。)
(3)2NaHCO3=Na2CO3+CO2↑+H2O
(NaHCO3热稳定性很差,受热容易分解) 梳理与反馈
一、知识梳理:通过本节学习你有何收获?
二、反馈训练:
1.下列物质相互之间不能发生反应的是( )
A.NaOH、HCl B.BaCl2、Na2CO3
C.NaCl、Na2SO4 D.CuSO4、KOH
2.蒸馒头时,在发酵面团中加入某种物质,既能除去面团发酵产生的酸,又能使馒头松软,加入的这种物质是( )
A.氢氧化钠 B.碳酸钠 C.氯化钠 D.氧化钙
1、生活中常见盐的用途;2、 CO32-、HCO3-的检验方法;3、复分解反应发生的条件。CB 讨论:
1.酸和碱反应生成盐和水,是复分解反应吗?为什么?是复分解反应,因为两种反应物相互交换成分生成两种生成物。2.分析、归纳反应中生成物的特点,思考复分解反应发生的条件。两种反应物相互交换成分,生成物中有气体、沉淀或水生成时反应才能够进行。
若是酸碱反应,至少有一种是可溶的;若是其它的反应,两种反应物都必须可溶。D 下列化学反应属复分解反应的是 课堂训练1、下列各组物质的溶液,不能发生复分解反应的是 ( )
A、HCl,Ca(OH)2 B、Na2CO3,H2SO4
C、AgNO3,BaCl2 D、KCl,CuSO4
D2、下列反应中不属于复分解反应的是()。
A、H2SO4+Ca(OH)2=CaSO4+2H2O
B、H2SO4+BaCl2=BaSO4 +3HCl
C、2HCl+Fe=FeCl2+H2
D、2HCl+CaCO3=CaCl2+H2CO3H2O+CO2c写出下列反应的方程式,并讨论它们是否属于复分解反应。
1.盐酸除铁锈。
2.氢氧化镁中和胃酸
3纯碱制烧碱。
4硫酸铜溶液与氢氧化钠溶液反应。
5.硫酸溶液与碳酸钠反应6HCl+2Fe2O3===2FeCl3+3H2OMg(OH)2+2HCl==MgCl2+2H2OCa(OH)2+Na2CO3==2NaCl+CaCO3↓CuSO4+2NaOH==Cu(OH)2↓+Na2SO4H2SO4+Na2CO3==Na2SO4+H2O+CO2↑1、判断下列复分解反应能否发生:
H2SO4 + NaNO3——
Na2SO4 + BaCl2——
2HNO3 + K2CO3——
KNO3 + NaOH——
不能BaSO4↓+ 2NaCl 2KNO3 + CO2↑+H2O不能3.下列各组物质中,能在同一溶液中大量共存的是( )
A.Na2SO4、 Ba(OH)2 、HCl .
B.CuSO4、H2SO4、HNO3。
C. Na2CO3、 NaOH、Ca(OH)2。
D. K2SO4、 NaOH、Ba(NO3)2。
4.欲除去氢氧化钠中的少量氢氧化钙,可以选用的试剂是( )
A.氢氧化钾溶液 B.碳酸钠溶液
C.氯化钡溶液 D.稀盐酸
BB 结合课本75页附录1判断下列反应能否发生
能不能能能能能能能能不能不能不能记住酸碱盐的溶解性是判断复分解反应基本要求,你有什么好方法快而准的记住它们吗? 在金属活动性顺序表中,只有________的金属才能把________的金属从它的______中置换出来,与氢的位置___关。盐必须是______盐。①金属 + 盐 → 新盐 + 新金属位于前面位于后面盐溶液无可溶性 不要用K、Ca、Na置换盐溶液中的金属。铁参加的置换反应生成的都是亚铁盐。
盐的化学性质(第三课时)注:②盐 + 酸 → 新盐 + 新酸③盐 + 碱 → 新盐 + 新碱④盐 + 盐 → 新盐 + 新盐复分解反应类型(举例)
1、酸+金属氧化物→盐 + 水
2、酸 + 碱 → 盐 + 水Fe2O3 + 6HCl =2FeCl3+ 3H2ONaOH + HCl = NaCl +H2O
3、盐+酸→新盐+新酸CaCO3+2HCl=CaCl2+ CO2 ↑ +H2O
4、盐+碱→新盐+新碱5、盐+盐→新盐+新盐CuCl2+2NaOH=Cu(OH)2↓+2NaClBaCl2+Na2SO4=BaSO4↓+2NaCl归纳几种常见离子的检验1.碳酸根离子的检验①滴加稀盐酸,现象:有气泡产生;②通入澄清石灰水,现象:生成白色浑浊。2.硫酸根离子的检验①滴加硝酸钡,现象:生成白色沉淀;②滴加稀硝酸,现象:沉淀不溶解。4.铵根离子的检验①滴加氢氧化钠溶液,现象:有气泡产生;②用红色石蕊试纸检验,现象:试纸变蓝。3.氯离子的检验①滴加硝酸银,现象:生成白色沉淀;②滴加稀硝酸,现象:沉淀不溶解。离子的鉴别:①紫色石蕊;②pH试纸①紫色石蕊;②酚酞试液;③ pH试纸1.下列各组离子能共存的是( )
A.Ba2+、K+、NO3-、CO32-、H+
B.K+、Cl-、Mg2+、NO3-、H+
C.Fe3+、SO42-、OH-、Na+、Cu2+
D.Ag+、Ba2+、Cl-、NO3-、K+B 2.不用其它试剂,用最简捷的方法鉴别:①氢氧化钠②硫酸镁③硝酸钡④氯化铁⑤氯化钾五种溶液,则被鉴别出来的物质的正确的顺序是( )
A.①②③④⑤
B.④①②③⑤
C.④③①②⑤
D.②③①④⑤
B 3.下列各组溶液,不加其它试剂就能鉴别的是( )
A.Na2CO3、HCl、H2SO4、NaNO3
B.K2CO3、H2SO4、HNO3、BaCl2
C.HCl、AgNO3、HNO3、NaCl
D.NaOH、FeCl3、MgCl2、BaCl2
B、D 4.有一包白色粉末,可能含有碳酸钙、硫酸钠、碳酸钠、氯化钙中的一种或几种。为了鉴别该白色粉末,做如下实验。(1)将白色粉末溶于水得无色溶液。(2)在该溶液中滴加BaCl2溶液有白色沉淀生成。(3)过滤后,在沉淀物里加入足量的稀硝酸,沉淀全部溶解并放出无色气体。
根据实验现象判断:此白色粉末中肯定含有 ,肯定不含有 。Na2CO3CaCO3、Na2SO4、CaCl2 4.若两次过滤后滤液仍然浑浊,原因可能有哪些?
5.过滤后把滤液倒进 进行蒸发,当蒸发皿 中 停止加热。
6.精盐产率=
7.若计算出的精盐产率比实际值偏大,试分析原因;若值偏小又有何原因。①过滤时液面高于滤纸边缘;②滤纸破损;③仪器不干净。蒸发皿有较多固体出现时精盐质量粗盐质量产率偏高:①过滤不干净;②水没蒸发完。产率偏低:①操作时液体洒落;②部分氯化钠沾在滤纸上或蒸发皿上。
钾盐
钠盐
硝酸盐
大部分盐酸盐
大部分硫酸盐大部分碳酸盐AgCl
BaSO41.盐的分类①正盐(如NaCl、硫酸钠等)②酸式盐(如硫酸氢钠)③碱式盐(如碱式碳酸铜)酸跟碱完全反应的产物。酸中的氢离子部分被中和的产物。碱中的氢氧根离子部分被中和的产物。)自学课本72—73页完成下列问题1.盐是指一类组成里含有 和 的化合物。氯化钠是由 和 构成的。其中 有促生盐酸、帮助消化和增进食欲的作用。
2.碳酸钠俗称 、 ;碳酸氢钠俗称 。
3.氯化钠的用途:
①生活中作 、 ;②医疗上用来配制 ;③农业上用来 ;④工业上可以用来制取 、 、氯气和盐酸等;⑤公路上用来 。金属离子酸根离子钠离子氯离子氯离子纯碱苏打小苏打调味剂防腐剂生理盐水配制盐水选种碳酸钠氢氧化钠消除积雪原理是什么?4.氯化钠主要蕴藏在 里,此外盐湖、盐井和盐矿中也有分布。
5.制取粗盐的方法是晾晒或煮海水、盐井水、盐湖水,以蒸发除去其中的 。这一过程是 变化。海水水物理1.氯离子(Cl-)的检验①滴加硝酸银,现象:生成白色沉淀②滴加稀硝酸,现象:沉淀不溶解二、碳酸钠、碳酸氢钠和碳酸钙自学课本73—74页完成下面的问题1.填表苏打、纯碱小苏打补钙胃酸过多用于生产玻璃、造纸、纺织、洗涤剂
发酵粉的主要成分、治疗
的药剂
1、下列各组物质名称不代表同一物质的一组是
A.氯化钠、盐
B.氢氧化钠、苛性钠
C.碳酸钠、纯碱
D.碳酸氢钠、小苏打
2、下列关于物质用途的说法中,错误的是
A.碳酸钙用作补钙剂
B.碳酸氢钠用于焙制糕点
C.纯碱溶液用于除水垢
D.食盐用作调味品 AC课堂训练 比较:碳酸钙(CaCO3)、碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)的化学式有何相似之处?都含有CO32-或HCO3-离子 想一想:碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)是否也能和盐酸发生类似的反应呢?产生大量气泡,澄清石灰水变浑浊
更快产生大量气泡,
澄清石灰水变浑浊
含CO32-的盐与盐酸反应产生使澄清石灰水变浑浊的CO2气体含HCO3-的盐与盐酸反应产生使澄清石灰水变浑浊的CO2气体Na2CO3+2HCl=
2NaCl+H2O+CO2↑
NaHCO3+HCl=
NaCl+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑ Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑组成里含有CO32-(或HCO3-)离子的盐,都能跟盐酸反应生成二氧化碳气体,利用此反应可以检验盐的组成中是否含有CO32-(或HCO3-)仔细观察上面三个化学方程式,你有何发现?观察发现5.CO32-、HCO3-的检验 ①检验依据:
组成里含有CO32-或HCO3-的盐都能与盐酸反应,生成二氧化碳气体。 ②检验试剂:稀盐酸、澄清的石灰水。 ③检验方法:取少量待测样品,加入少量稀盐酸,看能否生成使澄清的石灰水变浑浊的气体。知识小结:将珍珠放入稀盐酸中,有气泡产生,生成的气体能使澄清的石灰水变浑浊,则珍珠中含有下列离子中的
C A、氯离子 B、硫酸根离子
C、碳酸根离子 D、氢氧根离子课堂训练实验11—2溶液产生白色沉淀含有CO32-的碳酸盐溶液与石灰水能反应产生白色沉淀CaCO3 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH向盛有少量Na2CO3溶液的试管滴入澄清的石灰水,观察现象。 一、写出两种鉴别氢氧化钠和澄清石灰水的方法:
1、 。 2、 。 二、用石灰石、水、纯碱怎样制取烧碱?
写出有关的化学方程【课后练习】通入CO2加入Na2CO3溶液
;
;
。 CaO + H2O = Ca(OH)2如何鉴别碳酸钠和碳酸氢钠?1.加热固体产生能使澄清石灰水变浑浊的气体的是NaHCO32NaHCO3 Na2CO3+H2O+CO2△2.在溶液中加入相同溶液的盐酸反应剧烈的是NaHCO33.溶解,加入氯化钙.
产生沉淀的是Na2CO3Na2CO3+CaCI2=CaCO3 +2NaCl4、掌握CO32-、HCO3-的检验方法 ①检验依据:
②检验试剂: ③检验方法:知识归纳小结:3、了解碳酸钠、碳酸氢钠和碳酸钙的俗称及在生活中的主要用途。2、氯化钠的性质及用途1、盐的概念H2O+CO2 ↑H2O+CO2 ↑H2O+CO2 ↑导入新课复分解反应的概念: 两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应 。表达式:AB + CD→特 点:双交换,元素价不变AD+ CBNa2CO3+Ca(OH)2=2NaOH+CaCO3↓1、交换位置: Cl+ CO3Na H2、定化学式:NaCl+H2CO3例:3、配 平:2NaCl+H2O+CO2复分解反应:由两种化合物互相交换成分,
生成另外两种化合物的反应。 实质:发生复分解反应的两种物质在水溶液
中相互交换离子,结合成难解离的物
质----沉淀、气体、水,使溶液中离子
浓度降低,反应物:必须可溶;
生成物:必须有沉淀、气体、水三者之一知识归纳小结:复分解反应发生的条件: 酸、碱、盐之间的反应都属复分解反应,但并不是任何酸、碱、盐之间都能发生复分解反应。只有当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时(至少满足上述条件之一),复分解反应才可以发生。
Ca2+、OH- H+、SO4 2 -Ca2+、SO42-反应前反应后溶液中离子种类发生改变 Ca(OH)2+ H2SO4——CaSO4+2H2O——√溶液中反应的离子变化H+、Cl-Na+、CO3 2 -Na+、SO42-反应前反应后溶液中离子种类发生改变 2HCl+Na2CO3 ——Na2SO4+ + H2O——√溶液中反应的离子变化Ca2+、OH- Na+、CO3 2 -Na+、OH-反应前反应后溶液中离子种类发生改变 Ca(OH)2+ Na2CO3—— 2NaOH+——CaCO3↓√溶液中反应的离子变化K2SO4 + NaNO3×Na+、SO42- K+、NO3-K+、SO42-反应前反应后溶液中离子种类没有改变 Na2SO4 + KNO3 ——Na+、NO3-溶液中反应的离子变化想一想:化学方程式是否正确?
KNO3+NaOH=NaNO3+KOH物质溶解性口诀:
1、酸(除硅酸外)都溶:
溶碱有五位:钾、钠、钙、钡、铵.
2、钾、 钠、 铵、硝酸盐都可溶于水中间。
K_ Na_ NH4_ _NO3
3、盐酸盐中(— Cl)氯化银AgCl不可溶。、
4、硫酸盐中(—SO4)硫酸钡BaSO4不可溶。
5、碳酸盐(—CO3)只溶钾、钠、铵、镁,剩下多数不溶这些你都记住了吗?小结四种基本反应类型化合反应:A + B +…→C
分解反应:A → B + C +…
置换反应:A + BC →AC+B
复分解反应:AB + CD → AD + CB不是。例:CO2+2NaOH=Na2CO3+H2O 侯德榜,1890年8月9日生于福建闽侯农村。少年时他学习十分刻苦,就是伏在水车上双脚不停地车水时,仍能捧着书本认真读书。后来在姑母的资助下,他单身来到福州英华书院和闽皖路矿学堂读书。毕业后曾在津浦铁路符离集车站做过工程练习生。在工作之余,他抓紧时间学习,1911年考人清华留美预备学校。经过3年的努力,他以10门功课1000分的优异成绩被保送到美国留学。8年中,他先后在麻省理工学院、柏拉图学院、哥伦比亚大学攻读化学工程,1921年取得博士学位。 侯氏制碱法原理:
(1)NH3+H2O+CO2=NH4HCO3
(首先通入氨气,然后再通入二氧化碳)
(2)NH4HCO3+NaCl=NH4Cl+NaHCO3
(NaHCO3溶解度最小,所以析出。)
(3)2NaHCO3=Na2CO3+CO2↑+H2O
(NaHCO3热稳定性很差,受热容易分解) 梳理与反馈
一、知识梳理:通过本节学习你有何收获?
二、反馈训练:
1.下列物质相互之间不能发生反应的是( )
A.NaOH、HCl B.BaCl2、Na2CO3
C.NaCl、Na2SO4 D.CuSO4、KOH
2.蒸馒头时,在发酵面团中加入某种物质,既能除去面团发酵产生的酸,又能使馒头松软,加入的这种物质是( )
A.氢氧化钠 B.碳酸钠 C.氯化钠 D.氧化钙
1、生活中常见盐的用途;2、 CO32-、HCO3-的检验方法;3、复分解反应发生的条件。CB 讨论:
1.酸和碱反应生成盐和水,是复分解反应吗?为什么?是复分解反应,因为两种反应物相互交换成分生成两种生成物。2.分析、归纳反应中生成物的特点,思考复分解反应发生的条件。两种反应物相互交换成分,生成物中有气体、沉淀或水生成时反应才能够进行。
若是酸碱反应,至少有一种是可溶的;若是其它的反应,两种反应物都必须可溶。D 下列化学反应属复分解反应的是 课堂训练1、下列各组物质的溶液,不能发生复分解反应的是 ( )
A、HCl,Ca(OH)2 B、Na2CO3,H2SO4
C、AgNO3,BaCl2 D、KCl,CuSO4
D2、下列反应中不属于复分解反应的是()。
A、H2SO4+Ca(OH)2=CaSO4+2H2O
B、H2SO4+BaCl2=BaSO4 +3HCl
C、2HCl+Fe=FeCl2+H2
D、2HCl+CaCO3=CaCl2+H2CO3H2O+CO2c写出下列反应的方程式,并讨论它们是否属于复分解反应。
1.盐酸除铁锈。
2.氢氧化镁中和胃酸
3纯碱制烧碱。
4硫酸铜溶液与氢氧化钠溶液反应。
5.硫酸溶液与碳酸钠反应6HCl+2Fe2O3===2FeCl3+3H2OMg(OH)2+2HCl==MgCl2+2H2OCa(OH)2+Na2CO3==2NaCl+CaCO3↓CuSO4+2NaOH==Cu(OH)2↓+Na2SO4H2SO4+Na2CO3==Na2SO4+H2O+CO2↑1、判断下列复分解反应能否发生:
H2SO4 + NaNO3——
Na2SO4 + BaCl2——
2HNO3 + K2CO3——
KNO3 + NaOH——
不能BaSO4↓+ 2NaCl 2KNO3 + CO2↑+H2O不能3.下列各组物质中,能在同一溶液中大量共存的是( )
A.Na2SO4、 Ba(OH)2 、HCl .
B.CuSO4、H2SO4、HNO3。
C. Na2CO3、 NaOH、Ca(OH)2。
D. K2SO4、 NaOH、Ba(NO3)2。
4.欲除去氢氧化钠中的少量氢氧化钙,可以选用的试剂是( )
A.氢氧化钾溶液 B.碳酸钠溶液
C.氯化钡溶液 D.稀盐酸
BB 结合课本75页附录1判断下列反应能否发生
能不能能能能能能能能不能不能不能记住酸碱盐的溶解性是判断复分解反应基本要求,你有什么好方法快而准的记住它们吗? 在金属活动性顺序表中,只有________的金属才能把________的金属从它的______中置换出来,与氢的位置___关。盐必须是______盐。①金属 + 盐 → 新盐 + 新金属位于前面位于后面盐溶液无可溶性 不要用K、Ca、Na置换盐溶液中的金属。铁参加的置换反应生成的都是亚铁盐。
盐的化学性质(第三课时)注:②盐 + 酸 → 新盐 + 新酸③盐 + 碱 → 新盐 + 新碱④盐 + 盐 → 新盐 + 新盐复分解反应类型(举例)
1、酸+金属氧化物→盐 + 水
2、酸 + 碱 → 盐 + 水Fe2O3 + 6HCl =2FeCl3+ 3H2ONaOH + HCl = NaCl +H2O
3、盐+酸→新盐+新酸CaCO3+2HCl=CaCl2+ CO2 ↑ +H2O
4、盐+碱→新盐+新碱5、盐+盐→新盐+新盐CuCl2+2NaOH=Cu(OH)2↓+2NaClBaCl2+Na2SO4=BaSO4↓+2NaCl归纳几种常见离子的检验1.碳酸根离子的检验①滴加稀盐酸,现象:有气泡产生;②通入澄清石灰水,现象:生成白色浑浊。2.硫酸根离子的检验①滴加硝酸钡,现象:生成白色沉淀;②滴加稀硝酸,现象:沉淀不溶解。4.铵根离子的检验①滴加氢氧化钠溶液,现象:有气泡产生;②用红色石蕊试纸检验,现象:试纸变蓝。3.氯离子的检验①滴加硝酸银,现象:生成白色沉淀;②滴加稀硝酸,现象:沉淀不溶解。离子的鉴别:①紫色石蕊;②pH试纸①紫色石蕊;②酚酞试液;③ pH试纸1.下列各组离子能共存的是( )
A.Ba2+、K+、NO3-、CO32-、H+
B.K+、Cl-、Mg2+、NO3-、H+
C.Fe3+、SO42-、OH-、Na+、Cu2+
D.Ag+、Ba2+、Cl-、NO3-、K+B 2.不用其它试剂,用最简捷的方法鉴别:①氢氧化钠②硫酸镁③硝酸钡④氯化铁⑤氯化钾五种溶液,则被鉴别出来的物质的正确的顺序是( )
A.①②③④⑤
B.④①②③⑤
C.④③①②⑤
D.②③①④⑤
B 3.下列各组溶液,不加其它试剂就能鉴别的是( )
A.Na2CO3、HCl、H2SO4、NaNO3
B.K2CO3、H2SO4、HNO3、BaCl2
C.HCl、AgNO3、HNO3、NaCl
D.NaOH、FeCl3、MgCl2、BaCl2
B、D 4.有一包白色粉末,可能含有碳酸钙、硫酸钠、碳酸钠、氯化钙中的一种或几种。为了鉴别该白色粉末,做如下实验。(1)将白色粉末溶于水得无色溶液。(2)在该溶液中滴加BaCl2溶液有白色沉淀生成。(3)过滤后,在沉淀物里加入足量的稀硝酸,沉淀全部溶解并放出无色气体。
根据实验现象判断:此白色粉末中肯定含有 ,肯定不含有 。Na2CO3CaCO3、Na2SO4、CaCl2 4.若两次过滤后滤液仍然浑浊,原因可能有哪些?
5.过滤后把滤液倒进 进行蒸发,当蒸发皿 中 停止加热。
6.精盐产率=
7.若计算出的精盐产率比实际值偏大,试分析原因;若值偏小又有何原因。①过滤时液面高于滤纸边缘;②滤纸破损;③仪器不干净。蒸发皿有较多固体出现时精盐质量粗盐质量产率偏高:①过滤不干净;②水没蒸发完。产率偏低:①操作时液体洒落;②部分氯化钠沾在滤纸上或蒸发皿上。
同课章节目录
