人教版高中化学必修一 3.1 金属的化学性质课件
文档属性
| 名称 | 人教版高中化学必修一 3.1 金属的化学性质课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-04 09:26:41 | ||
图片预览









文档简介
课件59张PPT。第三章 金属及其化合物第一节 金属的化学性质 你知道焰火晚会上五颜六色的焰火是用什么制成的吗?你见过可以用小刀切割的金属吗?水是用来灭火的,你见过用水能够生火的吗……
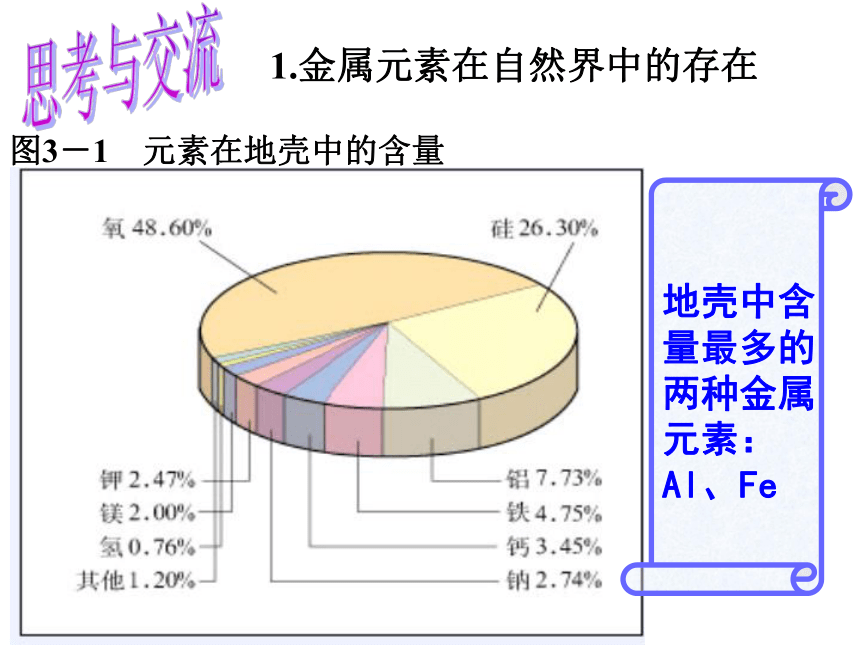
就让我们一起走进神奇的金属世界……古代炼铁 青铜器铜 线绚丽多彩的金属世界 铝箔1.金属元素在自然界中的存在 图3-1 元素在地壳中的含量思考与交流金属的一些物理性质 2.金属有哪些物理共性?不透明、多数为银白色、有金属光泽、导电性、导热性、延展性。讨论:?思考与交流 3.以Fe为例,说明金属能发生哪些化学反应?(1)与非金属反应(2)与酸反应(3)与某些盐溶液反应3Fe + 2O2 =Fe3O4△Fe + 2HCl =FeCl2+H2↑Fe +CuCl2 = FeCl2+ Cu
分析下列图片,写出反应的化学方程式。
若是离子反应的,写出离子方程式.
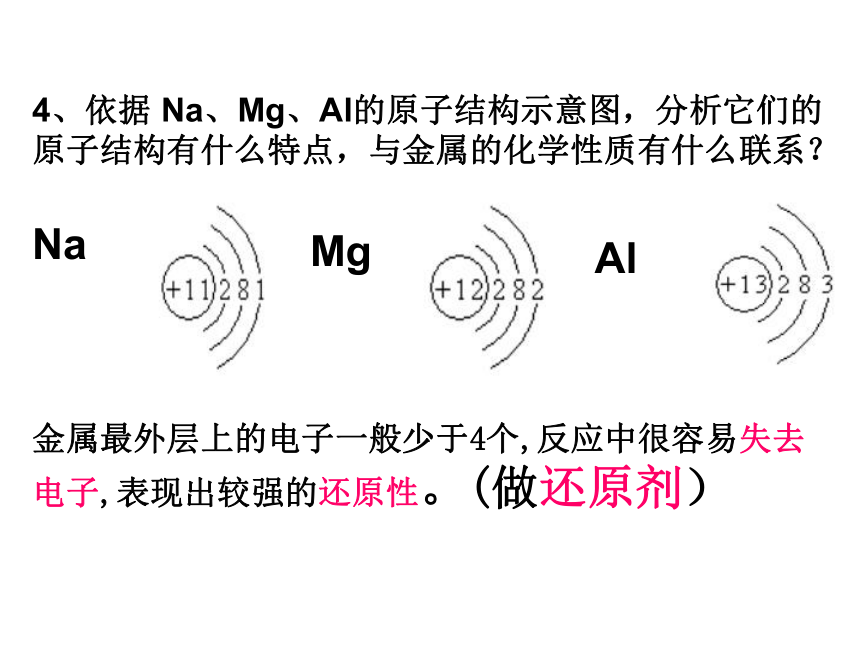
4、依据 Na、Mg、Al的原子结构示意图,分析它们的原子结构有什么特点,与金属的化学性质有什么联系?金属最外层上的电子一般少于4个,反应中很容易失去电子,表现出较强的还原性。(做还原剂)
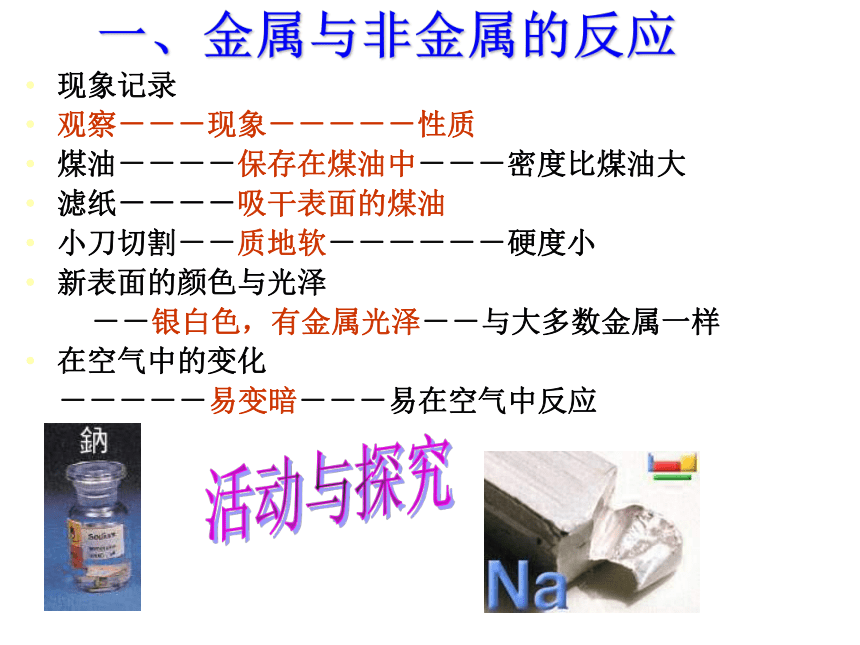
一、金属与非金属的反应1.钠与氧气的反应一、金属与非金属的反应现象记录
观察---现象-----性质
煤油----保存在煤油中---密度比煤油大
滤纸----吸干表面的煤油
小刀切割--质地软------硬度小
新表面的颜色与光泽
--银白色,有金属光泽--与大多数金属一样
在空气中的变化
-----易变暗---易在空气中反应活动与探究物理性质:色 态 熔、沸点
光泽 密度 保存 上述现象哪些涉及钠的化学性质原因:易与空气中的氧气反应
4Na+O2=2Na2O(白色)银白色、有金属光泽的固体,热、电的良导体,质软、
密度小、熔点低。保存在煤油中,在空气中易变暗 实验3-2:把一小块金属钠放在坩埚里,加热,有什么现象?实验现象:钠受热先熔化成银白色的小球,接着燃烧起来,火焰呈黄色, 最后生成淡黄色固体。常温下4Na + O2 == 2Na2O(白色)加热下-1失去2×e-,化合价升高,被氧化得到2×e-,化合价降低,被还原失去4×e-,化合价升高,被氧化得到2×2e-,化合价降低,被还原结论:钠的化学性质很活泼,在常温或加热的条件下都能跟氧气反应。(条件不同,现象不同,产物不同。)不稳定稳定△二.钠的化学性质1.钠与氧气反应2Na +O2 == Na2O2 (淡黄色)还原剂氧化剂氧化剂还原剂加热氧化钠过氧化钠白色固体淡黄色固体Na2O与Na2O2的比较不稳定较稳定铝容易被氧化而生成一层致密的氧化膜。铝表面的氧化膜保护了铝。构成薄膜的氧化铝(Al2O3)的熔点(2050℃)高于铝的熔点(660℃),包在铝的外面,使熔化了的铝不会滴落下来。铝箔发红卷缩, 熔化不滴落。 铝箔发红卷缩,很快就变暗 失去光泽,熔化不滴落。科学探究铝很活泼,除去原来的氧化膜后,很快又会生成一层新的氧化膜。
4Al + 3 O2 == 2Al2O3 金属元素的最外层电子数较少,容易失去,单质往往表现出还原性,当遇到氧化剂时,就会发生氧化还原反应。因此 ,除了能被氧气氧化外,还能被氯气、硫等具有氧化性的物质氧化,生成相应的氯化物或硫化物。小结:1. 钠在空气中加热,观察实验现象是( )
A.金属钠熔化
B.燃烧时放出红色火花
C.生成白色的固体物质
A3.下列关于铝的叙述中,不正确的是( )
A.铝是地壳中含量最多的金属元素
B.在常温下,铝不能与氧气反应
C.铝是一种比较活泼的金属
D.在化学反应中,铝容易失去电子,是还原剂2.下列关于钠的叙述中,不正确的( )
A.钠是银白色、质软的金属,可用小刀切割
B.钠燃烧时生成氧化钠
C.钠有很强的还原性
D.钠原子的最外层只有一个电子BB 1、金属与水的反应实验探究:钠与水的反应浮在水面上,金属钠熔化成小球,四处游动,发出嘶嘶的响声,水溶液变红。二、金属与酸和水的反应钠所在的位置
钠球的运动和大小变化情况
溶液颜色的变化情况等观察点产物呈碱性反应剧烈、有气体生成气体推动小球迅速移动反应放热、钠的熔点低为97.81℃密度(钠)<密度(水) 0.97g/cm3现象解释金属钠与水(加了酚酞)反应的实验现象:钠与水反应原理钠与水电离所产生的氢离子反应,生成氢气。钠与水反应实质化学方程式:2Na + 2H2O == 2NaOH + H2↑失2×e-得2×e-还原剂氧化剂离子方程式:2Na + 2H2O ==2Na+ + 2OH- +H2↑练习:请标出钠与水反应的电子转移情况;请写出钠与水反应的离子方程式 。Na的保存Na的保存在煤油或石蜡油中隔绝空气与水Na着火用干沙土扑灭1.预测金属钠与盐酸的反应的现象。和钠与水相比哪个更剧烈?钠与酸反应比与水反应剧烈。由于钠与水反应,实质上是钠跟水电离出的H+反应;而酸中的H+浓度比水中H+浓度大。思维拓展:钠与酸反应的离子方程式:
2Na + 2H+ = 2Na+ + H2↑思考与交流:
在金属活动顺序表中,钠排在铁、铜等金属的前面,说明钠比铜要活泼得多,那么钠能与CuSO4溶液反应置换出铜吗?[补充实验]把一小块金属钠投入到硫酸铜溶液中,观察发生的现象。实验探究:钠与盐溶液的反应[实验现象]浮在水面、熔成小球、四处游动、发出嘶嘶的响声,有蓝色絮状沉淀产生。2Na+2H2O+CuSO4 =Cu(OH)2 +Na2SO4+H2↑
反应原理:思考与交流 人们通常用铁制水壶来盛水和烧水。这说明了什么?铁真的不能跟水反应吗?铁不能与冷、热水反应,但能否与水蒸气反应?科学探究:铁与水的反应能否设计一套简单的实验装置,使铁粉与水蒸气反应? 假设推论:化学反应方程式(固)(气)实验设计探究 请用三支试管、水槽、蒸发皿、胶塞、导管、酒精喷灯及其它必要的仪器和物品,设计一个还原铁粉与水蒸气反应的实验装置,画出装置简图。
应考虑:①水蒸气的发生 ②水蒸气与铁粉的反应 ③气体产物的检验等。铁粉与水蒸气反应的实验装置:该反应装置各部分的作用是什么?④③②①①产生水蒸气;②水蒸气与铁粉反应④检验产生的气体③干燥剂水蒸气的发生装置水蒸气与铁粉反应装置产物收集装置★课本中设计的装置更好 (优点:装置简单、操作方便、现象明显)★在下表中记录实验现象
加热时试管内铁粉红热,点燃肥皂泡可听到爆鸣声。2Na+2HCl=2NaCl+H2↑Fe+2HCl=FeCl2+H2↑Mg+2HCl=MgCl2+H2↑最慢最快结论:
金属活动性顺序表中(H)前面的金属与酸反应产生H2。
金属越活泼,与酸反应越剧烈。 2、金属与酸的反应M+2H+=M 2+ +H2 ↑思考:Na、Mg、Fe分别与盐酸反应哪个快哪个慢?为什么?① 金属与水反应的难易
与水反应越容易,反应越剧烈,金属越活泼。比较金属活动性强弱的实验方法②金属与酸反应的难易
与酸反应产生H2越容易,反应越剧烈,金属越活泼。③金属之间的置换反应想一想:可以通过哪些实验事实来比较不同金属的活动性强弱?Na、Mg、Fe都能与稀盐酸、稀硫酸反应,能不能与NaOH 溶液反应?Al能否与NaOH溶液反应?思考:实验3-4:取两支试管,分别加入5mL 的盐酸和NaOH溶液,再分别加入几片铝片,观察实验现象。过一段时间后,将点燃的木条分别放在两支试管口,观察实验现象。实验探究:三、铝与氢氧化钠溶液的反应现象:铝片放入盐酸、NaOH溶液中都有气泡产生,点燃气体观察到蓝色火焰。思
考为什么铝与盐酸、氢氧化钠溶液的反应开始时气体产生的速度较慢,而后越来越快?因为开始时是铝表面的氧化膜先发生作用,氧化膜反应完全以后才有H2产生,该反应为放热反应,且随着反应的进行,温度升高,反应速度也加快。 化学方程式:
2Al+2NaOH+2H2O =2NaAlO2+3H2↑
2Al+6HCl = 2AlCl3+3H2↑
铝的特殊性:既能跟酸反应产生H2,又能跟强碱溶液反应产生H2。三、铝与氢氧化钠溶液的反应元素包括金属元素和非金属元素。铝既能与盐酸反应,
又能与氢氧化钠反应,我们又称铝为两性元素 铝和氧化铝均能跟酸、碱反应,因而铝的保护膜和铝制品会直接被酸、碱、盐侵蚀,所以,铝制餐具不宜用来蒸煮或长期存放酸性、碱性或咸的食物。思考:铝制餐具是否适宜用来蒸煮或长时间盛放酸性、碱性或咸的食物?为什么?金在自然界中以游离态存在以上我们学习了金属的一些化学性质,通过分析不难发现,在反应中这些金属元素的化合价都发生了变化,它们从0价升为正价。在这些变化中,金属表现了强的还原性,做还原剂 。在自然界中金属多以化合态存在,只有极少数不活泼的金属如金以游离态存在。小结:下列关于铝的叙述,不正确的是( )
A 铝是地壳中含量最多的金属元素
B 铝的抗腐蚀性能好,原因是铝表面的氧化膜可以
阻止铝与空气中的氧气接触
C 铝是一种活泼金属,在化学反应中常作还原剂
D 铝制餐具能用于蒸煮,或者长时间存放碱性食
物,但不适宜于存放酸性食物D课堂练习题:四、物质的量在化学方程式计算中的应用化学计量数之比扩大NA倍物质的量(n)之比2Na+2H2O=2NaOH+H2↑化 学 计 量 数 之 比物 质 的 量 之 比=一、原 理: 四:物质的量应用于化学方程式的计算微粒数之比:2个 : 2个 : 2个 : 1个 【例 题 】 实验室用6.5g Zn与足量盐酸完全反应。求:① Zn的物质的量;②参加反应HCl的物质的量;③生成H2的体积(标况下)。解:n(HCl)= 0.2 mol m(HCl)= 7.3g n(HCl)== 0.2 mol解法1:解法2:讨论:哪种方法简单?解:n(HCl)= 0.2 mol 1n (H2)n(H2)= 0.1 mol V(H2)= n(H2) × Vm = 0.1 mol × 22.4 L/mol= 2.24 L(1)根据题意写出相关反应的化学方程式
(2)找出相关物质的计量数之比
(3)对应计量系数,找出相关物质的物质的量
(要求的量用n(B)或设未知数x、y等代表)
(4)根据计量关系进行计算。 二、根据化学方程式进行计算的基本步骤 : 怎样计算生成H2的体积?【例 题 】 实验室用6.5g Zn与足量盐酸完全反应。求:① Zn的物质的量;②参加反应HCl的物质的量;③生成H2的体积(标况下)。1mol22.4LV (H2)0.1molV(H2)= 2.24 L=上下单位要相同,左右要相对应解法2:65g22.4LV (H2)6.5g2moln (HCl)注 意:
(1)化学方程式所表示的是实际参加反应的物质之间量的关系。
(2)上下单位要相同,左右要相对应n(HNO3)= 0.5 mol NaOH + HNO3 == NaNO3 + H2O1、完全中和0 .5 mol NaOH需多少摩尔的 HNO3?其质量是多少克?解: 答:完全中和0.5molNaOH需0.5mol HNO3 其质量为31.5g。HNO3摩尔质量为63 g/molm(HNO3)= 0.5 mol×63 g/mol=31.5 g因为所以【练 习】 解:(1)
(2)2Na + 2H2O = 2NaOH + H2↑【练一练】2、有4.6g的金属钠跟水发生反应,钠完全反应,计算:
(1)4.6g 钠的物质的量
(2)求生成的氢氧化钠的物质的量
(3)求生成的气体的体积(标准状态下)220.2mol1n(NaOH)n(H2)n(H2)=0.1moln(NaOH)=0.2mol V(H2)=0.1mol×22.4L=2.24L2molc(NaOH)] =2 mol 0.4 moln(NaOH)= 0.8 mol/L3×22.4 LV (H2)V(H2) = 13.44 Ln(NaOH) =0.4mol答: Al的物质的量0.4mol,参加反应的NaOH的物质的量是0.4mol,溶液的物质的量浓度是0.8mol/L,生成标准状况下H2的体积是13.44 L。n( Al) = = 0.4 mol3、向500mLNaOH溶液中投入10.8gAl,二者恰好完全反应后,计算:① Al的物质的量。②参加反应的NaOH的物质的量和溶液的物质的量浓度。③生成标准状况下H2的体积。解:==2.根据化学方程式进行计算的基本步骤 :
(1)根据题意写出相关反应的化学方程式
(2)找出相关物质的计量数之比
(3)对应计量系数,找出相关物质的物质的量
(要求的量用n(B)或设未知数x、y等代表)
(4)根据计量关系进行计算。3.弄清应注意的问题
(1)化学方程式所表示的是实际参加反应的物质之间的量的关系。
(2)上下单位要相同,左右要相对应。1、化学方程式中各物质的化学计量数之比等于各物质的物质的量之比通过做以上例题、习题,大家有什么体会? 小 结:练 习1、物质在相互反应时( )
A.它们的质量一定相等
B.它们的物质的量一定相等
C.它们的质量比等于方程式中化学计量数之比
D.它们物质的量比等于方程式中化学计量数之比
DB2、取两份物质的量相等的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同状态下产生的气体体积之比是( )
A.1:1 B.1:2 C. 1:3 D. 3:2 A3、0.16 g氢氧化钠恰好与20 mL的盐酸完全反应,则盐酸的物质的量浓度为( )
A.0.1 mol/L? B.0.2 mol/L
C.0.5 mol/L? D.1 mol/L作业计算题
将5.4克AL投入到足量的NaOH溶液中,试计算: 1.消耗NaOH的物质的量是多少? 2.生成NaALO2的质量是多少? 3.在标况下生成多少体积的H2?
就让我们一起走进神奇的金属世界……古代炼铁 青铜器铜 线绚丽多彩的金属世界 铝箔1.金属元素在自然界中的存在 图3-1 元素在地壳中的含量思考与交流金属的一些物理性质 2.金属有哪些物理共性?不透明、多数为银白色、有金属光泽、导电性、导热性、延展性。讨论:?思考与交流 3.以Fe为例,说明金属能发生哪些化学反应?(1)与非金属反应(2)与酸反应(3)与某些盐溶液反应3Fe + 2O2 =Fe3O4△Fe + 2HCl =FeCl2+H2↑Fe +CuCl2 = FeCl2+ Cu
分析下列图片,写出反应的化学方程式。
若是离子反应的,写出离子方程式.
4、依据 Na、Mg、Al的原子结构示意图,分析它们的原子结构有什么特点,与金属的化学性质有什么联系?金属最外层上的电子一般少于4个,反应中很容易失去电子,表现出较强的还原性。(做还原剂)
一、金属与非金属的反应1.钠与氧气的反应一、金属与非金属的反应现象记录
观察---现象-----性质
煤油----保存在煤油中---密度比煤油大
滤纸----吸干表面的煤油
小刀切割--质地软------硬度小
新表面的颜色与光泽
--银白色,有金属光泽--与大多数金属一样
在空气中的变化
-----易变暗---易在空气中反应活动与探究物理性质:色 态 熔、沸点
光泽 密度 保存 上述现象哪些涉及钠的化学性质原因:易与空气中的氧气反应
4Na+O2=2Na2O(白色)银白色、有金属光泽的固体,热、电的良导体,质软、
密度小、熔点低。保存在煤油中,在空气中易变暗 实验3-2:把一小块金属钠放在坩埚里,加热,有什么现象?实验现象:钠受热先熔化成银白色的小球,接着燃烧起来,火焰呈黄色, 最后生成淡黄色固体。常温下4Na + O2 == 2Na2O(白色)加热下-1失去2×e-,化合价升高,被氧化得到2×e-,化合价降低,被还原失去4×e-,化合价升高,被氧化得到2×2e-,化合价降低,被还原结论:钠的化学性质很活泼,在常温或加热的条件下都能跟氧气反应。(条件不同,现象不同,产物不同。)不稳定稳定△二.钠的化学性质1.钠与氧气反应2Na +O2 == Na2O2 (淡黄色)还原剂氧化剂氧化剂还原剂加热氧化钠过氧化钠白色固体淡黄色固体Na2O与Na2O2的比较不稳定较稳定铝容易被氧化而生成一层致密的氧化膜。铝表面的氧化膜保护了铝。构成薄膜的氧化铝(Al2O3)的熔点(2050℃)高于铝的熔点(660℃),包在铝的外面,使熔化了的铝不会滴落下来。铝箔发红卷缩, 熔化不滴落。 铝箔发红卷缩,很快就变暗 失去光泽,熔化不滴落。科学探究铝很活泼,除去原来的氧化膜后,很快又会生成一层新的氧化膜。
4Al + 3 O2 == 2Al2O3 金属元素的最外层电子数较少,容易失去,单质往往表现出还原性,当遇到氧化剂时,就会发生氧化还原反应。因此 ,除了能被氧气氧化外,还能被氯气、硫等具有氧化性的物质氧化,生成相应的氯化物或硫化物。小结:1. 钠在空气中加热,观察实验现象是( )
A.金属钠熔化
B.燃烧时放出红色火花
C.生成白色的固体物质
A3.下列关于铝的叙述中,不正确的是( )
A.铝是地壳中含量最多的金属元素
B.在常温下,铝不能与氧气反应
C.铝是一种比较活泼的金属
D.在化学反应中,铝容易失去电子,是还原剂2.下列关于钠的叙述中,不正确的( )
A.钠是银白色、质软的金属,可用小刀切割
B.钠燃烧时生成氧化钠
C.钠有很强的还原性
D.钠原子的最外层只有一个电子BB 1、金属与水的反应实验探究:钠与水的反应浮在水面上,金属钠熔化成小球,四处游动,发出嘶嘶的响声,水溶液变红。二、金属与酸和水的反应钠所在的位置
钠球的运动和大小变化情况
溶液颜色的变化情况等观察点产物呈碱性反应剧烈、有气体生成气体推动小球迅速移动反应放热、钠的熔点低为97.81℃密度(钠)<密度(水) 0.97g/cm3现象解释金属钠与水(加了酚酞)反应的实验现象:钠与水反应原理钠与水电离所产生的氢离子反应,生成氢气。钠与水反应实质化学方程式:2Na + 2H2O == 2NaOH + H2↑失2×e-得2×e-还原剂氧化剂离子方程式:2Na + 2H2O ==2Na+ + 2OH- +H2↑练习:请标出钠与水反应的电子转移情况;请写出钠与水反应的离子方程式 。Na的保存Na的保存在煤油或石蜡油中隔绝空气与水Na着火用干沙土扑灭1.预测金属钠与盐酸的反应的现象。和钠与水相比哪个更剧烈?钠与酸反应比与水反应剧烈。由于钠与水反应,实质上是钠跟水电离出的H+反应;而酸中的H+浓度比水中H+浓度大。思维拓展:钠与酸反应的离子方程式:
2Na + 2H+ = 2Na+ + H2↑思考与交流:
在金属活动顺序表中,钠排在铁、铜等金属的前面,说明钠比铜要活泼得多,那么钠能与CuSO4溶液反应置换出铜吗?[补充实验]把一小块金属钠投入到硫酸铜溶液中,观察发生的现象。实验探究:钠与盐溶液的反应[实验现象]浮在水面、熔成小球、四处游动、发出嘶嘶的响声,有蓝色絮状沉淀产生。2Na+2H2O+CuSO4 =Cu(OH)2 +Na2SO4+H2↑
反应原理:思考与交流 人们通常用铁制水壶来盛水和烧水。这说明了什么?铁真的不能跟水反应吗?铁不能与冷、热水反应,但能否与水蒸气反应?科学探究:铁与水的反应能否设计一套简单的实验装置,使铁粉与水蒸气反应? 假设推论:化学反应方程式(固)(气)实验设计探究 请用三支试管、水槽、蒸发皿、胶塞、导管、酒精喷灯及其它必要的仪器和物品,设计一个还原铁粉与水蒸气反应的实验装置,画出装置简图。
应考虑:①水蒸气的发生 ②水蒸气与铁粉的反应 ③气体产物的检验等。铁粉与水蒸气反应的实验装置:该反应装置各部分的作用是什么?④③②①①产生水蒸气;②水蒸气与铁粉反应④检验产生的气体③干燥剂水蒸气的发生装置水蒸气与铁粉反应装置产物收集装置★课本中设计的装置更好 (优点:装置简单、操作方便、现象明显)★在下表中记录实验现象
加热时试管内铁粉红热,点燃肥皂泡可听到爆鸣声。2Na+2HCl=2NaCl+H2↑Fe+2HCl=FeCl2+H2↑Mg+2HCl=MgCl2+H2↑最慢最快结论:
金属活动性顺序表中(H)前面的金属与酸反应产生H2。
金属越活泼,与酸反应越剧烈。 2、金属与酸的反应M+2H+=M 2+ +H2 ↑思考:Na、Mg、Fe分别与盐酸反应哪个快哪个慢?为什么?① 金属与水反应的难易
与水反应越容易,反应越剧烈,金属越活泼。比较金属活动性强弱的实验方法②金属与酸反应的难易
与酸反应产生H2越容易,反应越剧烈,金属越活泼。③金属之间的置换反应想一想:可以通过哪些实验事实来比较不同金属的活动性强弱?Na、Mg、Fe都能与稀盐酸、稀硫酸反应,能不能与NaOH 溶液反应?Al能否与NaOH溶液反应?思考:实验3-4:取两支试管,分别加入5mL 的盐酸和NaOH溶液,再分别加入几片铝片,观察实验现象。过一段时间后,将点燃的木条分别放在两支试管口,观察实验现象。实验探究:三、铝与氢氧化钠溶液的反应现象:铝片放入盐酸、NaOH溶液中都有气泡产生,点燃气体观察到蓝色火焰。思
考为什么铝与盐酸、氢氧化钠溶液的反应开始时气体产生的速度较慢,而后越来越快?因为开始时是铝表面的氧化膜先发生作用,氧化膜反应完全以后才有H2产生,该反应为放热反应,且随着反应的进行,温度升高,反应速度也加快。 化学方程式:
2Al+2NaOH+2H2O =2NaAlO2+3H2↑
2Al+6HCl = 2AlCl3+3H2↑
铝的特殊性:既能跟酸反应产生H2,又能跟强碱溶液反应产生H2。三、铝与氢氧化钠溶液的反应元素包括金属元素和非金属元素。铝既能与盐酸反应,
又能与氢氧化钠反应,我们又称铝为两性元素 铝和氧化铝均能跟酸、碱反应,因而铝的保护膜和铝制品会直接被酸、碱、盐侵蚀,所以,铝制餐具不宜用来蒸煮或长期存放酸性、碱性或咸的食物。思考:铝制餐具是否适宜用来蒸煮或长时间盛放酸性、碱性或咸的食物?为什么?金在自然界中以游离态存在以上我们学习了金属的一些化学性质,通过分析不难发现,在反应中这些金属元素的化合价都发生了变化,它们从0价升为正价。在这些变化中,金属表现了强的还原性,做还原剂 。在自然界中金属多以化合态存在,只有极少数不活泼的金属如金以游离态存在。小结:下列关于铝的叙述,不正确的是( )
A 铝是地壳中含量最多的金属元素
B 铝的抗腐蚀性能好,原因是铝表面的氧化膜可以
阻止铝与空气中的氧气接触
C 铝是一种活泼金属,在化学反应中常作还原剂
D 铝制餐具能用于蒸煮,或者长时间存放碱性食
物,但不适宜于存放酸性食物D课堂练习题:四、物质的量在化学方程式计算中的应用化学计量数之比扩大NA倍物质的量(n)之比2Na+2H2O=2NaOH+H2↑化 学 计 量 数 之 比物 质 的 量 之 比=一、原 理: 四:物质的量应用于化学方程式的计算微粒数之比:2个 : 2个 : 2个 : 1个 【例 题 】 实验室用6.5g Zn与足量盐酸完全反应。求:① Zn的物质的量;②参加反应HCl的物质的量;③生成H2的体积(标况下)。解:n(HCl)= 0.2 mol m(HCl)= 7.3g n(HCl)== 0.2 mol解法1:解法2:讨论:哪种方法简单?解:n(HCl)= 0.2 mol 1n (H2)n(H2)= 0.1 mol V(H2)= n(H2) × Vm = 0.1 mol × 22.4 L/mol= 2.24 L(1)根据题意写出相关反应的化学方程式
(2)找出相关物质的计量数之比
(3)对应计量系数,找出相关物质的物质的量
(要求的量用n(B)或设未知数x、y等代表)
(4)根据计量关系进行计算。 二、根据化学方程式进行计算的基本步骤 : 怎样计算生成H2的体积?【例 题 】 实验室用6.5g Zn与足量盐酸完全反应。求:① Zn的物质的量;②参加反应HCl的物质的量;③生成H2的体积(标况下)。1mol22.4LV (H2)0.1molV(H2)= 2.24 L=上下单位要相同,左右要相对应解法2:65g22.4LV (H2)6.5g2moln (HCl)注 意:
(1)化学方程式所表示的是实际参加反应的物质之间量的关系。
(2)上下单位要相同,左右要相对应n(HNO3)= 0.5 mol NaOH + HNO3 == NaNO3 + H2O1、完全中和0 .5 mol NaOH需多少摩尔的 HNO3?其质量是多少克?解: 答:完全中和0.5molNaOH需0.5mol HNO3 其质量为31.5g。HNO3摩尔质量为63 g/molm(HNO3)= 0.5 mol×63 g/mol=31.5 g因为所以【练 习】 解:(1)
(2)2Na + 2H2O = 2NaOH + H2↑【练一练】2、有4.6g的金属钠跟水发生反应,钠完全反应,计算:
(1)4.6g 钠的物质的量
(2)求生成的氢氧化钠的物质的量
(3)求生成的气体的体积(标准状态下)220.2mol1n(NaOH)n(H2)n(H2)=0.1moln(NaOH)=0.2mol V(H2)=0.1mol×22.4L=2.24L2molc(NaOH)] =2 mol 0.4 moln(NaOH)= 0.8 mol/L3×22.4 LV (H2)V(H2) = 13.44 Ln(NaOH) =0.4mol答: Al的物质的量0.4mol,参加反应的NaOH的物质的量是0.4mol,溶液的物质的量浓度是0.8mol/L,生成标准状况下H2的体积是13.44 L。n( Al) = = 0.4 mol3、向500mLNaOH溶液中投入10.8gAl,二者恰好完全反应后,计算:① Al的物质的量。②参加反应的NaOH的物质的量和溶液的物质的量浓度。③生成标准状况下H2的体积。解:==2.根据化学方程式进行计算的基本步骤 :
(1)根据题意写出相关反应的化学方程式
(2)找出相关物质的计量数之比
(3)对应计量系数,找出相关物质的物质的量
(要求的量用n(B)或设未知数x、y等代表)
(4)根据计量关系进行计算。3.弄清应注意的问题
(1)化学方程式所表示的是实际参加反应的物质之间的量的关系。
(2)上下单位要相同,左右要相对应。1、化学方程式中各物质的化学计量数之比等于各物质的物质的量之比通过做以上例题、习题,大家有什么体会? 小 结:练 习1、物质在相互反应时( )
A.它们的质量一定相等
B.它们的物质的量一定相等
C.它们的质量比等于方程式中化学计量数之比
D.它们物质的量比等于方程式中化学计量数之比
DB2、取两份物质的量相等的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同状态下产生的气体体积之比是( )
A.1:1 B.1:2 C. 1:3 D. 3:2 A3、0.16 g氢氧化钠恰好与20 mL的盐酸完全反应,则盐酸的物质的量浓度为( )
A.0.1 mol/L? B.0.2 mol/L
C.0.5 mol/L? D.1 mol/L作业计算题
将5.4克AL投入到足量的NaOH溶液中,试计算: 1.消耗NaOH的物质的量是多少? 2.生成NaALO2的质量是多少? 3.在标况下生成多少体积的H2?
