第一节化学反应中的质量守恒(25张PPT)
文档属性
| 名称 | 第一节化学反应中的质量守恒(25张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-06 10:28:41 | ||
图片预览








文档简介
1.通过实验探究理解质量守恒定律。
2.能用微粒观点解释质量守恒的本质原因。
3.会用质量守恒定律解决一些相关问题。
化学反应前后,物质质量是否发生变化?
●情景
质量怎么会变呢?在化学反应中,分子虽然变了,但是原子没有改变,质量应该不变吧?
过氧化氢分解了,分子变了,质量当然也就变了!
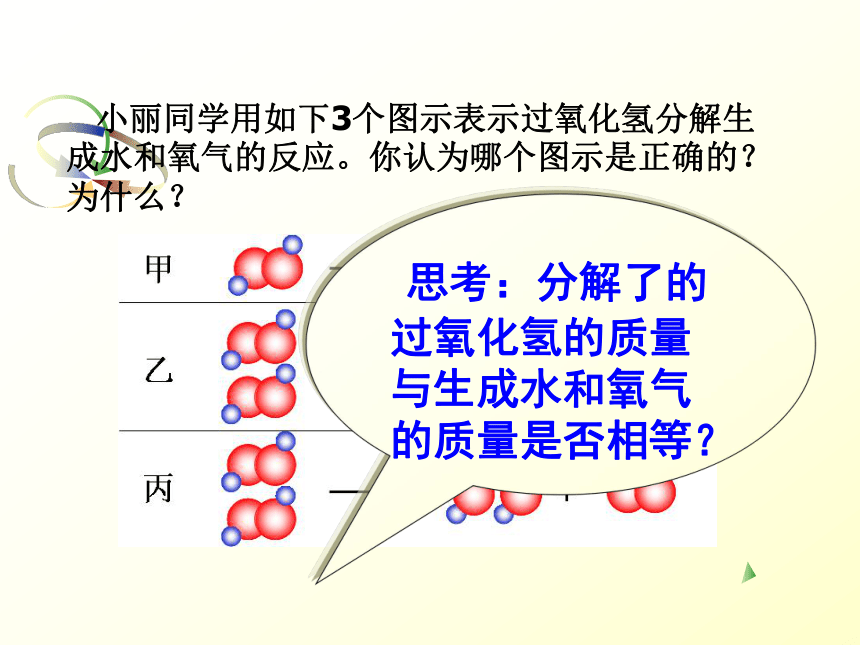
小丽和小明的争论
小丽同学用如下3个图示表示过氧化氢分解生成水和氧气的反应。你认为哪个图示是正确的?为什么?
思考:分解了的过氧化氢的质量与生成水和氧气的质量是否相等?
物质在发生化学变化时,反应物的质量总和与生成物的质量总和之间存在什么关系呢?
反成物的质量总和 生应物的质量总和
>
<
=
方案一:白磷在空气中燃烧生成五氧化二磷(P2O5)
方案二:氢氧化钠(NaOH)溶液和硫酸铜(CuSO4)溶液反应,生成硫酸钠(Na2SO4)和氢氧化铜[Cu(OH)2]
方案三:盐酸和大理石(Ca2CO3)反应生成二氧化碳、水和氯化钙(CaCl2)
1、怎样测量反应前后的物质质量?
2、怎样使反应发生、在哪里发生,需要哪些仪器、药品?
主要实验步骤:
1.称量反应前各物质质量总和;
3.称量反应后各物质质量总和;
2.使反应发生;
4.比较反应前后各物质质量总和的关系。
白磷在空气中燃烧生成五氧化二磷(P2O5)
白磷+氧气 五氧化二磷
方案一(演示):
白磷 ,产生 ,反应后天平 。
反应前物质总质量 反应后物质总质量
剧烈燃烧
大量白烟
任然平衡
等于
实验记录
反应现象
反应表达式
反应前后
质量变化
实验提示
1.小烧杯和锥形瓶用于盛放液体药品
2.气球用于密封和装固体药品
3.药品取少量即可
4.实验时规范操作,注意安全
主要实验步骤:
1.称量反应前各物质质量总和;
2.使反应发生;
3.称量反应后各物质质量总和;
4.比较反应前后各物质质量总和的关系。
盐酸和大理石(主要成分CaCO3)反应,生成氯化钙(CaCl2 )、水和二氧化碳
方案二:
碳酸钙+稀盐酸→氯化钙+水+二氧化碳
产生 ,气球 ,天平 。
反应前物质总质量 反应后物质总质量
大量气泡
鼓起来
任然平衡
等于
实验记录
反应现象
反应表达式
反应前后
质量变化
氢氧化钠溶液与硫酸铜溶液反应,生成氢氧化铜和硫酸钠
氢氧化钠+硫酸铜→氢氧化铜+硫酸钠
方案三:
产生 ,反应后天平 。
反应前物质总质量 反应后物质总质量
蓝色沉淀
任然平衡
等于
实验记录
反应现象
反应表达式
反应前后
质量变化
质量守恒定律
参加化学反应
的各物质的
质量总和
生成的各物质的质量
总和
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
练习1:
2g氢气和16g氧气恰好完全反应,生成水的质量为 。
18g
把握质量守恒定律应注意几点
1、只有化学变化才遵守质量守恒定律,物理变化不用质量守恒定律解释!
2、守恒的是“总质量”,即“参加反应的各反应物的总质量”和“生成物的总质量”。
如沉淀、气体等都应考虑进去。
3、 “参加”,意味着没有参加反应(剩余)的物质的质量不能算在内。
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
化学反应
练习2:
2g氢气和17g氧气完全反应,(有1g氧气剩余),生成水的质量为 。
下列变化能用质量守恒定律解释的是( )
A.5g水受热变成5g水蒸气。
B.5g食盐溶解在95g水中,成为100g食盐溶液
C.12g碳与32g氧气恰好完全反应生成44g二氧化碳
18g
C
为什么化学反应前后的物质的质量总和相等?
试用分子、原子的观点解释质量守恒的原因。
过氧化氢 水 + 氧气
MnO2
结合过氧化氢分解的微观图思考:
化学反应前后,原子种类、数目、质量有变化吗?
H2O2 H2O + O2
二氧化锰
O
H
O
O
O
H
H
H
H
H
过氧化氢分子
水分子
氧分子
H
H
H
H
O
O
O
H
O
H
O
O
O
O
归纳:
质量守恒的原因:
(微观)
种类没变。
个数没有增减。
质量没有变化。
原子
物质总质量不变
元素种类不变
某大师说他能点石(主要成分CaCO3)成金(Au),他的说法可信吗?
原子数目
原子质量
原子种类
元素种类
物质的种类
分子的种类
分子数目
物质状态
你知道吗?
物质的总质量
适用于一切化学反应
“守恒”是指质量守恒
“参加,生成,质量总和”
内容
微观
注意
质量守恒定律
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
课堂小结
2.能用微粒观点解释质量守恒的本质原因。
3.会用质量守恒定律解决一些相关问题。
化学反应前后,物质质量是否发生变化?
●情景
质量怎么会变呢?在化学反应中,分子虽然变了,但是原子没有改变,质量应该不变吧?
过氧化氢分解了,分子变了,质量当然也就变了!
小丽和小明的争论
小丽同学用如下3个图示表示过氧化氢分解生成水和氧气的反应。你认为哪个图示是正确的?为什么?
思考:分解了的过氧化氢的质量与生成水和氧气的质量是否相等?
物质在发生化学变化时,反应物的质量总和与生成物的质量总和之间存在什么关系呢?
反成物的质量总和 生应物的质量总和
>
<
=
方案一:白磷在空气中燃烧生成五氧化二磷(P2O5)
方案二:氢氧化钠(NaOH)溶液和硫酸铜(CuSO4)溶液反应,生成硫酸钠(Na2SO4)和氢氧化铜[Cu(OH)2]
方案三:盐酸和大理石(Ca2CO3)反应生成二氧化碳、水和氯化钙(CaCl2)
1、怎样测量反应前后的物质质量?
2、怎样使反应发生、在哪里发生,需要哪些仪器、药品?
主要实验步骤:
1.称量反应前各物质质量总和;
3.称量反应后各物质质量总和;
2.使反应发生;
4.比较反应前后各物质质量总和的关系。
白磷在空气中燃烧生成五氧化二磷(P2O5)
白磷+氧气 五氧化二磷
方案一(演示):
白磷 ,产生 ,反应后天平 。
反应前物质总质量 反应后物质总质量
剧烈燃烧
大量白烟
任然平衡
等于
实验记录
反应现象
反应表达式
反应前后
质量变化
实验提示
1.小烧杯和锥形瓶用于盛放液体药品
2.气球用于密封和装固体药品
3.药品取少量即可
4.实验时规范操作,注意安全
主要实验步骤:
1.称量反应前各物质质量总和;
2.使反应发生;
3.称量反应后各物质质量总和;
4.比较反应前后各物质质量总和的关系。
盐酸和大理石(主要成分CaCO3)反应,生成氯化钙(CaCl2 )、水和二氧化碳
方案二:
碳酸钙+稀盐酸→氯化钙+水+二氧化碳
产生 ,气球 ,天平 。
反应前物质总质量 反应后物质总质量
大量气泡
鼓起来
任然平衡
等于
实验记录
反应现象
反应表达式
反应前后
质量变化
氢氧化钠溶液与硫酸铜溶液反应,生成氢氧化铜和硫酸钠
氢氧化钠+硫酸铜→氢氧化铜+硫酸钠
方案三:
产生 ,反应后天平 。
反应前物质总质量 反应后物质总质量
蓝色沉淀
任然平衡
等于
实验记录
反应现象
反应表达式
反应前后
质量变化
质量守恒定律
参加化学反应
的各物质的
质量总和
生成的各物质的质量
总和
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
练习1:
2g氢气和16g氧气恰好完全反应,生成水的质量为 。
18g
把握质量守恒定律应注意几点
1、只有化学变化才遵守质量守恒定律,物理变化不用质量守恒定律解释!
2、守恒的是“总质量”,即“参加反应的各反应物的总质量”和“生成物的总质量”。
如沉淀、气体等都应考虑进去。
3、 “参加”,意味着没有参加反应(剩余)的物质的质量不能算在内。
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
化学反应
练习2:
2g氢气和17g氧气完全反应,(有1g氧气剩余),生成水的质量为 。
下列变化能用质量守恒定律解释的是( )
A.5g水受热变成5g水蒸气。
B.5g食盐溶解在95g水中,成为100g食盐溶液
C.12g碳与32g氧气恰好完全反应生成44g二氧化碳
18g
C
为什么化学反应前后的物质的质量总和相等?
试用分子、原子的观点解释质量守恒的原因。
过氧化氢 水 + 氧气
MnO2
结合过氧化氢分解的微观图思考:
化学反应前后,原子种类、数目、质量有变化吗?
H2O2 H2O + O2
二氧化锰
O
H
O
O
O
H
H
H
H
H
过氧化氢分子
水分子
氧分子
H
H
H
H
O
O
O
H
O
H
O
O
O
O
归纳:
质量守恒的原因:
(微观)
种类没变。
个数没有增减。
质量没有变化。
原子
物质总质量不变
元素种类不变
某大师说他能点石(主要成分CaCO3)成金(Au),他的说法可信吗?
原子数目
原子质量
原子种类
元素种类
物质的种类
分子的种类
分子数目
物质状态
你知道吗?
物质的总质量
适用于一切化学反应
“守恒”是指质量守恒
“参加,生成,质量总和”
内容
微观
注意
质量守恒定律
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
课堂小结
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
