氧化还原反应[下学期]
图片预览






文档简介
课件14张PPT。氧化还原反应从化合价是否变化判断氧化还原反应怎样判断反应是否是氧化还原反应?〖复习回忆〗氧化还原反应的本质是什么?发生了电子转移〖掌握概念〗怎样判断氧化剂、还原剂、氧化产物、还原产物?(指反应物) 得到电子的物质,在反应时所含元素的化合价降低(指反应物)失去电子的物质,在反应时所含元素的化合价升高
氧化剂:
还原剂:
氧化产物:
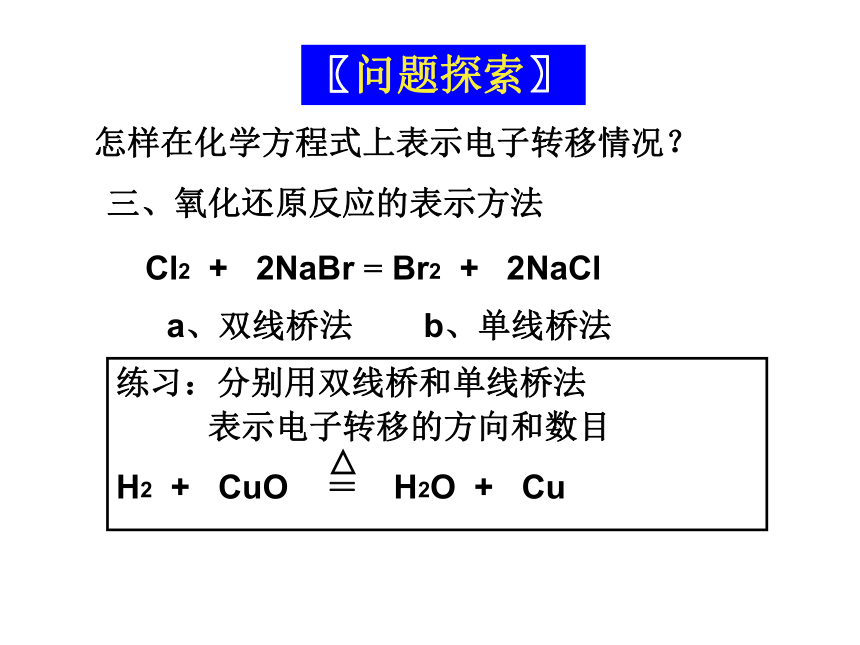
还原产物:(指生成物) (指生成物) 还原剂失去电子被氧化后的产物氧化剂得到电子被还原后的产物怎样在化学方程式上表示电子转移情况?〖问题探索〗a、双线桥法b、单线桥法三、氧化还原反应的表示方法Cl2 + 2NaBr = Br2 + 2NaCl氧化还原反应基本规律
1、守恒律:得电子总数=失电子总数
判断得失电子数目要以发生化合价变化的元素为基准
某元素得失电子数目=
发生化合价变化的原子数目×化合价的变化量 什么叫氧化性、还原性?〖掌握概念〗氧化性:
还原性:物质得电子的性质物质失电子的性质怎么判断物质具有氧化性还是还原性?看物质所含元素化合价的升降物质所含元素化合价的升高→还原性物质所含元素化合价的降低→氧化性氧化剂有氧化性,还原剂有还原性练习:下列由左边物质生成右边物质有无
氧化还原变化?左边物质表现什么性质?
(1) KI I2
(2)SO2 SO3
(3)SO2 S
(4)N2O5 N2O3
(5)KMnO4 K2MnO4还原性
还原性
氧化性
氧化性
氧化性〖问题探索〗怎样比较物质氧化性的强弱?
怎样比较物质还原性的强弱?1、根据氧化还原反应方程式判断氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物 以 强 制 弱 练习:已知下列氧化还原反应:
2FeCl3+2KI==2FeCl2+2KCl+I2 ;
2FeBr2+ Br2==2FeBr3
比较Cl2 、Br2 、 I2 、 Fe3+的氧化性强弱 2.金属活泼顺序表:
金属单质的还原性依次减弱,
其离子的氧化性依次增强;
同理,非金属单质越活泼即氧化性越强,
其离子的还原性越弱
3.根据反应条件:不同物质与相同物质反应,
谁条件越简单谁强 4、根据元素化合价判断(1)元素处于最高价态---只能得电子----只有氧化性
(2)元素处于最低价态---只能失电子----只有还原性
(3)元素处于中间价态---
-----即能得电子 ---既有氧化性
又能失电子 又有还原性[例]下列微粒中只有氧化性的是 ;
只有还原性的是 ,
既有氧化性又有还原性的是 。
(1) Cl2 (2)Cl- (3)Fe
(4)Fe2+ (5)Fe3+ (6) O2
(7) S2- (8) S (9) SO2 (10) HCl5、62、3、71、4、8、9、10氧化还原基本规律
一种氧化剂遇上几种还原剂时,
优先与还原性较强的物质反应
一种还原剂遇上几种氧化剂时,
优先与氧化性较强的物质反应思考:
向FeBr2溶液中逐渐通Cl2会有什么样的变化呢?
Think over:
已知三个氧化还原反应:
2FeCl3+2KI==2FeCl2+2KCl+I2 ; 2FeCl2+ Cl2==2FeCl3
2KMnO4+16HCl(浓)==2KCl+2MnCl2+5Cl2+8H2O
若某含氯离子的溶液中含有Fe2+和I-,现除去I-,而不影响
Fe2+和Cl-,可加入的试剂是 ( )
A.Cl2 B.KMnO4 C.FeCl3 D.HClC
氧化剂:
还原剂:
氧化产物:
还原产物:(指生成物) (指生成物) 还原剂失去电子被氧化后的产物氧化剂得到电子被还原后的产物怎样在化学方程式上表示电子转移情况?〖问题探索〗a、双线桥法b、单线桥法三、氧化还原反应的表示方法Cl2 + 2NaBr = Br2 + 2NaCl氧化还原反应基本规律
1、守恒律:得电子总数=失电子总数
判断得失电子数目要以发生化合价变化的元素为基准
某元素得失电子数目=
发生化合价变化的原子数目×化合价的变化量 什么叫氧化性、还原性?〖掌握概念〗氧化性:
还原性:物质得电子的性质物质失电子的性质怎么判断物质具有氧化性还是还原性?看物质所含元素化合价的升降物质所含元素化合价的升高→还原性物质所含元素化合价的降低→氧化性氧化剂有氧化性,还原剂有还原性练习:下列由左边物质生成右边物质有无
氧化还原变化?左边物质表现什么性质?
(1) KI I2
(2)SO2 SO3
(3)SO2 S
(4)N2O5 N2O3
(5)KMnO4 K2MnO4还原性
还原性
氧化性
氧化性
氧化性〖问题探索〗怎样比较物质氧化性的强弱?
怎样比较物质还原性的强弱?1、根据氧化还原反应方程式判断氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物 以 强 制 弱 练习:已知下列氧化还原反应:
2FeCl3+2KI==2FeCl2+2KCl+I2 ;
2FeBr2+ Br2==2FeBr3
比较Cl2 、Br2 、 I2 、 Fe3+的氧化性强弱 2.金属活泼顺序表:
金属单质的还原性依次减弱,
其离子的氧化性依次增强;
同理,非金属单质越活泼即氧化性越强,
其离子的还原性越弱
3.根据反应条件:不同物质与相同物质反应,
谁条件越简单谁强 4、根据元素化合价判断(1)元素处于最高价态---只能得电子----只有氧化性
(2)元素处于最低价态---只能失电子----只有还原性
(3)元素处于中间价态---
-----即能得电子 ---既有氧化性
又能失电子 又有还原性[例]下列微粒中只有氧化性的是 ;
只有还原性的是 ,
既有氧化性又有还原性的是 。
(1) Cl2 (2)Cl- (3)Fe
(4)Fe2+ (5)Fe3+ (6) O2
(7) S2- (8) S (9) SO2 (10) HCl5、62、3、71、4、8、9、10氧化还原基本规律
一种氧化剂遇上几种还原剂时,
优先与还原性较强的物质反应
一种还原剂遇上几种氧化剂时,
优先与氧化性较强的物质反应思考:
向FeBr2溶液中逐渐通Cl2会有什么样的变化呢?
Think over:
已知三个氧化还原反应:
2FeCl3+2KI==2FeCl2+2KCl+I2 ; 2FeCl2+ Cl2==2FeCl3
2KMnO4+16HCl(浓)==2KCl+2MnCl2+5Cl2+8H2O
若某含氯离子的溶液中含有Fe2+和I-,现除去I-,而不影响
Fe2+和Cl-,可加入的试剂是 ( )
A.Cl2 B.KMnO4 C.FeCl3 D.HClC
