氧化还原反应[上学期]
图片预览







文档简介
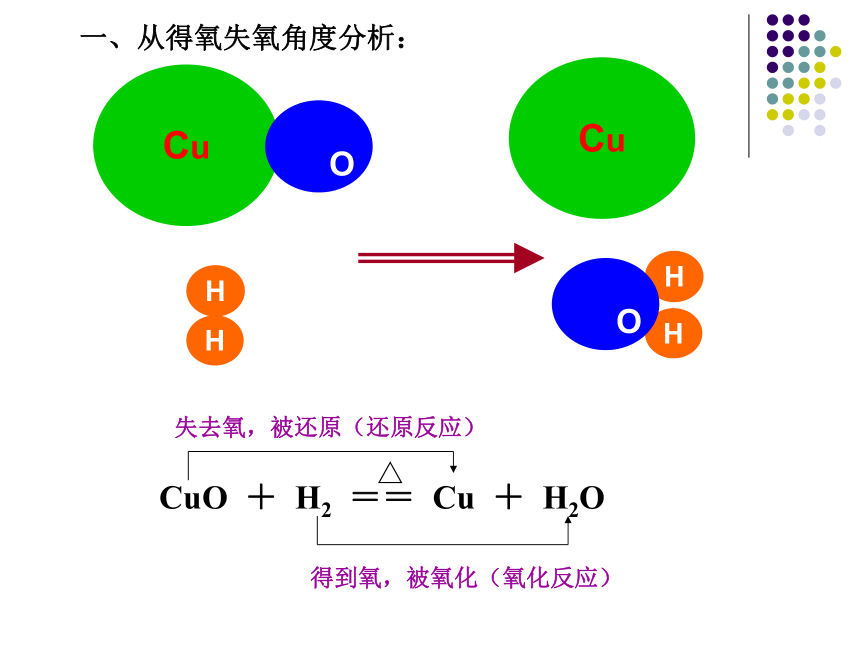
课件33张PPT。氧 化 还 原 反 应(1)宿迁中学高一化学备课组得到氧,被氧化(氧化反应)△CuO + H2 == Cu + H2O 失去氧,被还原(还原反应)Cu
OHHCuHH
O一、从得氧失氧角度分析:[问题]以上反应除了包含有得氧失氧的变化之外,还包含有什么变化?[结果]还包含有化合价的变化。+200+1化合价降低,被还原(还原反应)化合价升高,被氧化(氧化反应)CuO + H2 === Cu + H2O[定义]有元素化合价升降的化学反应称为氧化还原反应。二、从化合价升降角度分析:[问题]下列反应是否属于氧化还原反应?
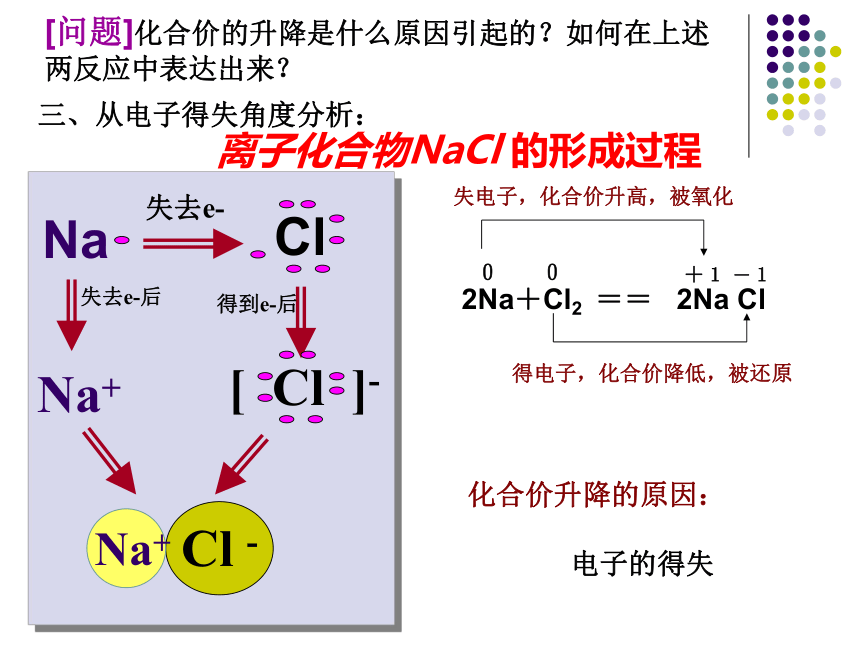
2Na+Cl2 === 2NaCl
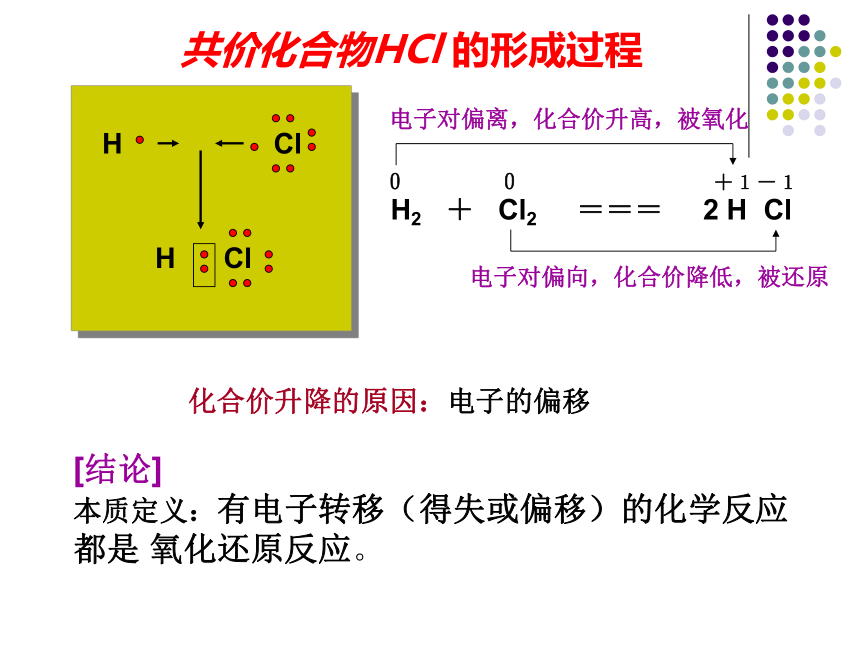
2H2+Cl2 === 2HCl
可见,从化合价升降角度不但可以
分析有得氧失氧的化学反应,也可以分
析没有得氧失氧的化学反应,扩大了概
念的适用范围。
[结论]因为有化合价升降,所以是氧化还原反应。[问题]化合价的升降是什么原因引起的?如何在上述两反应中表达出来?离子化合物NaCl 的形成过程化合价升降的原因:
电子的得失失去e-失去e-后得到e-后Na+三、从电子得失角度分析:[结论]
本质定义:有电子转移(得失或偏移)的化学反应都是 氧化还原反应。共价化合物HCl 的形成过程化合价升降的原因:电子的偏移H Cl氧化还原反应◆从得氧失氧角度分析
一种物质得到氧被氧化,同时另一种物质失去氧被还原
的化学反应是氧化还原反应。
特点:局限于得氧失氧的反应,是氧化还原反应的表观现象。
◆从化合价升降角度分析
有元素化合价升降的化学反应是氧化还原反应。
特点:可作为氧化还原反应的判断依据。
◆从电子转移角度分析
有电子转移(得失或偏移)的化学反应是氧化还原反应。
特点:揭示氧化还原反应的本质。
二、氧化还原反应1.概念
(1)氧化反应:物质所含元素化合价升高的反应
还原反应:物质所含元素化合价降低的反应
(2)氧化剂: 得到电子(或电子对偏向)的物质
还原剂: 失去电子(或电子对偏离)的物质
(3)氧化性: 氧化剂得到电子的性质
还原性: 还原剂失去电子的性质
(4)氧化产物:还原剂被氧化的产物
还原产物:氧化剂被还原的产物二、氧化还原反应2.联系
氧化剂 具有氧化性,反应中得到电子,
化合价降低,发生还原反应,
被还原成还原产物.
还原剂 具有还原性,反应中失去电子,
化合价升高,发生氧化反应,
被氧化成氧化产物.
⑤.课堂练习
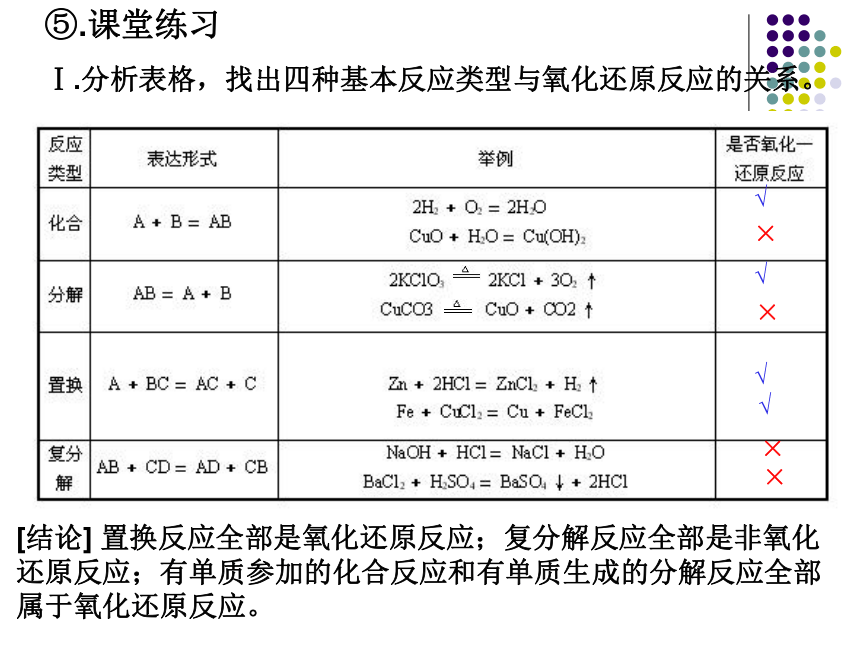
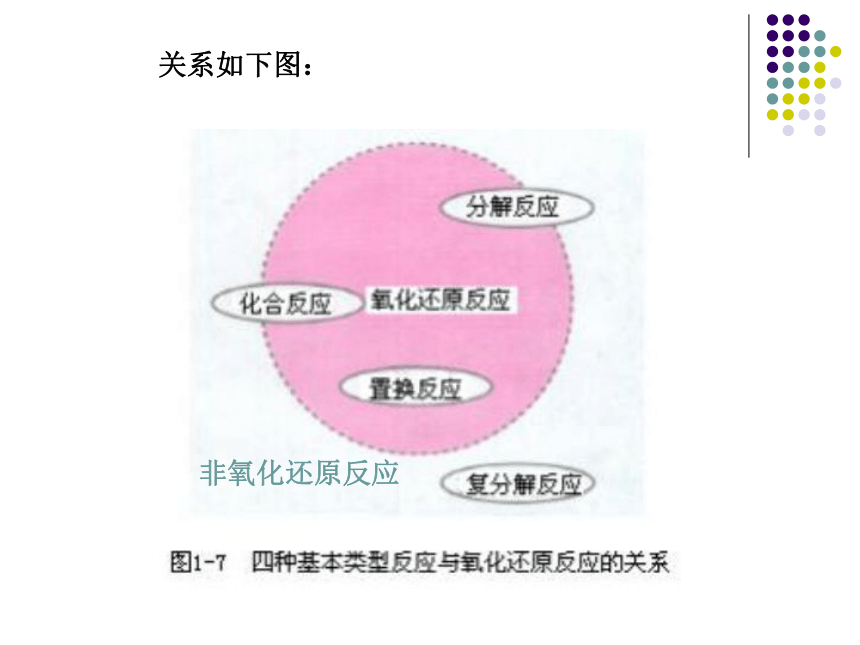
Ⅰ.分析表格,找出四种基本反应类型与氧化还原反应的关系。[结论] 置换反应全部是氧化还原反应;复分解反应全部是非氧化还原反应;有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。√×√×√√××关系如下图:非氧化还原反应Ⅱ.下列反应中属于氧化还原反应的是( )
A CaCO3 + 2HCl == CaCl2 + CO2↑ + H2O
B. Na2O + H2O == 2NaOH
C. 2KMnO4 == K2MnO4 + MnO2 + O2↑
D. MnO2 + 4HCl == MnCl2 + 2H2O + Cl2↑
E. 3Fe + 2O2 == Fe3O4
CuSO4·5H2O == CuSO4 + 5H2O
CDE小结一、氧化还原反应
1、定义:
2、特征:
3、本质: 凡有电子转移(得失或偏移)的反应叫氧化还原反应。 反应中有元素化合价的升降(化合价升高总数=化合价降低总数) 反应中有电子的得失或电子对的偏移(氧化剂得电子总数=还原剂失电子总数)二、氧化还原反应的基本概念及相互关系: 相互关系:
氧化剂 + 还原剂 还原产物 + 氧化产物
得ne-,化合价降低,被还原,发生还原反应失ne-,化合价升高,被氧化,发生氧化反应氧 化 还 原 反 应(2)宿迁中学高一化学备课组一、基本概念1、从得氧、失氧的角度氧化反应:
还原反应:
氧化还原反应:
氧化剂:
还原剂:物质得氧的反应
物质失氧的反应
失去氧的物质
得到氧的物质氧化性:
还原性:一、基本概念2、从化合价升降的角度氧化反应:
还原反应:
氧化还原反应:
氧化剂:
还原剂:氧化性:
还原性:一、基本概念3、从电子转移的角度氧化反应:
还原反应:
氧化还原反应:
氧化剂:
还原剂:氧化性:
还原性:氧化剂+还原剂=还原产物+氧化产物得 e -,价降,被还原失 e -,价升,被氧化4、各概念间关系二、四种基本反应与氧化还原反应的关系:化合反应:
分解反应:
置换反应:
复分解反应:有单质参加或生成的反应是氧化还原反应都是氧还反应都不是氧还反应练习:下列化学反应是否为氧化还原反应,若是请指明氧化剂、还原剂三、电子转移的表示方法:双线桥法:由氧化剂指向还原产物,由还原剂指向氧化产物,注明“得”、“失”和电子总数1、标出变价元素的化合价;
2、箭头由变化前起,至变化后终;
3、箭头上注明“得失”电子总数升价总数=降价总数单线桥法:由还原剂中升价元素指向氧化剂中降价元素,注明电子总数,不再写“得”“失”四、氧化还原类型Fe+H2SO4(稀)=FeSO4+H2↑电子转移发生在不同物质、不同元素间电子转移发生在不同物质、同种元素间电子转移发生在同种物质、不同元素间电子转移发生在同种物质、同种元素间Cl2+H2O=HCl+HClOFe+2FeCl3=3FeCl22KMnO4=K2MnO4+MnO2+O2↑△五、氧化性或还原性强弱的比较:
总原则:看反应进行的难易程度,不是看得失电子数目的多少1.根据反应方程式判断:氧化剂+还原剂=还原产物+氧化产物氧化性:氧化剂>氧化产物还原性:还原剂>还原产物F2>Cl2>Br2六、氧化还原反应的规律1.电子守恒 失电子总数=得电子总数 即:升价总数=降价总数2.“高价氧化低价还原,中间价态两边转”3.同种元素的高、低两种不同价态相互反应,化合价只靠拢不交叉。推论:同种元素的相邻价态不发生氧化还原反应,如H2S与S、S与SO2、SO2与H2SO4等。4.先后规律:一种氧化(还原)剂面对多种还原(氧化)剂时,优先与还原(氧化)性强的反应。5.强氧化剂与强还原剂一般能发生氧化还原反应 [练习] 2H2S+SO2 = 3S+2H2O当氧化产物比还原产物多 32g时,参加反应的SO2的质量为 g。64
OHHCuHH
O一、从得氧失氧角度分析:[问题]以上反应除了包含有得氧失氧的变化之外,还包含有什么变化?[结果]还包含有化合价的变化。+200+1化合价降低,被还原(还原反应)化合价升高,被氧化(氧化反应)CuO + H2 === Cu + H2O[定义]有元素化合价升降的化学反应称为氧化还原反应。二、从化合价升降角度分析:[问题]下列反应是否属于氧化还原反应?
2Na+Cl2 === 2NaCl
2H2+Cl2 === 2HCl
可见,从化合价升降角度不但可以
分析有得氧失氧的化学反应,也可以分
析没有得氧失氧的化学反应,扩大了概
念的适用范围。
[结论]因为有化合价升降,所以是氧化还原反应。[问题]化合价的升降是什么原因引起的?如何在上述两反应中表达出来?离子化合物NaCl 的形成过程化合价升降的原因:
电子的得失失去e-失去e-后得到e-后Na+三、从电子得失角度分析:[结论]
本质定义:有电子转移(得失或偏移)的化学反应都是 氧化还原反应。共价化合物HCl 的形成过程化合价升降的原因:电子的偏移H Cl氧化还原反应◆从得氧失氧角度分析
一种物质得到氧被氧化,同时另一种物质失去氧被还原
的化学反应是氧化还原反应。
特点:局限于得氧失氧的反应,是氧化还原反应的表观现象。
◆从化合价升降角度分析
有元素化合价升降的化学反应是氧化还原反应。
特点:可作为氧化还原反应的判断依据。
◆从电子转移角度分析
有电子转移(得失或偏移)的化学反应是氧化还原反应。
特点:揭示氧化还原反应的本质。
二、氧化还原反应1.概念
(1)氧化反应:物质所含元素化合价升高的反应
还原反应:物质所含元素化合价降低的反应
(2)氧化剂: 得到电子(或电子对偏向)的物质
还原剂: 失去电子(或电子对偏离)的物质
(3)氧化性: 氧化剂得到电子的性质
还原性: 还原剂失去电子的性质
(4)氧化产物:还原剂被氧化的产物
还原产物:氧化剂被还原的产物二、氧化还原反应2.联系
氧化剂 具有氧化性,反应中得到电子,
化合价降低,发生还原反应,
被还原成还原产物.
还原剂 具有还原性,反应中失去电子,
化合价升高,发生氧化反应,
被氧化成氧化产物.
⑤.课堂练习
Ⅰ.分析表格,找出四种基本反应类型与氧化还原反应的关系。[结论] 置换反应全部是氧化还原反应;复分解反应全部是非氧化还原反应;有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。√×√×√√××关系如下图:非氧化还原反应Ⅱ.下列反应中属于氧化还原反应的是( )
A CaCO3 + 2HCl == CaCl2 + CO2↑ + H2O
B. Na2O + H2O == 2NaOH
C. 2KMnO4 == K2MnO4 + MnO2 + O2↑
D. MnO2 + 4HCl == MnCl2 + 2H2O + Cl2↑
E. 3Fe + 2O2 == Fe3O4
CuSO4·5H2O == CuSO4 + 5H2O
CDE小结一、氧化还原反应
1、定义:
2、特征:
3、本质: 凡有电子转移(得失或偏移)的反应叫氧化还原反应。 反应中有元素化合价的升降(化合价升高总数=化合价降低总数) 反应中有电子的得失或电子对的偏移(氧化剂得电子总数=还原剂失电子总数)二、氧化还原反应的基本概念及相互关系: 相互关系:
氧化剂 + 还原剂 还原产物 + 氧化产物
得ne-,化合价降低,被还原,发生还原反应失ne-,化合价升高,被氧化,发生氧化反应氧 化 还 原 反 应(2)宿迁中学高一化学备课组一、基本概念1、从得氧、失氧的角度氧化反应:
还原反应:
氧化还原反应:
氧化剂:
还原剂:物质得氧的反应
物质失氧的反应
失去氧的物质
得到氧的物质氧化性:
还原性:一、基本概念2、从化合价升降的角度氧化反应:
还原反应:
氧化还原反应:
氧化剂:
还原剂:氧化性:
还原性:一、基本概念3、从电子转移的角度氧化反应:
还原反应:
氧化还原反应:
氧化剂:
还原剂:氧化性:
还原性:氧化剂+还原剂=还原产物+氧化产物得 e -,价降,被还原失 e -,价升,被氧化4、各概念间关系二、四种基本反应与氧化还原反应的关系:化合反应:
分解反应:
置换反应:
复分解反应:有单质参加或生成的反应是氧化还原反应都是氧还反应都不是氧还反应练习:下列化学反应是否为氧化还原反应,若是请指明氧化剂、还原剂三、电子转移的表示方法:双线桥法:由氧化剂指向还原产物,由还原剂指向氧化产物,注明“得”、“失”和电子总数1、标出变价元素的化合价;
2、箭头由变化前起,至变化后终;
3、箭头上注明“得失”电子总数升价总数=降价总数单线桥法:由还原剂中升价元素指向氧化剂中降价元素,注明电子总数,不再写“得”“失”四、氧化还原类型Fe+H2SO4(稀)=FeSO4+H2↑电子转移发生在不同物质、不同元素间电子转移发生在不同物质、同种元素间电子转移发生在同种物质、不同元素间电子转移发生在同种物质、同种元素间Cl2+H2O=HCl+HClOFe+2FeCl3=3FeCl22KMnO4=K2MnO4+MnO2+O2↑△五、氧化性或还原性强弱的比较:
总原则:看反应进行的难易程度,不是看得失电子数目的多少1.根据反应方程式判断:氧化剂+还原剂=还原产物+氧化产物氧化性:氧化剂>氧化产物还原性:还原剂>还原产物F2>Cl2>Br2六、氧化还原反应的规律1.电子守恒 失电子总数=得电子总数 即:升价总数=降价总数2.“高价氧化低价还原,中间价态两边转”3.同种元素的高、低两种不同价态相互反应,化合价只靠拢不交叉。推论:同种元素的相邻价态不发生氧化还原反应,如H2S与S、S与SO2、SO2与H2SO4等。4.先后规律:一种氧化(还原)剂面对多种还原(氧化)剂时,优先与还原(氧化)性强的反应。5.强氧化剂与强还原剂一般能发生氧化还原反应 [练习] 2H2S+SO2 = 3S+2H2O当氧化产物比还原产物多 32g时,参加反应的SO2的质量为 g。64
