氧化还原反应[上学期]
图片预览





文档简介
课件18张PPT。第一节
——氧化还原反应一.教学目标:
1.了解化学反应的几种不同的分类方法。
2.能用化合价升降的观点及电子转移的观点理解氧化还原反应,学会利用“双线桥”法分析氧化还原还原反应。
3.能运用对立统一等辨证唯物主义观点认识氧化还原反应有关的概念。二、氧化还原反应的定义 同学们,我们在初中化学熟悉了很多化学反应,现在在高中化学课程中我们会学到更多的,实用的化学反应!可以这么说:化学方程式是化学家的交流语言,因此必须从一般原理上去研究化学反应的本质问题。回忆一下我们以前在初中所学的四大基本反应类型是怎样呢? 因为只有在从本质上掌握一般原理,才会很轻松的去书写化学方程式,而不是去记忆,化学方程式从而不是杂乱无章,是有规律可寻的,是有趣的!(1)CuO+H2= Cu+H2O (2)H2SO4+Ba(OH)2=BaSO46+2H2O
(3)CO2+Cu+H2O=Cu(OH)2CO3
(4)NH4HCO3=NH3+H2O+CO2
(5)Fe2O3+3CO=Fe+3CO2
请分析下面反应属于哪一类型?
————氧化还原反应:
(1):概念——凡有元素化合价升降的化学反应即~
(2):特征(判断方法)——有物质中的元素化合价发生变化了。
(3):本质:反应过程中有电子得失(或偏移)。
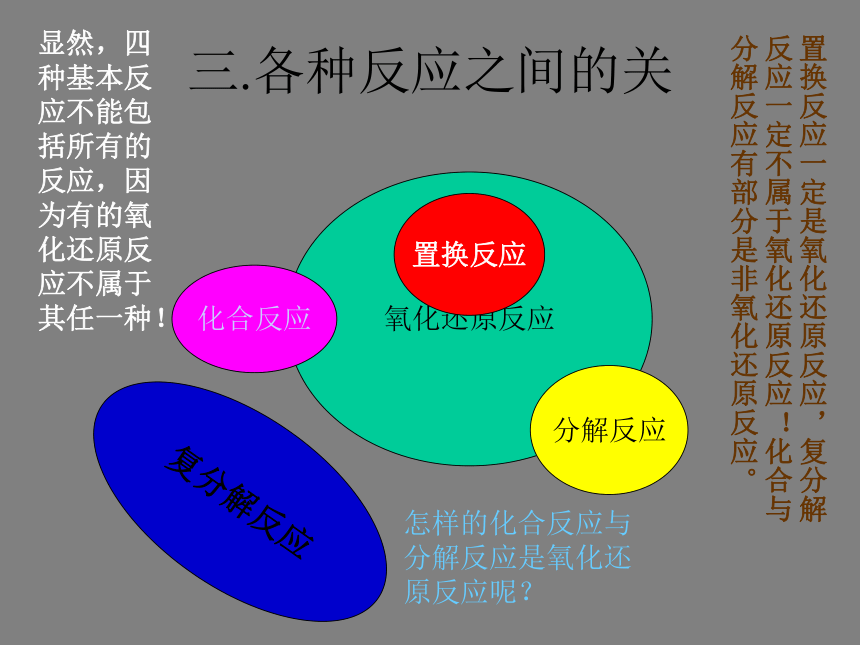
凡没有电子转移(得失或偏移)的反应,就是非氧化还原反应。三.各种反应之间的关 氧化还原反应置换反应化合反应分解反应复分解反应显然,四种基本反应不能包括所有的反应,因为有的氧化还原反应不属于其任一种!置换反应一定是氧化还原反应,复分解反应一定不属于氧化还原反应!化合与分解反应有部分是非氧化还原反应。
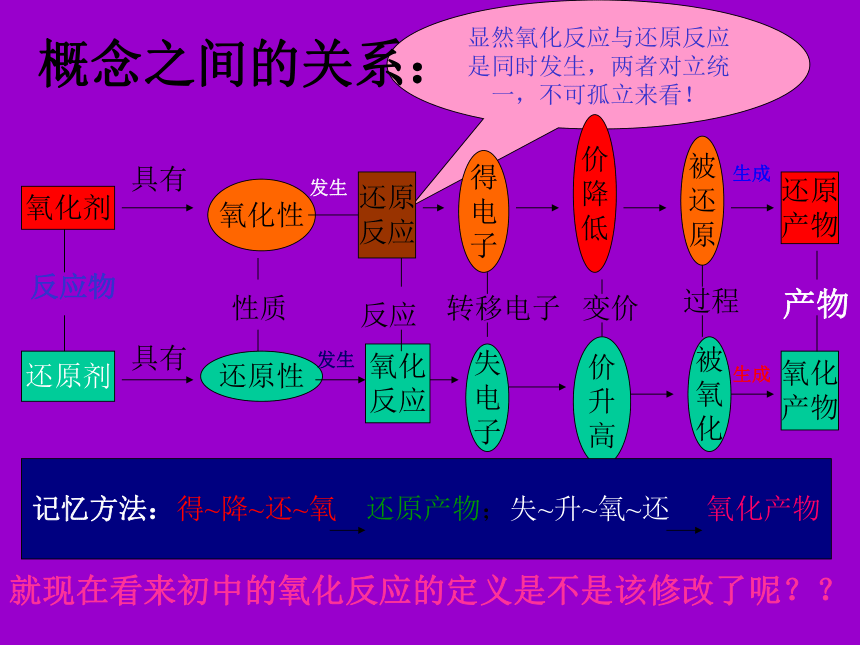
怎样的化合反应与分解反应是氧化还原反应呢?四、氧化还原反应的有关概念1、氧化与还原:2、氧化剂与还原剂:3、氧化性与还原性:4、氧化产物与还原产物:失去电子(或电子对偏离)的变化称为氧化;得到电子(或电子对的偏向)的变化称为还原。 在化学反应中,得到电子(或电子对偏向)的物质称为氧化剂;失去电子(或电子对偏离)的物质称为还原剂。氧化剂具有氧化性,还原剂具有还原性。还原剂在反应中失去电子(化合价升高)后被氧化形成的生成物称为氧化产物;氧化剂在反应中结合电子(化合价降低)后被还原形成的生成物称为还原产物。显然氧化反应与还原反应是同时发生,两者对立统一,不可孤立来看!概念之间的关系:氧化剂还原剂具有反应物具有氧化性还原性 性质发生发生还原
反应氧化
反应反应得
电
子失
电
子转移电子价
降
低价
升
高变价被
还
原被
氧
化过程还原
产物氧化
产物产物生成生成记忆方法:得~降~还~氧 还原产物;失~升~氧~还 氧化产物就现在看来初中的氧化反应的定义是不是该修改了呢??示例:5KI+KIO3+3H2SO4==3I2+3K2SO4+3H2O-1+50得1 × 6e—,化合价降低,被还原失5 × e—,化合价升高,被氧化双线桥表示法!下面稍后介绍!1.氧化剂是?还原剂是?KIO3 ;KI2.被氧化的元素是?被还原的元素是?I; I—1+53.氧化产物和还原产物是什么?其质量只比是多少?均为:I2;5:14.反应中硫酸的作用??既不是氧化剂也不是还原剂!只是提供酸性环境而已!5.谁有氧化性?谁有还原性?五、氧化还原反应中的电子转移表示方法——“双线桥”法与“单线桥”法1.双线桥法
(1).“双线桥”法的含义:
①.表示元素化合价的变化过程。(写明化合价升、降)
②.表示变价过程的反应类型。(氧化反应或还原反应)
③.表示变价过程的电子转移情况。(写明得或“+”、失或“—”电子的数目)(2)、“双线桥”的画法:
A.连接反应前后不同价态的同种元素。
B.线桥跨越“=”从左边到右边。 C.使得失电子总数相等。示例: CuO+ H2 == Cu+H2O +200+1失2× e— ,化合价升高,被氧化得2× e— ,化合价降低,被还原(2).“单线桥” 表示法——了解,基础好的可掌握!
① .含义:表示氧化还原反应过程的电子转移方向和数目!
② .画法:A.连接化合价变化的不同元素;B.线桥不跨过“=”只在左边从还原剂指向氧化剂;C.写出得失电子的总数。
③ .示例:2NaIO3+5NaHSO3==3NaHSO4+2Na2SO4+I2+H2O+5+4+6+60失:5×2e— 氧化剂还原剂氧化产物还原产物对比“双线桥”法:2NaIO3+5NaHSO3==3NaHSO4+2Na2SO4+I2+H2O化合价降低,被还原,得:2×5 e— 化合价升高,被氧化,共失: 5 ×2 e—很显然掌握了单线桥法比双线桥简洁明了!不过初学者要小心的使用,多去练习方能水到渠成!六、化合价的有关规律(1)金属元素一般没有负化合价,除零价外只显正价,因为在反应中只能失去电子。
(2)非金属元素(除氧、氟外)在反应中既可能得到电子也可失去电子,故既可显正价也可以显负价。
(3)氧、氟的非金属性很强,在反应中一般不失去电子,故一般没有正化合价。
(4)显最高价的元素,在反应中只能得到电子而不能失去电子,故发生氧化还原反应时化合价只能降低。相反,显最底化合价的元素,在发生氧化还原反应时化合价只能升高。七、物质氧化性或还原性的相对强弱的判断规律(1)发生化合价变化的元素在元素周期表中的位置及原子的特征电子构型(见物质结构元素周期律一章介绍!)(2)金属活动顺序与非金属活动顺序。K、Ca、Na、Mg、Al、Zn、Cr、Fe、Ni、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au 还原性逐渐增强K+、Ca2+、Na+、Mg2+、Al3+、Zn2+、Cr3+、Fe2+、Ni2+、Sn2+、Pb2+、(H+)、Cu2+、Fe3+、Hg2+、Ag+、Pt2+、Au3+氧化性增强F2、Cl2、O2、Br2、I2、S、N2、P、C、Si、H2 氧化性减弱,还原性增强(3)非金属气态氢化物还原性同一主族:HI>HBr>HCl>HF 同一周期:SiH4>PH3>H2S>HCl 上到下增强左减弱到右(4)根据实验事实得出结论。根据实验事实,对于一个氧化还原反应,一般有如下规律:还化剂+氧原剂=氧化产物还原产物+得电子,价态降低、被还原失去电子、价态升高、被氧化氧化性:(强)氧原剂(反应物)>氧化产物(产物)(弱氧化剂)还原性:(强)还原剂(反应物)还原产物(产物)(弱还原剂)(5)、由反应条件的难易比较。A、不同的氧化剂与同一还原剂反应,反应条件越易,氧化性越强或还原剂被氧化的程度越大,氧化剂的氧化性越强。例如:卤素单质与氢气的化合的条件比较可证明其氧化性顺序;Cl2和S与Fe反应分别生成FeCl3和FeS可证明其氧化性顺序 。B、不同还原剂与同一氧化剂反应,反应条件越易,还原性越强或氧化剂被还原的程度越大,还原剂的还原性越强。(6)值得注意的几点:A、同一元素的不同价态,要注意不能作出非金属元素价态越高氧化性越强的结论。例如:硫的含氧酸氧化性:H2SO4>H2SO3 +6+4氯的含氧酸氧化:HClO4O2,而F2 2F-,O2 2O2-得电子数比F2多。得2e-得4e-C、影响氧化还原的因素:(I)氧化剂、还原剂的相对强弱!(只有强氧化剂和强还原剂才能发生反应)(严格说应由电极电势比较!)(II)溶液浓度影响(不同浓度的发生不同反应,产生不同产物(III)温度影响(IV)反应介质(如:酸性、中性、碱性等)八、氧化还原反应的基本规律及其应用(1)守恒规律:化合价有升必有降,电子有得必有失。对于一个完整的氧化还原反应,化合价价升高总数与降低总数相等,失电子总数与得电子总数相等。应用:有关氧化还原反应的计算及配平氧化还原反应方程式。例1、以知某物质的XO(OH)2+与Na2SO3反应时,XO(OH)2+作氧化剂,Na2SO3被氧化为Na2SO4。经测得2分子XO(OH)2+与5分子的Na2SO3恰好完全作用。试问XO(OH)2+还原后X的最终价态是( )(A)、3 (B)、4 (C)、5 (D)、0分析与解答:先分析各元素化合价的变化:(设X最终价态为:a)XO(OH)2+ X+5a得(5—a)eNa2SO3 Na2SO4+4+6失(6—4)e根据氧化剂、还原剂得失电子的物质的总数相等,则有等式:
2X(5—a)=5X(6—4) 解得:a=0 所以选(D)例2、配平方程式:Fe(OH)3+NaOH+Cl2 Na2FeO4+NaCl+H2O分析与解答:关于氧化还原方程式的配平问题以后要专门的讲解,现在只做个基本了解,有能力者可掌握!下面以本例为基础讲讲其配平的基本步骤!(A).氧化还原方程式配平基本步骤:(I).写出反应物和生成物的分子式,并列出发生氧化还原反应的化合价(简称标价态).(II).分别列出元素化合价升高数值(或失电子数)与与元素化合价降低数值(或得电子数).(简称定得失).(III).求化合价升降值(或得失电子数目)的最小公倍数.配平氧化剂、还原剂、氧化产物、还原产物的系数.(IV).用观察法配平其他物质的系数.并且将“箭头”改为“等号”,检验是否真正配平。(B)本例的配平.可按上述方法步骤进行,熟练后可省略中间步骤很快的完成哦!此法比待定系数法一般要来得快(I)、标价态:Fe(OH)3 Na2FeO4 失3e-+3+6(II)、定得失:Cl2 2Cl- 得2e-0-1最小公倍数62X3e-3X2e-(III).确定氧化剂、还原剂、氧化产物、还原产物的系数2Fe(OH)3+NaOH+3Cl2 2Na2FeO4+6NaCl+H2O(IV).用观察法配平其他物质的系数2Fe(OH)3+10NaOH+3Cl2 2Na2FeO4+6NaCl+8H2O(2)、价态规律:元素处于最高价,只有氧化性;处于最低价,只有还原性。处于中间价态既有氧化性又有还原性,但是主要呈现一种性质。若某物质由多种元素组成,其性质由这些元素性质的综合体现。应用:判断元素或物质有无氧化性、还原性例3.下列叙述中正确的是?( )A、含最高价元素的化合物,一定具有氧化性;B、阳离子只有氧化性,阴离子只有还原性;C、失电子越多、还原性越强,失电子越少还原性越弱;D、强氧化剂与强还原剂不一定能发生氧化还原反应。D(3)强弱规律:较强的氧化剂和较强的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。应用:在适宜的条件下,用氧化性较强的物质制备氧化性较弱的物质,或用还原性较强的物质制备还原性较弱的物质;亦可用于比较物质间氧化性或还原性的强弱。例4、G、Q、X、Y、Z均为含氯元素的物质。我们不了解它们的化学式,但知道它们之间在一定条件下的如下的转换关系(未配平):① G Q+NaCl② Q+H2O X+H2电解③ Y+NaOH G+Q+H2O④ Z+NaOH Q+X+H2O这五种化合物中氯的化合价由高到低的顺序为( )A、QGZYX B、GYQZX C、GYZQX D、ZXGYQB分析与解答:根据规律(1)、(2)、(3)以得注释:关于归中反应与歧化反应的介绍不同价态的同种元素间发生氧化还原反应,其结果是两种价态只能相互靠近或最多达到相同的价态,而决不会出现高价态变低、低价态变高的交叉现象。——归中反应规律处于中间价态的化合物,其某一部分转化为较低价态,一部分转变为较高价态的反应,称之为歧化反应(4)、转化规律:氧化还原反应中,以元素相邻价态间的转化最容易;同种元素之间的氧化还原反应,化合价遵循“高价+低价 中间价”(即价态归中);同种元素相邻价态之间不会发生氧化还原反应。应用:分析判断氧化还原反应能否发生。(5)、难易规律:越易失电子的物质,失后就越难得电子,越易得电子的物质,得后就难失电子。一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应;同理,一种氧化剂遇多种氧化剂时,氧化性最强的优先发生反应。应用:判断物质的稳定性及反应顺序。(注意:难失电子的物质不一定易得电子!你能句举个例子吗???)
1.了解化学反应的几种不同的分类方法。
2.能用化合价升降的观点及电子转移的观点理解氧化还原反应,学会利用“双线桥”法分析氧化还原还原反应。
3.能运用对立统一等辨证唯物主义观点认识氧化还原反应有关的概念。二、氧化还原反应的定义 同学们,我们在初中化学熟悉了很多化学反应,现在在高中化学课程中我们会学到更多的,实用的化学反应!可以这么说:化学方程式是化学家的交流语言,因此必须从一般原理上去研究化学反应的本质问题。回忆一下我们以前在初中所学的四大基本反应类型是怎样呢? 因为只有在从本质上掌握一般原理,才会很轻松的去书写化学方程式,而不是去记忆,化学方程式从而不是杂乱无章,是有规律可寻的,是有趣的!(1)CuO+H2= Cu+H2O (2)H2SO4+Ba(OH)2=BaSO46+2H2O
(3)CO2+Cu+H2O=Cu(OH)2CO3
(4)NH4HCO3=NH3+H2O+CO2
(5)Fe2O3+3CO=Fe+3CO2
请分析下面反应属于哪一类型?
————氧化还原反应:
(1):概念——凡有元素化合价升降的化学反应即~
(2):特征(判断方法)——有物质中的元素化合价发生变化了。
(3):本质:反应过程中有电子得失(或偏移)。
凡没有电子转移(得失或偏移)的反应,就是非氧化还原反应。三.各种反应之间的关 氧化还原反应置换反应化合反应分解反应复分解反应显然,四种基本反应不能包括所有的反应,因为有的氧化还原反应不属于其任一种!置换反应一定是氧化还原反应,复分解反应一定不属于氧化还原反应!化合与分解反应有部分是非氧化还原反应。
怎样的化合反应与分解反应是氧化还原反应呢?四、氧化还原反应的有关概念1、氧化与还原:2、氧化剂与还原剂:3、氧化性与还原性:4、氧化产物与还原产物:失去电子(或电子对偏离)的变化称为氧化;得到电子(或电子对的偏向)的变化称为还原。 在化学反应中,得到电子(或电子对偏向)的物质称为氧化剂;失去电子(或电子对偏离)的物质称为还原剂。氧化剂具有氧化性,还原剂具有还原性。还原剂在反应中失去电子(化合价升高)后被氧化形成的生成物称为氧化产物;氧化剂在反应中结合电子(化合价降低)后被还原形成的生成物称为还原产物。显然氧化反应与还原反应是同时发生,两者对立统一,不可孤立来看!概念之间的关系:氧化剂还原剂具有反应物具有氧化性还原性 性质发生发生还原
反应氧化
反应反应得
电
子失
电
子转移电子价
降
低价
升
高变价被
还
原被
氧
化过程还原
产物氧化
产物产物生成生成记忆方法:得~降~还~氧 还原产物;失~升~氧~还 氧化产物就现在看来初中的氧化反应的定义是不是该修改了呢??示例:5KI+KIO3+3H2SO4==3I2+3K2SO4+3H2O-1+50得1 × 6e—,化合价降低,被还原失5 × e—,化合价升高,被氧化双线桥表示法!下面稍后介绍!1.氧化剂是?还原剂是?KIO3 ;KI2.被氧化的元素是?被还原的元素是?I; I—1+53.氧化产物和还原产物是什么?其质量只比是多少?均为:I2;5:14.反应中硫酸的作用??既不是氧化剂也不是还原剂!只是提供酸性环境而已!5.谁有氧化性?谁有还原性?五、氧化还原反应中的电子转移表示方法——“双线桥”法与“单线桥”法1.双线桥法
(1).“双线桥”法的含义:
①.表示元素化合价的变化过程。(写明化合价升、降)
②.表示变价过程的反应类型。(氧化反应或还原反应)
③.表示变价过程的电子转移情况。(写明得或“+”、失或“—”电子的数目)(2)、“双线桥”的画法:
A.连接反应前后不同价态的同种元素。
B.线桥跨越“=”从左边到右边。 C.使得失电子总数相等。示例: CuO+ H2 == Cu+H2O +200+1失2× e— ,化合价升高,被氧化得2× e— ,化合价降低,被还原(2).“单线桥” 表示法——了解,基础好的可掌握!
① .含义:表示氧化还原反应过程的电子转移方向和数目!
② .画法:A.连接化合价变化的不同元素;B.线桥不跨过“=”只在左边从还原剂指向氧化剂;C.写出得失电子的总数。
③ .示例:2NaIO3+5NaHSO3==3NaHSO4+2Na2SO4+I2+H2O+5+4+6+60失:5×2e— 氧化剂还原剂氧化产物还原产物对比“双线桥”法:2NaIO3+5NaHSO3==3NaHSO4+2Na2SO4+I2+H2O化合价降低,被还原,得:2×5 e— 化合价升高,被氧化,共失: 5 ×2 e—很显然掌握了单线桥法比双线桥简洁明了!不过初学者要小心的使用,多去练习方能水到渠成!六、化合价的有关规律(1)金属元素一般没有负化合价,除零价外只显正价,因为在反应中只能失去电子。
(2)非金属元素(除氧、氟外)在反应中既可能得到电子也可失去电子,故既可显正价也可以显负价。
(3)氧、氟的非金属性很强,在反应中一般不失去电子,故一般没有正化合价。
(4)显最高价的元素,在反应中只能得到电子而不能失去电子,故发生氧化还原反应时化合价只能降低。相反,显最底化合价的元素,在发生氧化还原反应时化合价只能升高。七、物质氧化性或还原性的相对强弱的判断规律(1)发生化合价变化的元素在元素周期表中的位置及原子的特征电子构型(见物质结构元素周期律一章介绍!)(2)金属活动顺序与非金属活动顺序。K、Ca、Na、Mg、Al、Zn、Cr、Fe、Ni、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au 还原性逐渐增强K+、Ca2+、Na+、Mg2+、Al3+、Zn2+、Cr3+、Fe2+、Ni2+、Sn2+、Pb2+、(H+)、Cu2+、Fe3+、Hg2+、Ag+、Pt2+、Au3+氧化性增强F2、Cl2、O2、Br2、I2、S、N2、P、C、Si、H2 氧化性减弱,还原性增强(3)非金属气态氢化物还原性同一主族:HI>HBr>HCl>HF 同一周期:SiH4>PH3>H2S>HCl 上到下增强左减弱到右(4)根据实验事实得出结论。根据实验事实,对于一个氧化还原反应,一般有如下规律:还化剂+氧原剂=氧化产物还原产物+得电子,价态降低、被还原失去电子、价态升高、被氧化氧化性:(强)氧原剂(反应物)>氧化产物(产物)(弱氧化剂)还原性:(强)还原剂(反应物)还原产物(产物)(弱还原剂)(5)、由反应条件的难易比较。A、不同的氧化剂与同一还原剂反应,反应条件越易,氧化性越强或还原剂被氧化的程度越大,氧化剂的氧化性越强。例如:卤素单质与氢气的化合的条件比较可证明其氧化性顺序;Cl2和S与Fe反应分别生成FeCl3和FeS可证明其氧化性顺序 。B、不同还原剂与同一氧化剂反应,反应条件越易,还原性越强或氧化剂被还原的程度越大,还原剂的还原性越强。(6)值得注意的几点:A、同一元素的不同价态,要注意不能作出非金属元素价态越高氧化性越强的结论。例如:硫的含氧酸氧化性:H2SO4>H2SO3 +6+4氯的含氧酸氧化:HClO4
2X(5—a)=5X(6—4) 解得:a=0 所以选(D)例2、配平方程式:Fe(OH)3+NaOH+Cl2 Na2FeO4+NaCl+H2O分析与解答:关于氧化还原方程式的配平问题以后要专门的讲解,现在只做个基本了解,有能力者可掌握!下面以本例为基础讲讲其配平的基本步骤!(A).氧化还原方程式配平基本步骤:(I).写出反应物和生成物的分子式,并列出发生氧化还原反应的化合价(简称标价态).(II).分别列出元素化合价升高数值(或失电子数)与与元素化合价降低数值(或得电子数).(简称定得失).(III).求化合价升降值(或得失电子数目)的最小公倍数.配平氧化剂、还原剂、氧化产物、还原产物的系数.(IV).用观察法配平其他物质的系数.并且将“箭头”改为“等号”,检验是否真正配平。(B)本例的配平.可按上述方法步骤进行,熟练后可省略中间步骤很快的完成哦!此法比待定系数法一般要来得快(I)、标价态:Fe(OH)3 Na2FeO4 失3e-+3+6(II)、定得失:Cl2 2Cl- 得2e-0-1最小公倍数62X3e-3X2e-(III).确定氧化剂、还原剂、氧化产物、还原产物的系数2Fe(OH)3+NaOH+3Cl2 2Na2FeO4+6NaCl+H2O(IV).用观察法配平其他物质的系数2Fe(OH)3+10NaOH+3Cl2 2Na2FeO4+6NaCl+8H2O(2)、价态规律:元素处于最高价,只有氧化性;处于最低价,只有还原性。处于中间价态既有氧化性又有还原性,但是主要呈现一种性质。若某物质由多种元素组成,其性质由这些元素性质的综合体现。应用:判断元素或物质有无氧化性、还原性例3.下列叙述中正确的是?( )A、含最高价元素的化合物,一定具有氧化性;B、阳离子只有氧化性,阴离子只有还原性;C、失电子越多、还原性越强,失电子越少还原性越弱;D、强氧化剂与强还原剂不一定能发生氧化还原反应。D(3)强弱规律:较强的氧化剂和较强的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。应用:在适宜的条件下,用氧化性较强的物质制备氧化性较弱的物质,或用还原性较强的物质制备还原性较弱的物质;亦可用于比较物质间氧化性或还原性的强弱。例4、G、Q、X、Y、Z均为含氯元素的物质。我们不了解它们的化学式,但知道它们之间在一定条件下的如下的转换关系(未配平):① G Q+NaCl② Q+H2O X+H2电解③ Y+NaOH G+Q+H2O④ Z+NaOH Q+X+H2O这五种化合物中氯的化合价由高到低的顺序为( )A、QGZYX B、GYQZX C、GYZQX D、ZXGYQB分析与解答:根据规律(1)、(2)、(3)以得注释:关于归中反应与歧化反应的介绍不同价态的同种元素间发生氧化还原反应,其结果是两种价态只能相互靠近或最多达到相同的价态,而决不会出现高价态变低、低价态变高的交叉现象。——归中反应规律处于中间价态的化合物,其某一部分转化为较低价态,一部分转变为较高价态的反应,称之为歧化反应(4)、转化规律:氧化还原反应中,以元素相邻价态间的转化最容易;同种元素之间的氧化还原反应,化合价遵循“高价+低价 中间价”(即价态归中);同种元素相邻价态之间不会发生氧化还原反应。应用:分析判断氧化还原反应能否发生。(5)、难易规律:越易失电子的物质,失后就越难得电子,越易得电子的物质,得后就难失电子。一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应;同理,一种氧化剂遇多种氧化剂时,氧化性最强的优先发生反应。应用:判断物质的稳定性及反应顺序。(注意:难失电子的物质不一定易得电子!你能句举个例子吗???)
