离子反应[下学期]
图片预览

文档简介
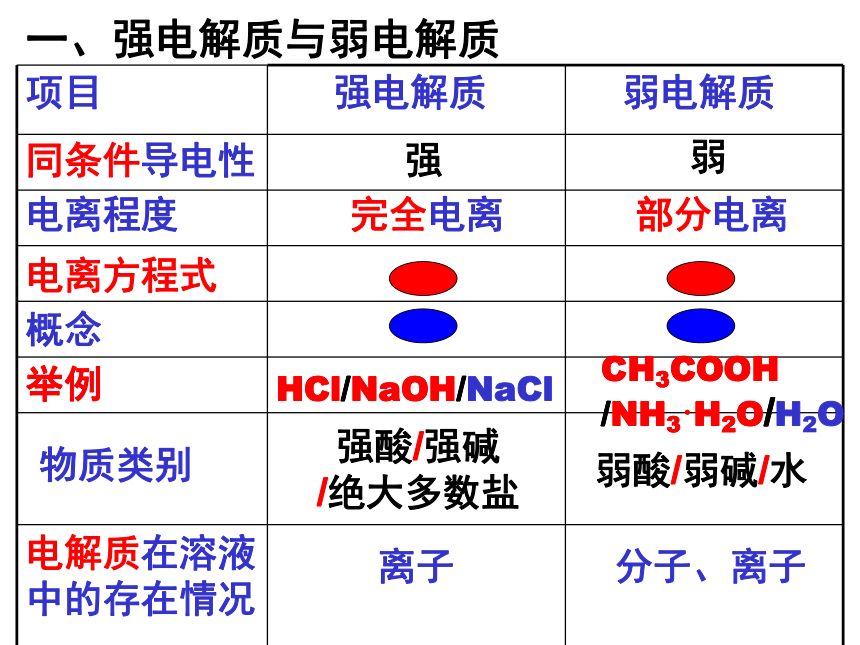
课件9张PPT。一、强电解质与弱电解质完全电离部分电离强弱离子分子、离子 强酸/强碱 /绝大多数盐弱酸/弱碱/水HCl/NaOH/CH3COOH /NH3·H2O/同条件导电性举例电离程度电离方程式概念物质类别电解质在溶液中的存在情况HCl/NaOH/NaClCH3COOH /NH3·H2O/H2O
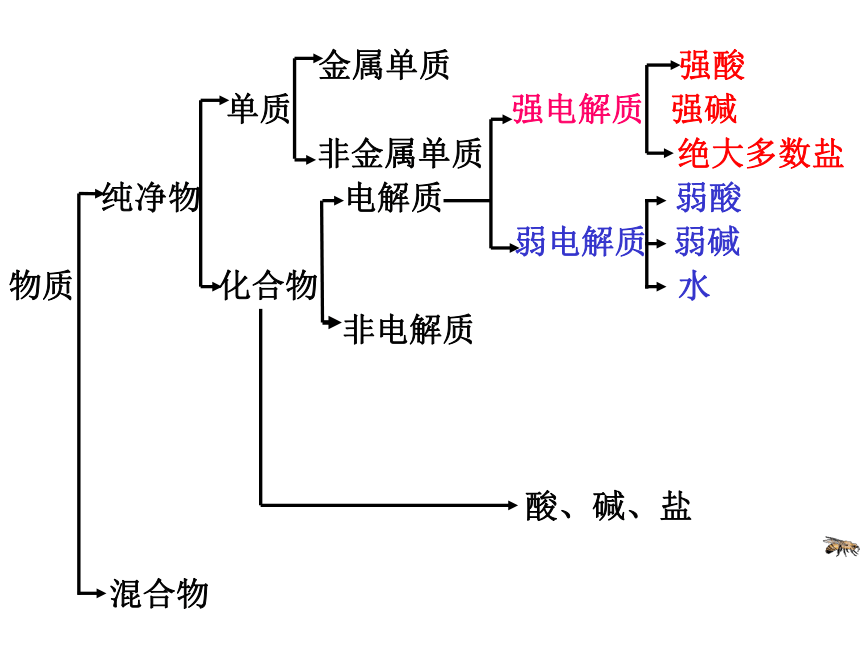
金属单质 强酸
单质 强电解质 强碱
非金属单质 绝大多数盐
纯净物 电解质 弱酸
弱电解质 弱碱
物质 化合物 水
非电解质
酸、碱、盐
混合物判断下列物质中谁是强电解质
HCl、醋酸、NaOH、Cu(OH)2、H3PO4
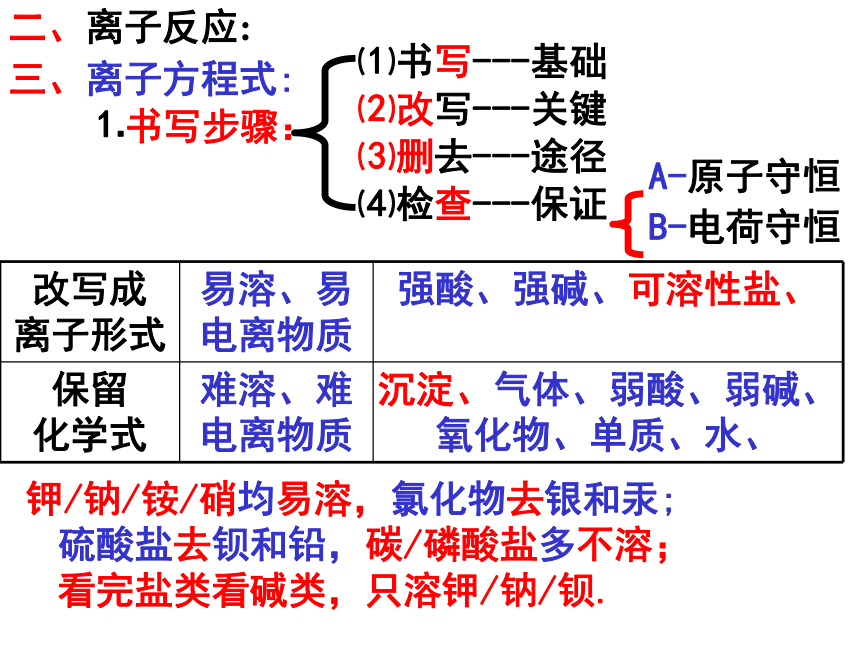
NaCl、AgCl、NH3·H2O、蔗糖、CO2即 时 巩 固二、离子反应:⑶删去---途径⑴书写---基础⑵改写---关键⑷检查---保证钾/钠/铵/硝均易溶,氯化物去银和汞; 硫酸盐去钡和铅,碳/磷酸盐多不溶; 看完盐类看碱类,只溶钾/钠/钡.三、离子方程式:⒈书写步骤:A-原子守恒
B-电荷守恒⑴HCl+NaOH=NaCl+H2O⑵H2SO4+2KOH=K2SO4+2H2O⑶CH3COOH+NaOH=CH3COONa+H2O⑷H2SO4+Ba(OH)2=BaSO4↓+2H2O⒉意义:⑸2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O⑹CaCO3+2HCl=CaCl2+CO2↑+H2O⑺CO2+2NaOH=Na2CO3+H2O⑻Fe+CuSO4=FeSO4+Cu⑼Zn+H2SO4=ZnSO4+H2↑⑽NH4Cl+NaOH = NaCl+NH3↑+H2O⑾NaCl+AgNO3 = AgCl↓+NaNO3⒁Na2SO4+BaCl2 = BaSO4↓+2NaCl⒂2NaCl+2H2O = 2NaOH+H2↑+Cl2↑通电⒃MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O⒄Cl2+2NaBr=2NaCl+Br2⒅Cl2+2KI=2KCl+I2⒆Br2+2KI=2KBr+I2⑿KBr+AgNO3 = AgBr↓+KNO3⒀Nal+AgNO3 = Agl↓+NaNO3⒇Cl2+H2O=HCl+HClO(21)Cl2+2NaOH=NaCl+NaClO+H2O(22)3S+6NaOH(热/浓)=2Na2S+Na2SO3+3H2O(26)CO2+NaOH=NaHCO3+H2O(27)Na2CO3+CO2+H2O=2NaHCO3(24)Na2CO3+2HCl=2NaCl+CO2↑+H2O(25) NaHCO3+HCl=NaCl+CO2↑+H2O(28)NaHCO3+NaOH=Na2CO3+H2O(29)CO2+Ca(OH)2=CaCO3↓+H2O(30)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(23)2Na+2H2O=2NaOH+H2↑●无色/透明溶液中,能大量共存的离子是( )
A.Na+/SO42-/Ca2+/Cl-
B.Cu2+/H+/NO3-/Cl-
C.K+/CO32-/Na+/SO42-
D.Na+/CO32-/H+/Cl-●在pH=1的溶液中,能大量共存的离子是( )
A.Na+/HCO3-/Ca2+/Cl-
B.Na+/Ba2+/NO3-/OH-
C.K+/Cl-/Na+/SO42-
D.Na+/CO32-/NO3-/Cl-CC四、离子共存问题(思路与方法)2、注意题干中的关键词:1、实质: 根据复分解反应条件,判断离子之间是否能够发生反应.离子间只要能够结合生成沉淀或者气体或者水的,就不能够大量共存.(1)溶液的颜色: 有“无色溶液”字样,则MnO4-、Fe2+、Fe3+、Cu2+等有色离子就不能够存在。(2)溶液的酸碱性:A、以“强酸性”、“强碱性”字样表示;
B、pH值:1、2;13、14;
C、指示剂颜色的变化。
金属单质 强酸
单质 强电解质 强碱
非金属单质 绝大多数盐
纯净物 电解质 弱酸
弱电解质 弱碱
物质 化合物 水
非电解质
酸、碱、盐
混合物判断下列物质中谁是强电解质
HCl、醋酸、NaOH、Cu(OH)2、H3PO4
NaCl、AgCl、NH3·H2O、蔗糖、CO2即 时 巩 固二、离子反应:⑶删去---途径⑴书写---基础⑵改写---关键⑷检查---保证钾/钠/铵/硝均易溶,氯化物去银和汞; 硫酸盐去钡和铅,碳/磷酸盐多不溶; 看完盐类看碱类,只溶钾/钠/钡.三、离子方程式:⒈书写步骤:A-原子守恒
B-电荷守恒⑴HCl+NaOH=NaCl+H2O⑵H2SO4+2KOH=K2SO4+2H2O⑶CH3COOH+NaOH=CH3COONa+H2O⑷H2SO4+Ba(OH)2=BaSO4↓+2H2O⒉意义:⑸2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O⑹CaCO3+2HCl=CaCl2+CO2↑+H2O⑺CO2+2NaOH=Na2CO3+H2O⑻Fe+CuSO4=FeSO4+Cu⑼Zn+H2SO4=ZnSO4+H2↑⑽NH4Cl+NaOH = NaCl+NH3↑+H2O⑾NaCl+AgNO3 = AgCl↓+NaNO3⒁Na2SO4+BaCl2 = BaSO4↓+2NaCl⒂2NaCl+2H2O = 2NaOH+H2↑+Cl2↑通电⒃MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O⒄Cl2+2NaBr=2NaCl+Br2⒅Cl2+2KI=2KCl+I2⒆Br2+2KI=2KBr+I2⑿KBr+AgNO3 = AgBr↓+KNO3⒀Nal+AgNO3 = Agl↓+NaNO3⒇Cl2+H2O=HCl+HClO(21)Cl2+2NaOH=NaCl+NaClO+H2O(22)3S+6NaOH(热/浓)=2Na2S+Na2SO3+3H2O(26)CO2+NaOH=NaHCO3+H2O(27)Na2CO3+CO2+H2O=2NaHCO3(24)Na2CO3+2HCl=2NaCl+CO2↑+H2O(25) NaHCO3+HCl=NaCl+CO2↑+H2O(28)NaHCO3+NaOH=Na2CO3+H2O(29)CO2+Ca(OH)2=CaCO3↓+H2O(30)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(23)2Na+2H2O=2NaOH+H2↑●无色/透明溶液中,能大量共存的离子是( )
A.Na+/SO42-/Ca2+/Cl-
B.Cu2+/H+/NO3-/Cl-
C.K+/CO32-/Na+/SO42-
D.Na+/CO32-/H+/Cl-●在pH=1的溶液中,能大量共存的离子是( )
A.Na+/HCO3-/Ca2+/Cl-
B.Na+/Ba2+/NO3-/OH-
C.K+/Cl-/Na+/SO42-
D.Na+/CO32-/NO3-/Cl-CC四、离子共存问题(思路与方法)2、注意题干中的关键词:1、实质: 根据复分解反应条件,判断离子之间是否能够发生反应.离子间只要能够结合生成沉淀或者气体或者水的,就不能够大量共存.(1)溶液的颜色: 有“无色溶液”字样,则MnO4-、Fe2+、Fe3+、Cu2+等有色离子就不能够存在。(2)溶液的酸碱性:A、以“强酸性”、“强碱性”字样表示;
B、pH值:1、2;13、14;
C、指示剂颜色的变化。
