钠的性质[上学期]
图片预览





文档简介
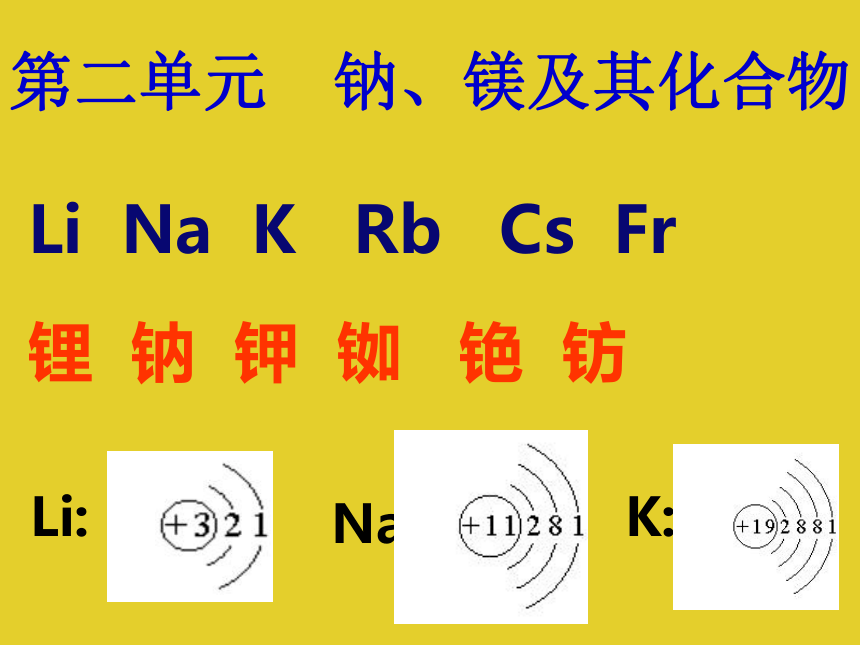
课件14张PPT。第二单元 钠、镁及其化合物 锂 钠 钾 铷 铯 钫Li:Na:K: Li Na K Rb Cs Fr钠离子的形成:
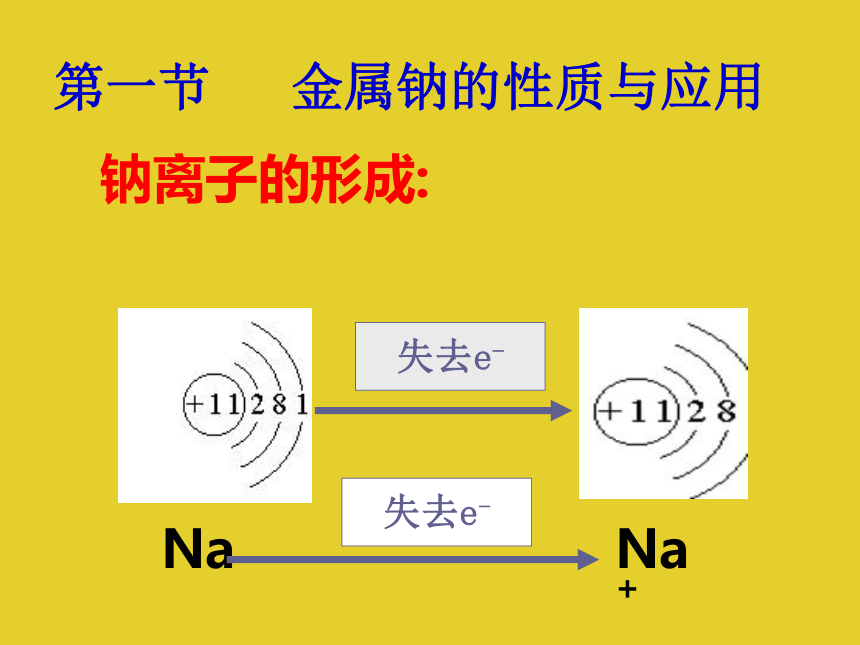
第一节 金属钠的性质与应用NaNa+失去e-失去e-一 钠的物理性质银白色,有金属光泽的固体
质软
密度比水小
熔、沸点低
是热和电的良导体
二 钠的化学性质1、与非金属反应:
常温:点燃:4Na + O2 ==2Na2O淡黄色白色2、与水的反应方 程:2Na + 2H2O == 2NaOH + H2↑离子方程式:2Na + 2H2O ==2Na+ + 2OH- +H2↑现象:
浮:密度比水小
熔:熔点低;此反应为放热反应。
游: 反应很剧烈
响: 有气体生成
红:有碱生成推测:
钠能否与盐酸反应生成氢气?
若能,请分析反应的剧烈程度;
若不能,请说明理由。
解疑:
能;反应程度远大于与水的反应。
想一想?做一做!1、钠着火时,应如何灭火?2、取用钠块时,能否用手直接去拿?
为什么?解疑:应用沙子,而不能用水。解疑:不能;手上的水会与钠反应生成强碱氢氧化钠,对手腐蚀性很强。3、与盐的反应强调:1、钠的还原性很强,但不能从溶液将不活泼的金属置换出来,钠先与水反应,而不直接置换金属。
2、金属活动性顺序表中前三种金属都不能将不活泼金属从溶液中置换出来。钠与CuSO4溶液反应:2Na + 2H2O == 2NaOH + H2↑2NaOH+CuSO4==Cu(OH)2↓+Na2SO4三 钠在自然界里的存在和主要用途制备:
电解熔融的氯化钠可制得单质钠
用途:
①原子反应堆的导热剂(K-Na合金)
②钛、钽、铌、锆等金属冶炼
③高压钠灯
存在:化合态课堂小结:钠存在用途性质制法练习:4、在下列叙述中,错误的是:( )
A.钠燃烧时发出黄色火焰 B.钠在空气中燃烧生成氧化钠
C.钠与硫化合时可以发生爆炸 D.钠是强还原剂1、钠在自然界里不能以( )态存在,只能以( )态存在,这是因为( ).游离化合钠的还原性强B2、由于钠很容易与空气中的( )、( )等物质发生反应,通常将那保存在( )里,以使钠与( )、( )等隔绝。H20O2煤油H20O23、钠可以把钛、锆等金属从它们的卤化物中还原出来,这是由于钠具有( )性。还原5、4.6克钠与足量的水反应,计算生成的气体在标准状况下(标准状况下氢气的密度为0.0899克每升)6、 2.3g金属钠溶于97.7g水中所得溶液的溶质质量分数是 ( )
2.3% B.4% C. 略小于4% D.略大于4%D 解疑:设生成的氢气为xg
2Na + 2H2O == 2NaOH + H2↑
46g 2g
4.6g x x=0.2gVH2=0.2g/0.0899g/L
=2.2L
答:可生成氢气在标准状况下的体积为2.2L作业:
<导与练>P60演练广场THANK YOUBye-bye
第一节 金属钠的性质与应用NaNa+失去e-失去e-一 钠的物理性质银白色,有金属光泽的固体
质软
密度比水小
熔、沸点低
是热和电的良导体
二 钠的化学性质1、与非金属反应:
常温:点燃:4Na + O2 ==2Na2O淡黄色白色2、与水的反应方 程:2Na + 2H2O == 2NaOH + H2↑离子方程式:2Na + 2H2O ==2Na+ + 2OH- +H2↑现象:
浮:密度比水小
熔:熔点低;此反应为放热反应。
游: 反应很剧烈
响: 有气体生成
红:有碱生成推测:
钠能否与盐酸反应生成氢气?
若能,请分析反应的剧烈程度;
若不能,请说明理由。
解疑:
能;反应程度远大于与水的反应。
想一想?做一做!1、钠着火时,应如何灭火?2、取用钠块时,能否用手直接去拿?
为什么?解疑:应用沙子,而不能用水。解疑:不能;手上的水会与钠反应生成强碱氢氧化钠,对手腐蚀性很强。3、与盐的反应强调:1、钠的还原性很强,但不能从溶液将不活泼的金属置换出来,钠先与水反应,而不直接置换金属。
2、金属活动性顺序表中前三种金属都不能将不活泼金属从溶液中置换出来。钠与CuSO4溶液反应:2Na + 2H2O == 2NaOH + H2↑2NaOH+CuSO4==Cu(OH)2↓+Na2SO4三 钠在自然界里的存在和主要用途制备:
电解熔融的氯化钠可制得单质钠
用途:
①原子反应堆的导热剂(K-Na合金)
②钛、钽、铌、锆等金属冶炼
③高压钠灯
存在:化合态课堂小结:钠存在用途性质制法练习:4、在下列叙述中,错误的是:( )
A.钠燃烧时发出黄色火焰 B.钠在空气中燃烧生成氧化钠
C.钠与硫化合时可以发生爆炸 D.钠是强还原剂1、钠在自然界里不能以( )态存在,只能以( )态存在,这是因为( ).游离化合钠的还原性强B2、由于钠很容易与空气中的( )、( )等物质发生反应,通常将那保存在( )里,以使钠与( )、( )等隔绝。H20O2煤油H20O23、钠可以把钛、锆等金属从它们的卤化物中还原出来,这是由于钠具有( )性。还原5、4.6克钠与足量的水反应,计算生成的气体在标准状况下(标准状况下氢气的密度为0.0899克每升)6、 2.3g金属钠溶于97.7g水中所得溶液的溶质质量分数是 ( )
2.3% B.4% C. 略小于4% D.略大于4%D 解疑:设生成的氢气为xg
2Na + 2H2O == 2NaOH + H2↑
46g 2g
4.6g x x=0.2gVH2=0.2g/0.0899g/L
=2.2L
答:可生成氢气在标准状况下的体积为2.2L作业:
<导与练>P60演练广场THANK YOUBye-bye
