选修模块《物质结构与性质》专题2《原子结构与元素的性质》内容分析及使用建议[下学期]
文档属性
| 名称 | 选修模块《物质结构与性质》专题2《原子结构与元素的性质》内容分析及使用建议[下学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-09-27 19:47:00 | ||
图片预览







文档简介
课件42张PPT。选修模块《物质结构与性质》
专题2《原子结构与元素的性质》内容分析及使用建议江苏省苏州实验中学
高一化学备课组
2006.5“物质结构与性质”模块设置的意义通过本课程模块的学习,学生应主要在以下几个方面得到发展:
1.?? 从科学家探索物质构成奥秘的史实中体会科学探究的过程和方法,增强学习化学的兴趣;
2.? 进一步形成有关物质结构的基本观念,初步认识物质的结构与性质之间的关系;
3.? 能从物质结构决定性质的视角解释一些化学现象,预测物质的有关性质;
4.在理论分析和实验探究过程中学习辩证唯物主义的方法论,逐步形成科学的价值观。
《普通高中化学课程标准》3. 物质结构与性质选修模块内容简介主题1 原子结构与元素的性质地位和作用原子结构理论的建立,为研究分子的结构,认识化学键的本质,掌握物质化学性质变化的规律提供了重要的理论基础。本主题主要选择了原子核外电子的运动状态,原子结构的构造原理,原子核外的能级分布,元素的电离能,电负性原子核外电子的跃迁等内容,旨在让学生理解原子结构的微观本质,进而理解元素的性质表现。内容标准了解原子核外电子的运动状态。了解s、p轨道的形状。
了解原子结构的构造原理,知道原子核外电子的能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子的排布。
能说出元素电离能、电负性的涵义,能应用元素的第一电离能和电负性说明元素的某些性质。
知道原子核外电子在一定条件下会发生跃迁,了解电子跃迁的简单应用。?
认识原子结构揭示了元素周期律的本质。
力求简单易懂,通过有关物理知识和物理实验背景的知识,以能够用来使学生形成共价键和分子结构的基础为限度。
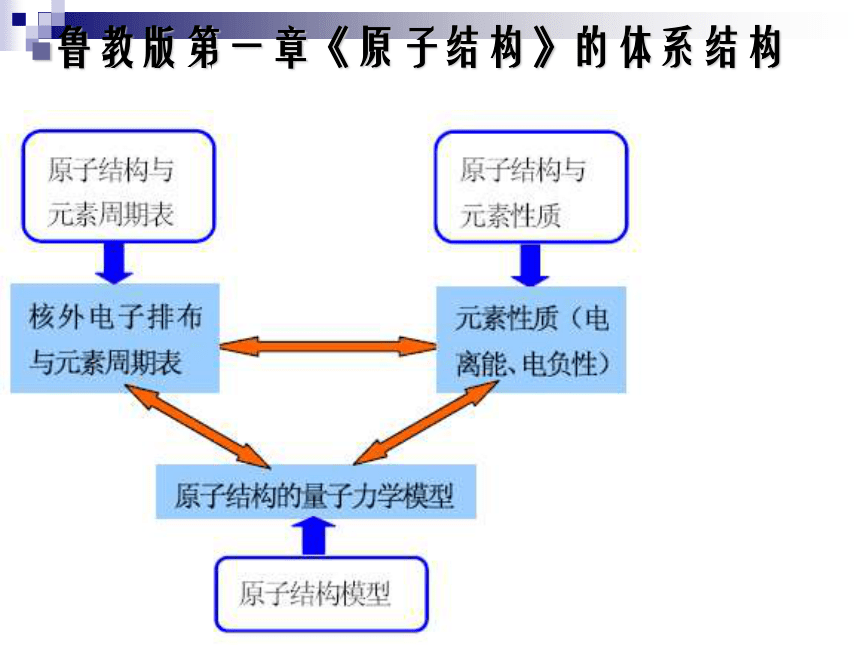
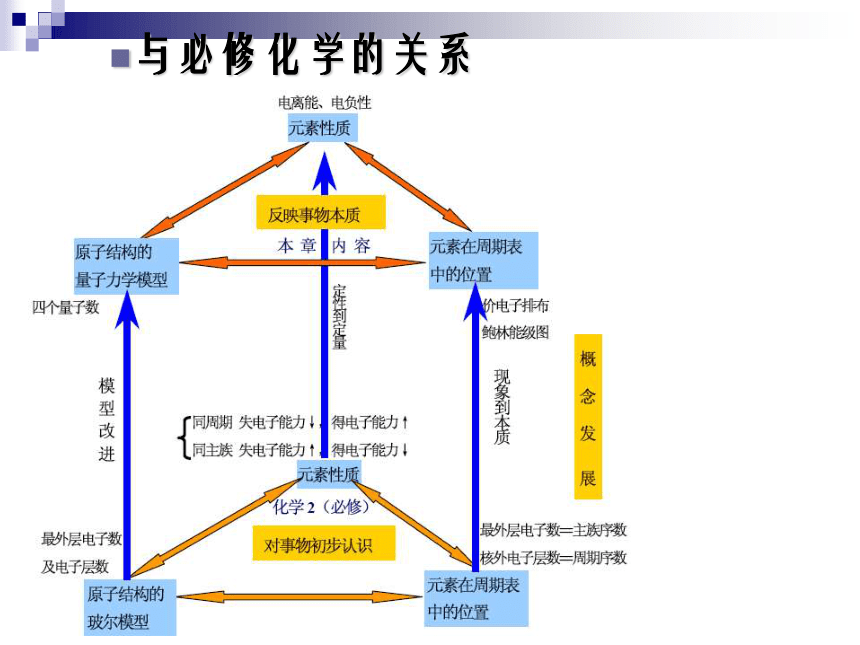
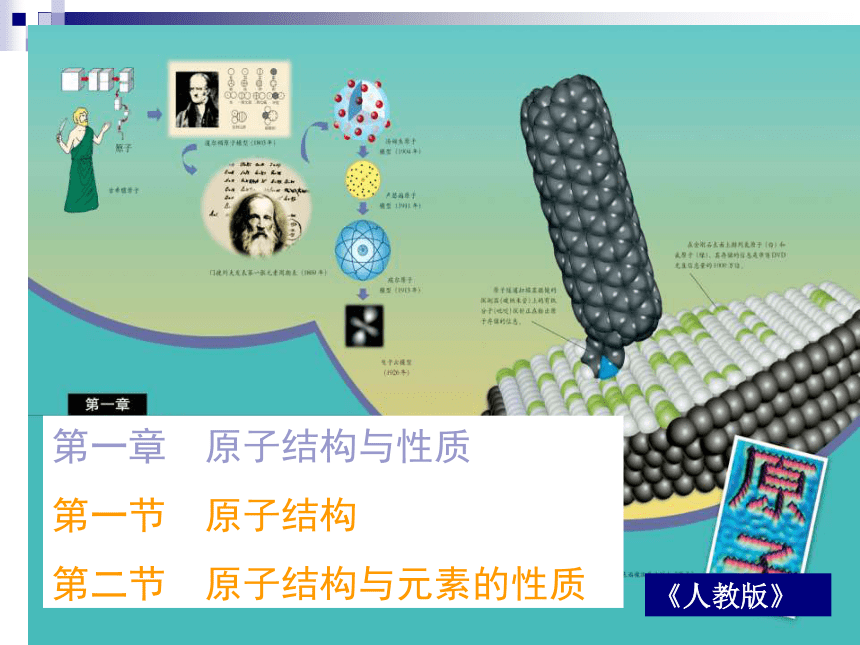
教学原则《鲁教版》三种版本教材的比较鲁教版第一章《原子结构》的体系结构与必修化学的关系第一章 原子结构与性质
第一节 原子结构
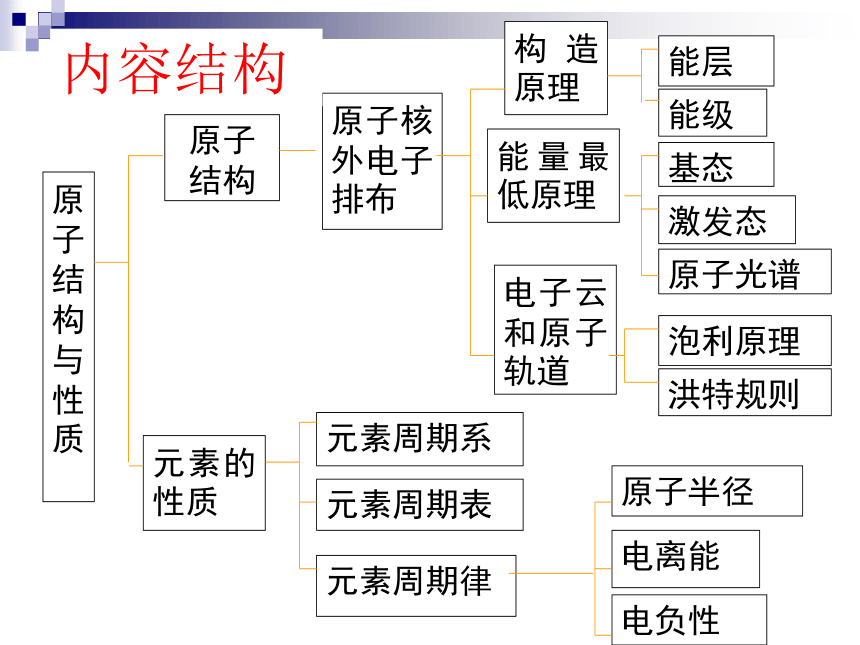
第二节 原子结构与元素的性质《人教版》内容结构第一节 原子结构能层和能级构造原理
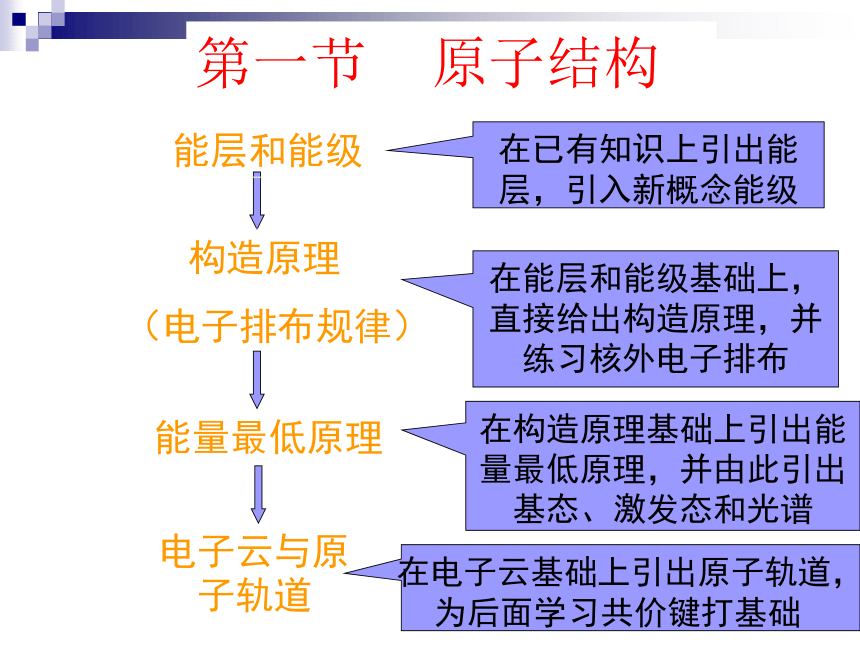
(电子排布规律)能量最低原理电子云与原子轨道在已有知识上引出能层,引入新概念能级在能层和能级基础上,直接给出构造原理,并练习核外电子排布在构造原理基础上引出能量最低原理,并由此引出基态、激发态和光谱在电子云基础上引出原子轨道,为后面学习共价键打基础(课标主题1第1、2、4条)
1、了解原子核外电子的运动状态。
2、了解原子结构的构造原理,知道原子核外电子的能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子的排布。
4、知道原子核外电子在一定条件下会发生跃迁,了解其简单应用。 本节内容选材依据电子云与原子轨道基态、激发态、光谱能层与能级,构造原理,电子排布式原子结构与元素周期表元素周期律第二节 原子结构与元素的性质电子排布式,元素周期系, “科学探究”元素周期表,认识拓展提升图表、“学与问”或“科学探究”原子半径、电离能、电负性化合价、金属与非金属性“学与问”复习(课标主题1第3条和主题4第3条)
3、能说出元素电离能、电负性的涵义,能应用元素的电离能说明元素的某些性质。
3、认识原子结构与元素周期系的关系,了解周期系的应用价值。 本节内容选材依据元素周期律原子结构与元素周期表《苏教版》
编写思路原子结构元素性质学生已有经验结构决定性质主动建构知识强化知识应用原子行星模型 玻尔模型 统计模型
电子分层排布 原子轨道 电子排布原子核外电子排布 化合价、原子半径、金属性和非金属性、电离能、电负性课时参考第一单元 原子核外电子的运动
人类对原子结构的认识历史 1课时
原子核外电子的运动特征 1课时
原子核外电子的排布 1课时第二单元 元素性质的递变规律
原子核外电子排布的周期性 1课时
元素第一电离能的周期性变化 1课时
元素电负性的周期性变化 1课时
专题回顾和总结 1课时教学建议根据课程标准,注重基本要求。原子轨道:s 、p轨道,对d 轨道不要作过多要求, 只要求知道nd有5个d轨道。
原子核外电子排布:24Cr 3d54s1 29Cu 3d104s1
46Pd 4d10
电离能:了解第一电离能的变化规律。
电负性:了解电负性的基本应用。对电负性的概念 不作过多的要求。重视物质结构决定其性质的思想应用,强化元素周期律教学。充分应用学生已有知识,注意与化学必修内容的接轨。核外电子分层排布 核外电子排布式
元素性质的周期性 电离能、电负性的周期性
活动与探究建议讨论:元素周期表中各区、周期、族元素的原子核外电子排步的规律。
参观、观看影像或资料:原子吸收和发射光谱分析。
讨论:主族元素电离能的变化与核外电子排步的关系。?
查阅有关元素的电负性资料,解释元素的“对角线”规则,列举实例予以说明。 道尔顿 汤姆生 卢瑟福 玻尔人类认识原子结构的历史原子核外电子的运动氢原子光谱的谱线 玻尔把化学、放射性和光谱学方面的实验事实与卢瑟福的原子结构模型相结合,在研究氢原子光谱产生的原因中发展了原子结构理论。1913年,玻尔提出了新的原子结构模型,其要点如下: (1) 原子核外电子在具有确定能量的轨道上运动,当原子不受外界影响时,电子既不吸收也不放出能量。 (2) 不同的原子轨道具有不同的能量,轨道能量的变化是不连续的,即量子化的。
(3) 当电子吸收了能量(如光能、热能等),就会从从能量较低的轨道跃迁到能量较高的轨道上。处于能量较高轨道的电子不稳定,会回到能量较低的轨道上,当电子从能量较高的(E2)轨道跃迁到能量较低的(E。)轨道时发射出光子,发出光的波长取决于两个轨道的能量差。玻尔提出的原子结构模型,揭示了光谱线与原子结构的内在联系。由于这一开拓性的贡献,玻尔获得了1922年诺贝尔物理学奖。
玻尔的原子结构模型理论也不是十分完美,在解释氢以外的多电子原子的光谱线时,就只能做出近似的估计,无法定量计算。科学家们经过13年的艰苦修改、验证、论证,终于在1925年~1926年,在玻尔原子结构模型的基础上发展成为原子的量子力学模型,其核心是薛定谔波动方程。该模型已经受了半个多世纪的考验。 电 子 层构造原理原子核外电子排步的轨道能量顺序 表示电子的两种不同的自旋状态根据展示的第二周期元素原子的核外电子排布的轨道表示式,由学生交流讨论核外电子排布的一些规律。科学探究原子核外电子的排布所遵循的原理:1、能量最低原理
电子先占据能量低的轨道,再依次进入能量高的轨道2、泡利不相容原理
每个轨道最多容纳两个自旋状态不同的电子3、洪特规则
在能量相同的轨道上排布时,电子尽可能分占不同的轨
道,且自旋状态相同交流与讨论:在Ar原子核外电子排步的基础上,结合元素周期表,对第四周期元素某些原子的核外电子进行排步,让学生发现第四周期元素原子的电子排布中出现的一些特例,找出可能的原因,分析Cr、Cu原子核外电子的排步,理解洪特规则的特例。等价轨道全充满、半充满或全空的状态是比较稳定的。例如:全充满:p6,d10,f14
半充满: p3,d5,f7
全空: p0,d0,f0
锂、氦、汞的发射与吸收光谱科学探究回顾必修2里有关元素周期表的内容,设计“科学探究”,在复习的基础上从电子排布式角度提高。元素性质的递变规律原子结构与元素性质的关系,从元素周期律认识,讨论其周期性的变化 原子半径
电离能
电负性主族元素原子半径决定因素:
电子层数
核电荷数电离能和电负性:
电离能:简单定义,通过元素的第一电离能周期性图组织学生交流讨论。钠、镁、铝的逐级电离能数据表电负性:利用图、表、数据说明科学探究问题讨论原子轨道玻尔:原子核外电子在一系列稳定轨道 上运动。
量子力学:Ψ= R(r)Θ(θ,φ)
|Ψ|2= R(r)2Θ2(θ,φ)
教材中的界定:量子力学描述电子在核 外运动的主要区域。 能级交错ns (n-2)f (n-1)d np能级交错是多电子体系电子相互作用的结果。
轨道能量的差值与核电荷数的大小有关。
原子核外电子排布是以实验事实为依据的。
电子填充的顺序与原子失去电子的顺序不同。电离能及应用M(g) –e- = M+(g) △H=I1 电离能是原子核外电子分层排布的实验验证。
第一电离能的周期性变化是原子核外电子排布周期性变化的必然结果。
元素的第一电离能越小表示它越容易失去电子,即该元素的金属性越强。电负性的应用
1 元素的金属性的判别
一般来说金属元素的电负性在2.0以下,非金属元素的电负性在2.0以上,利用电负性这一概念,结合其它键参数可以判断不同元素的原子(或离子)之间相互结合形成化合键的类型。
2 化学键型判别
电负性相差较大(△x≥1.7)的两种元素的原子结合形成化合物, 通常形成离子键。电负性相差较小(△x<1.7)的两种元素的原子结合形成化合物, 通常形成共价键,且电负性不相等的元素原子间一般形成极性共价健。电负性及其应用
专题2《原子结构与元素的性质》内容分析及使用建议江苏省苏州实验中学
高一化学备课组
2006.5“物质结构与性质”模块设置的意义通过本课程模块的学习,学生应主要在以下几个方面得到发展:
1.?? 从科学家探索物质构成奥秘的史实中体会科学探究的过程和方法,增强学习化学的兴趣;
2.? 进一步形成有关物质结构的基本观念,初步认识物质的结构与性质之间的关系;
3.? 能从物质结构决定性质的视角解释一些化学现象,预测物质的有关性质;
4.在理论分析和实验探究过程中学习辩证唯物主义的方法论,逐步形成科学的价值观。
《普通高中化学课程标准》3. 物质结构与性质选修模块内容简介主题1 原子结构与元素的性质地位和作用原子结构理论的建立,为研究分子的结构,认识化学键的本质,掌握物质化学性质变化的规律提供了重要的理论基础。本主题主要选择了原子核外电子的运动状态,原子结构的构造原理,原子核外的能级分布,元素的电离能,电负性原子核外电子的跃迁等内容,旨在让学生理解原子结构的微观本质,进而理解元素的性质表现。内容标准了解原子核外电子的运动状态。了解s、p轨道的形状。
了解原子结构的构造原理,知道原子核外电子的能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子的排布。
能说出元素电离能、电负性的涵义,能应用元素的第一电离能和电负性说明元素的某些性质。
知道原子核外电子在一定条件下会发生跃迁,了解电子跃迁的简单应用。?
认识原子结构揭示了元素周期律的本质。
力求简单易懂,通过有关物理知识和物理实验背景的知识,以能够用来使学生形成共价键和分子结构的基础为限度。
教学原则《鲁教版》三种版本教材的比较鲁教版第一章《原子结构》的体系结构与必修化学的关系第一章 原子结构与性质
第一节 原子结构
第二节 原子结构与元素的性质《人教版》内容结构第一节 原子结构能层和能级构造原理
(电子排布规律)能量最低原理电子云与原子轨道在已有知识上引出能层,引入新概念能级在能层和能级基础上,直接给出构造原理,并练习核外电子排布在构造原理基础上引出能量最低原理,并由此引出基态、激发态和光谱在电子云基础上引出原子轨道,为后面学习共价键打基础(课标主题1第1、2、4条)
1、了解原子核外电子的运动状态。
2、了解原子结构的构造原理,知道原子核外电子的能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子的排布。
4、知道原子核外电子在一定条件下会发生跃迁,了解其简单应用。 本节内容选材依据电子云与原子轨道基态、激发态、光谱能层与能级,构造原理,电子排布式原子结构与元素周期表元素周期律第二节 原子结构与元素的性质电子排布式,元素周期系, “科学探究”元素周期表,认识拓展提升图表、“学与问”或“科学探究”原子半径、电离能、电负性化合价、金属与非金属性“学与问”复习(课标主题1第3条和主题4第3条)
3、能说出元素电离能、电负性的涵义,能应用元素的电离能说明元素的某些性质。
3、认识原子结构与元素周期系的关系,了解周期系的应用价值。 本节内容选材依据元素周期律原子结构与元素周期表《苏教版》
编写思路原子结构元素性质学生已有经验结构决定性质主动建构知识强化知识应用原子行星模型 玻尔模型 统计模型
电子分层排布 原子轨道 电子排布原子核外电子排布 化合价、原子半径、金属性和非金属性、电离能、电负性课时参考第一单元 原子核外电子的运动
人类对原子结构的认识历史 1课时
原子核外电子的运动特征 1课时
原子核外电子的排布 1课时第二单元 元素性质的递变规律
原子核外电子排布的周期性 1课时
元素第一电离能的周期性变化 1课时
元素电负性的周期性变化 1课时
专题回顾和总结 1课时教学建议根据课程标准,注重基本要求。原子轨道:s 、p轨道,对d 轨道不要作过多要求, 只要求知道nd有5个d轨道。
原子核外电子排布:24Cr 3d54s1 29Cu 3d104s1
46Pd 4d10
电离能:了解第一电离能的变化规律。
电负性:了解电负性的基本应用。对电负性的概念 不作过多的要求。重视物质结构决定其性质的思想应用,强化元素周期律教学。充分应用学生已有知识,注意与化学必修内容的接轨。核外电子分层排布 核外电子排布式
元素性质的周期性 电离能、电负性的周期性
活动与探究建议讨论:元素周期表中各区、周期、族元素的原子核外电子排步的规律。
参观、观看影像或资料:原子吸收和发射光谱分析。
讨论:主族元素电离能的变化与核外电子排步的关系。?
查阅有关元素的电负性资料,解释元素的“对角线”规则,列举实例予以说明。 道尔顿 汤姆生 卢瑟福 玻尔人类认识原子结构的历史原子核外电子的运动氢原子光谱的谱线 玻尔把化学、放射性和光谱学方面的实验事实与卢瑟福的原子结构模型相结合,在研究氢原子光谱产生的原因中发展了原子结构理论。1913年,玻尔提出了新的原子结构模型,其要点如下: (1) 原子核外电子在具有确定能量的轨道上运动,当原子不受外界影响时,电子既不吸收也不放出能量。 (2) 不同的原子轨道具有不同的能量,轨道能量的变化是不连续的,即量子化的。
(3) 当电子吸收了能量(如光能、热能等),就会从从能量较低的轨道跃迁到能量较高的轨道上。处于能量较高轨道的电子不稳定,会回到能量较低的轨道上,当电子从能量较高的(E2)轨道跃迁到能量较低的(E。)轨道时发射出光子,发出光的波长取决于两个轨道的能量差。玻尔提出的原子结构模型,揭示了光谱线与原子结构的内在联系。由于这一开拓性的贡献,玻尔获得了1922年诺贝尔物理学奖。
玻尔的原子结构模型理论也不是十分完美,在解释氢以外的多电子原子的光谱线时,就只能做出近似的估计,无法定量计算。科学家们经过13年的艰苦修改、验证、论证,终于在1925年~1926年,在玻尔原子结构模型的基础上发展成为原子的量子力学模型,其核心是薛定谔波动方程。该模型已经受了半个多世纪的考验。 电 子 层构造原理原子核外电子排步的轨道能量顺序 表示电子的两种不同的自旋状态根据展示的第二周期元素原子的核外电子排布的轨道表示式,由学生交流讨论核外电子排布的一些规律。科学探究原子核外电子的排布所遵循的原理:1、能量最低原理
电子先占据能量低的轨道,再依次进入能量高的轨道2、泡利不相容原理
每个轨道最多容纳两个自旋状态不同的电子3、洪特规则
在能量相同的轨道上排布时,电子尽可能分占不同的轨
道,且自旋状态相同交流与讨论:在Ar原子核外电子排步的基础上,结合元素周期表,对第四周期元素某些原子的核外电子进行排步,让学生发现第四周期元素原子的电子排布中出现的一些特例,找出可能的原因,分析Cr、Cu原子核外电子的排步,理解洪特规则的特例。等价轨道全充满、半充满或全空的状态是比较稳定的。例如:全充满:p6,d10,f14
半充满: p3,d5,f7
全空: p0,d0,f0
锂、氦、汞的发射与吸收光谱科学探究回顾必修2里有关元素周期表的内容,设计“科学探究”,在复习的基础上从电子排布式角度提高。元素性质的递变规律原子结构与元素性质的关系,从元素周期律认识,讨论其周期性的变化 原子半径
电离能
电负性主族元素原子半径决定因素:
电子层数
核电荷数电离能和电负性:
电离能:简单定义,通过元素的第一电离能周期性图组织学生交流讨论。钠、镁、铝的逐级电离能数据表电负性:利用图、表、数据说明科学探究问题讨论原子轨道玻尔:原子核外电子在一系列稳定轨道 上运动。
量子力学:Ψ= R(r)Θ(θ,φ)
|Ψ|2= R(r)2Θ2(θ,φ)
教材中的界定:量子力学描述电子在核 外运动的主要区域。 能级交错ns (n-2)f (n-1)d np能级交错是多电子体系电子相互作用的结果。
轨道能量的差值与核电荷数的大小有关。
原子核外电子排布是以实验事实为依据的。
电子填充的顺序与原子失去电子的顺序不同。电离能及应用M(g) –e- = M+(g) △H=I1 电离能是原子核外电子分层排布的实验验证。
第一电离能的周期性变化是原子核外电子排布周期性变化的必然结果。
元素的第一电离能越小表示它越容易失去电子,即该元素的金属性越强。电负性的应用
1 元素的金属性的判别
一般来说金属元素的电负性在2.0以下,非金属元素的电负性在2.0以上,利用电负性这一概念,结合其它键参数可以判断不同元素的原子(或离子)之间相互结合形成化合键的类型。
2 化学键型判别
电负性相差较大(△x≥1.7)的两种元素的原子结合形成化合物, 通常形成离子键。电负性相差较小(△x<1.7)的两种元素的原子结合形成化合物, 通常形成共价键,且电负性不相等的元素原子间一般形成极性共价健。电负性及其应用
