原子结构模型的演变[上学期]
图片预览




文档简介
课件17张PPT。第三单元
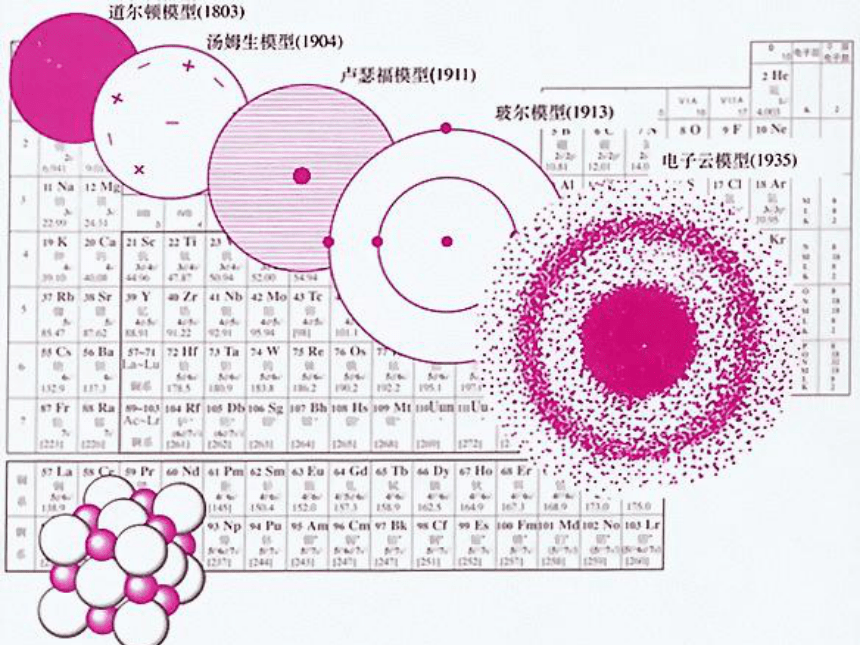
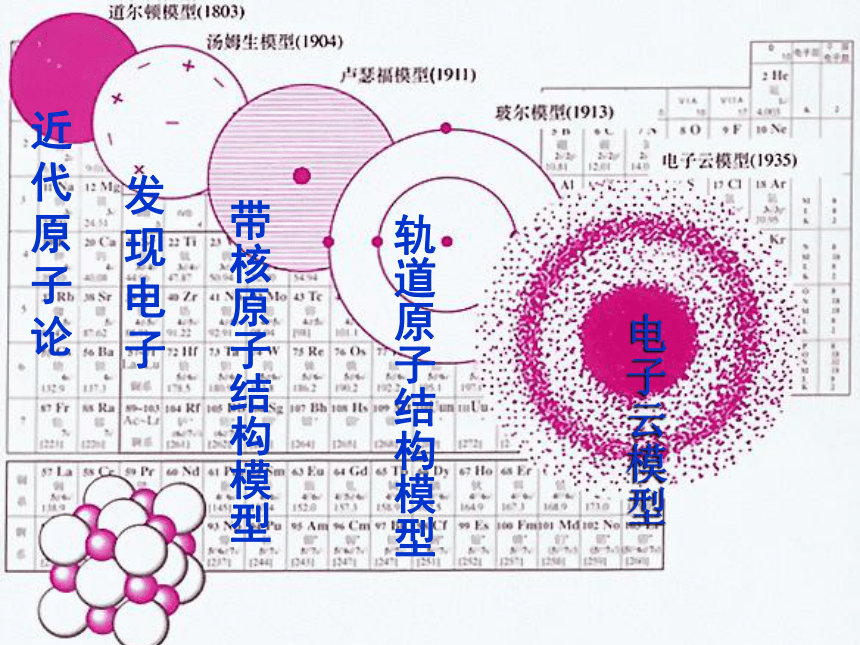
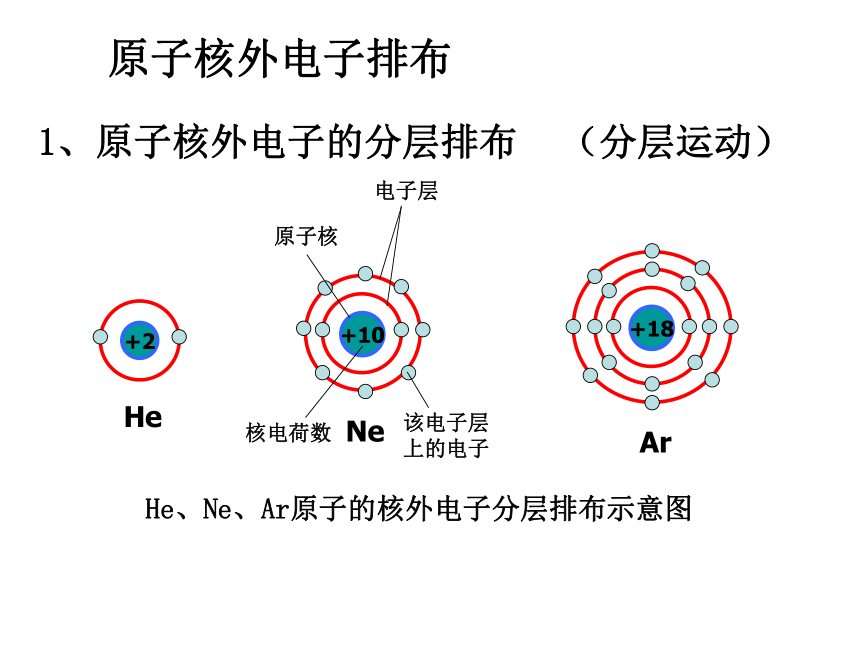
人类对原子结构的认识原子结构模型的演变阅读课本P26~27,填写以下内容 19世纪初,英国科学家111111提出了原子学说;1897年,111111发现了原子中存在电子;1911年,英国物理学家111111提出了带核的原子结构模型,其中原子由11111和111111组成,原子核带111111,位于111111电子带111111,在原子核周围空间作111111;1913年,丹麦物理学家111111引入量子论观点,提出原子核外,电子在一系列稳定的111111运动。现代科学家根据微观世界的波粒二象性规律,提出必须用 的方法来描述核外电子运动。 道尔顿汤姆生卢瑟福原子核核外电子正电荷原子中心负电荷高速运动玻尔轨道上电子量子力学近代原子论发现电子带核原子结构模型轨道原子结构模型电子云模型原子核外电子排布 1、原子核外电子的分层排布原子核电子层核电荷数该电子层上的电子He、Ne、Ar原子的核外电子分层排布示意图(分层运动)K L M N O P Q 电子能量高在离核远的区域内运动,电子能量低在离核近的区域内运动?,把原子核外分成七个运动区域,又叫电子层,分别用n=1、2、3、4、5、6、7…表示,分别称为K、L、M、N、O、P、Q…,n值越大,说明电子离核越远,能量也就越高。2、原子核外电子运动区域与电子能量的关系: 3、原子核外电子排布规律③? 最外层最多只能容纳 8个电子(K层为最外层是2个);? 次外层最多只能容纳18个电子 倒数第三层最多只能容纳32个电子; ② 每个电子层最多只能容纳2n2电子。①能量最低原理:电子总是尽先排布在能量最低的电子层里; 即由能量 低 高经验:电子排满K层,排 层,
排满 L 层排 层LMH、O、Mg原子的核外电子分层排布示意图 为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。15第1层第2层第3层K层L层M层285原子结构示意图+4、原子结构与元素性质的关系(结构决定性质) (1)稳定结构:即最外层为8电子的结构
(K层为2个)
特点:原子既不容易失去电子又不容易得到电子(如He、Ne、Ar等)(2)不稳定结构:(如,失去: Na、Mg、Al 得到:F、O、Cl)最外层电子数﹤4时,容易失去电子最外层电子数≧4时,容易得到电子问题:为什么Ne气单质不活泼?答:因为Ne元素原子最外层为8电子的稳定结构
(原子结构)问题解决:从原子结构知识角度去解释
P29:问题解决1+12282失去电子+1228MgMg2++826+828得到电子OO2-原子结构示意图离子结构示意图元素化合价与最外层电子数的关系:最外层电子数﹤4时,容易失去电子最外层电子数≧4时,容易得到电子
(化合价=+失去的电子数目)
化合价=-(8-最外层电子数)关系:元素化合价在数值上等于原子失去或得到的电子数目(失为正,得为负)问题解决+11失1+2失2-2得27得11.道尔顿→汤姆生→卢瑟福 →玻尔→量子力学2.原子核外电子排布规律
①能量最低原理
② 每个电子层最多只能容纳2n2电子
③? 最外层最多只能容纳 8个电子(K层为最外层是2个);
次外层最多只能容纳18个电子
倒数第三层最多只能容纳32个电子4.原子结构示意图
离子结构示意图3.原子结构与元素性质的关系(结构决定性质)小结:本节课的重点知识⒈原子核外电子是 排布的
⒉金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阳离子(稳定结构)。
⒊非金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阴离子(稳定结构)。
⒋化学反应中,原子核不发生变化,但原子的 发生变化,元素的化学性质主要决定于原子结构中的 。练习:分层<4≧4得到失去最外层电子数目
人类对原子结构的认识原子结构模型的演变阅读课本P26~27,填写以下内容 19世纪初,英国科学家111111提出了原子学说;1897年,111111发现了原子中存在电子;1911年,英国物理学家111111提出了带核的原子结构模型,其中原子由11111和111111组成,原子核带111111,位于111111电子带111111,在原子核周围空间作111111;1913年,丹麦物理学家111111引入量子论观点,提出原子核外,电子在一系列稳定的111111运动。现代科学家根据微观世界的波粒二象性规律,提出必须用 的方法来描述核外电子运动。 道尔顿汤姆生卢瑟福原子核核外电子正电荷原子中心负电荷高速运动玻尔轨道上电子量子力学近代原子论发现电子带核原子结构模型轨道原子结构模型电子云模型原子核外电子排布 1、原子核外电子的分层排布原子核电子层核电荷数该电子层上的电子He、Ne、Ar原子的核外电子分层排布示意图(分层运动)K L M N O P Q 电子能量高在离核远的区域内运动,电子能量低在离核近的区域内运动?,把原子核外分成七个运动区域,又叫电子层,分别用n=1、2、3、4、5、6、7…表示,分别称为K、L、M、N、O、P、Q…,n值越大,说明电子离核越远,能量也就越高。2、原子核外电子运动区域与电子能量的关系: 3、原子核外电子排布规律③? 最外层最多只能容纳 8个电子(K层为最外层是2个);? 次外层最多只能容纳18个电子 倒数第三层最多只能容纳32个电子; ② 每个电子层最多只能容纳2n2电子。①能量最低原理:电子总是尽先排布在能量最低的电子层里; 即由能量 低 高经验:电子排满K层,排 层,
排满 L 层排 层LMH、O、Mg原子的核外电子分层排布示意图 为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。15第1层第2层第3层K层L层M层285原子结构示意图+4、原子结构与元素性质的关系(结构决定性质) (1)稳定结构:即最外层为8电子的结构
(K层为2个)
特点:原子既不容易失去电子又不容易得到电子(如He、Ne、Ar等)(2)不稳定结构:(如,失去: Na、Mg、Al 得到:F、O、Cl)最外层电子数﹤4时,容易失去电子最外层电子数≧4时,容易得到电子问题:为什么Ne气单质不活泼?答:因为Ne元素原子最外层为8电子的稳定结构
(原子结构)问题解决:从原子结构知识角度去解释
P29:问题解决1+12282失去电子+1228MgMg2++826+828得到电子OO2-原子结构示意图离子结构示意图元素化合价与最外层电子数的关系:最外层电子数﹤4时,容易失去电子最外层电子数≧4时,容易得到电子
(化合价=+失去的电子数目)
化合价=-(8-最外层电子数)关系:元素化合价在数值上等于原子失去或得到的电子数目(失为正,得为负)问题解决+11失1+2失2-2得27得11.道尔顿→汤姆生→卢瑟福 →玻尔→量子力学2.原子核外电子排布规律
①能量最低原理
② 每个电子层最多只能容纳2n2电子
③? 最外层最多只能容纳 8个电子(K层为最外层是2个);
次外层最多只能容纳18个电子
倒数第三层最多只能容纳32个电子4.原子结构示意图
离子结构示意图3.原子结构与元素性质的关系(结构决定性质)小结:本节课的重点知识⒈原子核外电子是 排布的
⒉金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阳离子(稳定结构)。
⒊非金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阴离子(稳定结构)。
⒋化学反应中,原子核不发生变化,但原子的 发生变化,元素的化学性质主要决定于原子结构中的 。练习:分层<4≧4得到失去最外层电子数目
