原子结构模型的演变[上学期]
图片预览


文档简介
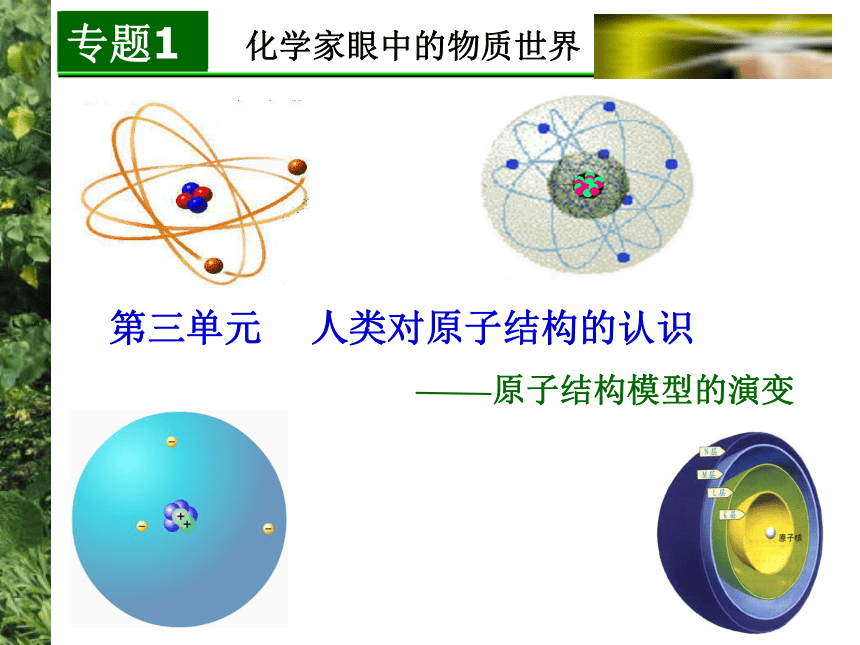
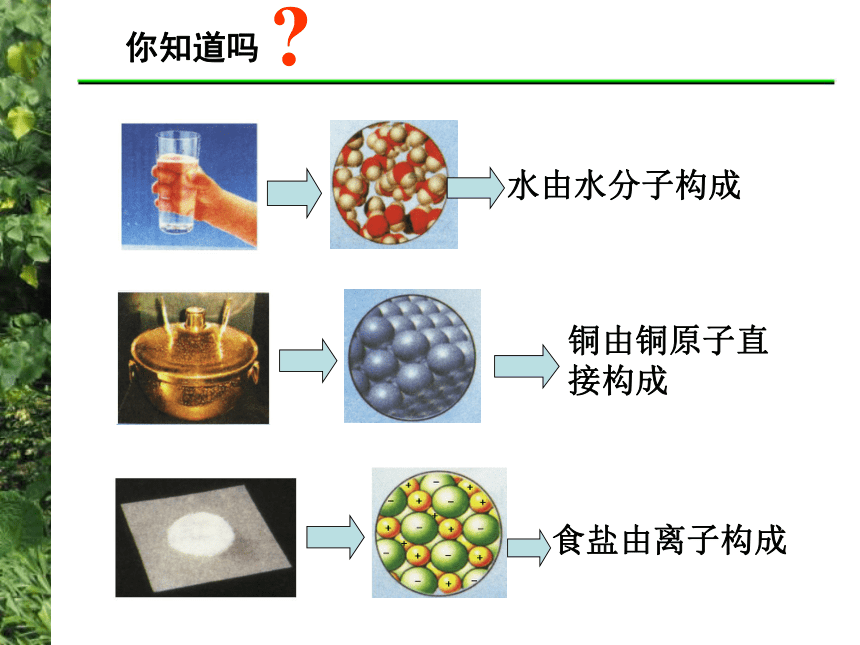
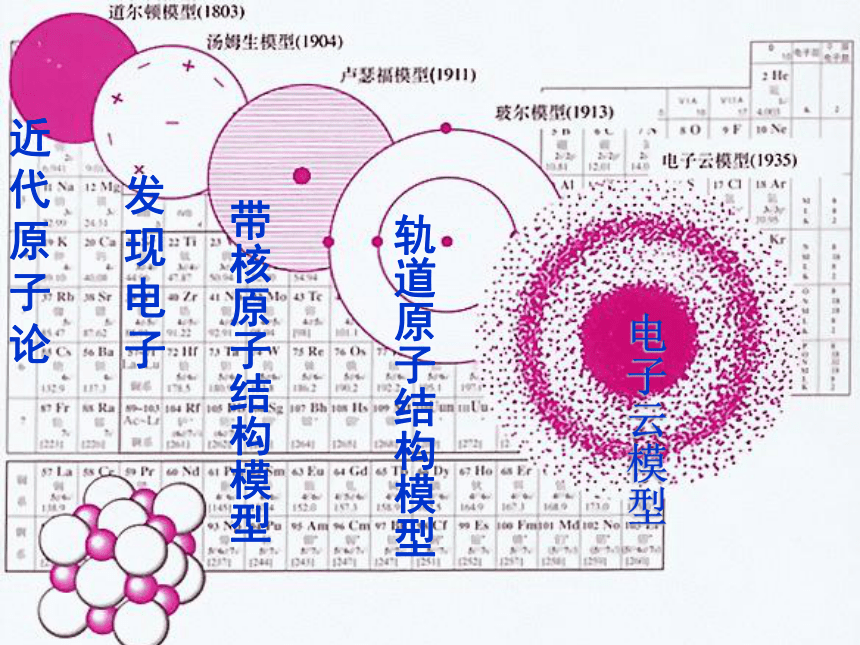
课件24张PPT。化学家眼中的物质世界第三单元 人类对原子结构的认识在你眼中…? 在化学家眼中…? 你知道吗?阅读教材P26-27的短文,回答下列问题1、人类对原子的认识经历哪些重要阶段?
2、道尔顿、汤姆生、卢瑟福、波尔的原子结构
模型的特点?
3、科学家和古希腊哲学家在认识原子方法上有
什么区别吗?
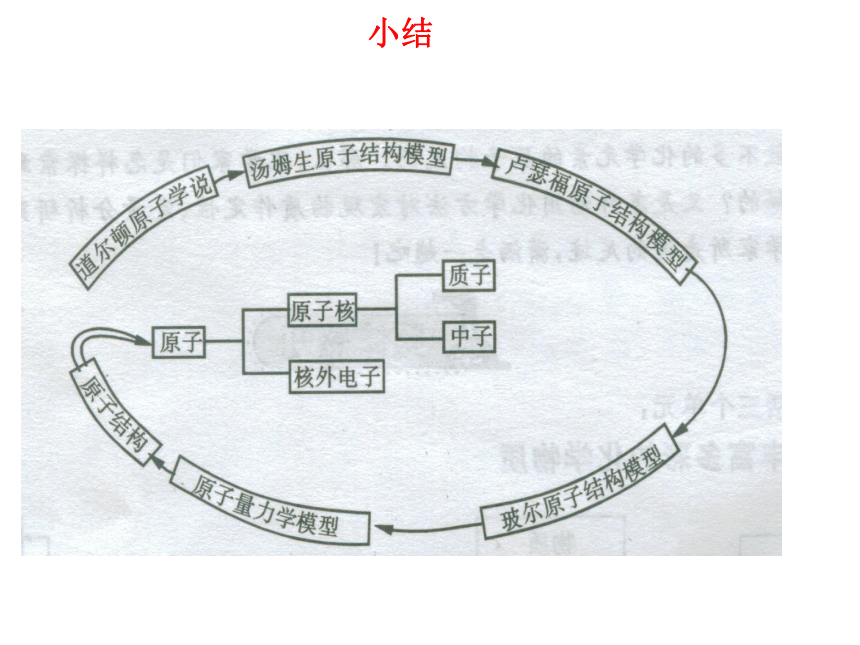
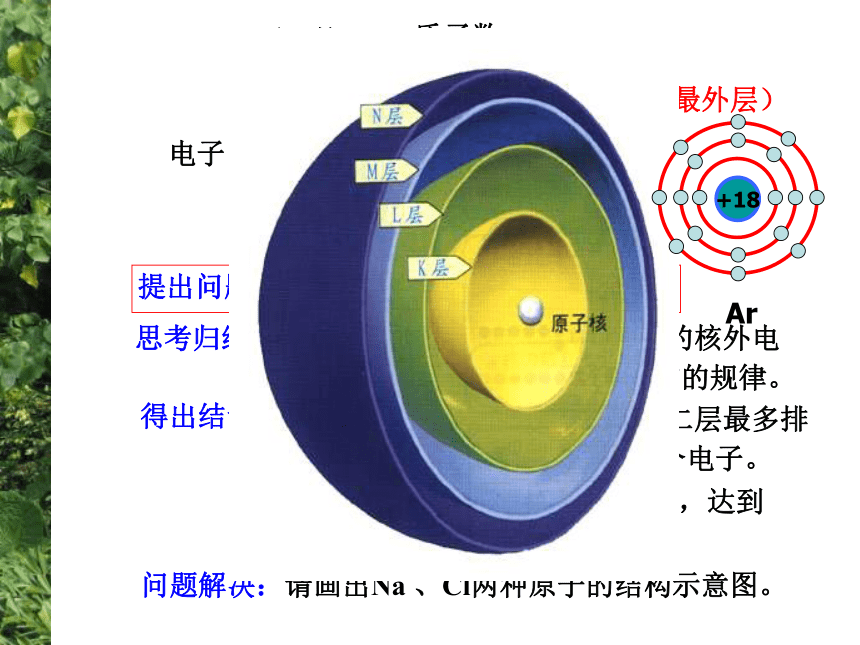
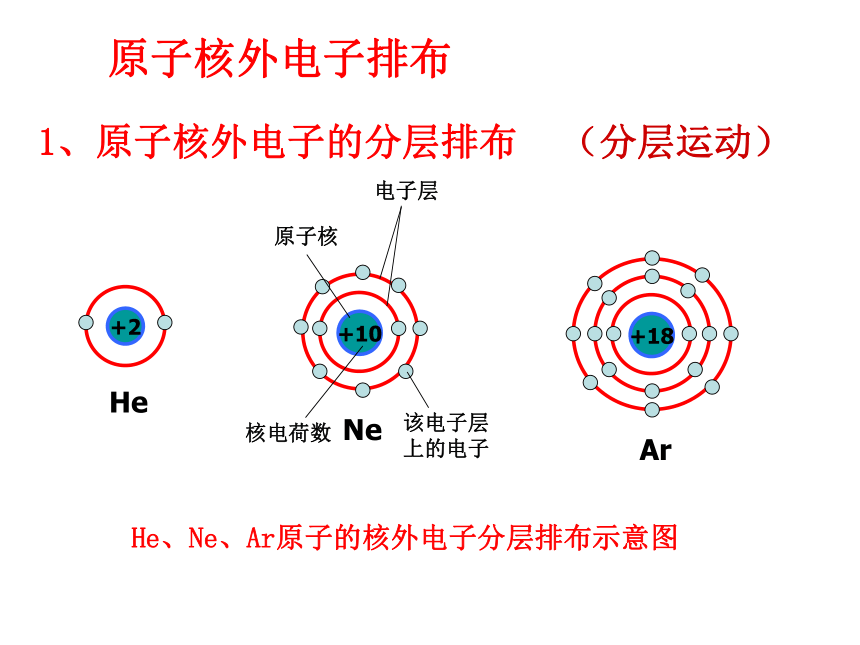
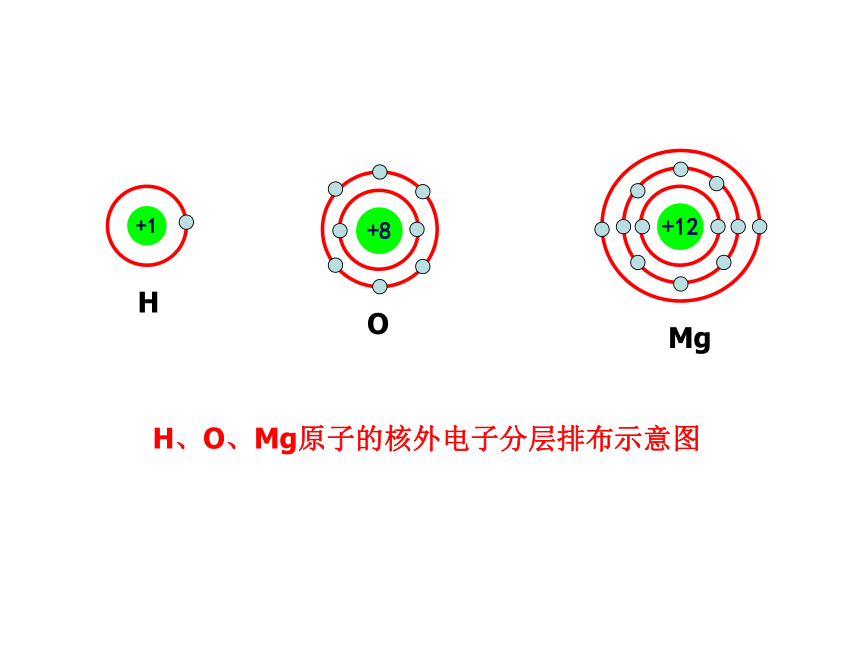
4、请你谈谈从原子结构的演变得到什么启迪?原子结构模型的演变电子云1电子云2散射实验演示近代原子论发现电子带核原子结构模型轨道原子结构模型电子云模型小结思考归纳:观察教材P28页图1-30几种原子的核外电
子排布,归纳核外电子分层排布的规律。得出结论:1、第一层最多排2个电子,第二层最多排
8个电子,最外层最多排8个电子。2、稀有气体最外层是2个或8个,达到
稳定结构。(最外层)问题解决:请画出Na 、Cl两种原子的结构示意图。原子核外电子排布 1、原子核外电子的分层排布原子核电子层核电荷数该电子层上的电子He、Ne、Ar原子的核外电子分层排布示意图(分层运动)H、O、Mg原子的核外电子分层排布示意图核外电子分层排布电子按能量高低在核外分层排布。3、原子核外电子排布规律③最外层最多只能容纳 8个电子(K层为最外层是2个);? 次外层最多只能容纳18个电子 倒数第三层最多只能容纳32个电子; ② 每个电子层最多只能容纳2n2电子。①能量最低原理:电子总是尽先排布在能量最低的电子层里; 即由能量 低 高经验:电子排满K层,排 层,排满L层排 层LM注意:多条规律必须同时兼顾。 为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。+15第1层第2层第3层K层L层M层285原子结构示意图各层电子的数目 原子符号核电荷数电子层+12282失去电子+1228MgMg2++826+828得到电子OO2-交流与讨论:分析氧化镁的形成过程,你能得出什么结论?(从原子结构的变化去分析)得出结论:1、活泼金属与活泼非金属反应时,活泼金
属容易失去电子,而活泼非金属容易得到电子;使最外
层达到“稳定结构”。2、在化学反应过程中,原子核不发生变化,原子的最外
层电子数会发生变化。提出问题:产物中元素的化合价与得失电子的数目有什么
关系?结论1、活泼金属元素易失电子变为带正电荷的阳离子MgMg2+失 2e-(带2个单位正电荷)2、活泼非金属元素易得电子变为带负电荷的阴离子OO2-得 2e-
(带2个单位负电荷)MgO+12Mg2+O2-结论: 原子最外层的电子数小于8个时,在化学反应中总是得到或失去电子而达到最外层8电子的稳定结构。4、原子结构与元素性质的关系(结构决定性质)(1)稳定结构:即最外层为8电子的结构(K层为2个)
特点:原子既不容易失去电子又不容易得到电子(如他、Ne、Ar等)(2)不稳定结构:(如,失去: Na、Mg、Al 得到:F、O、Cl)最外层电子数﹤4时,容易失去电子最外层电子数≧4时,容易得到电子⒈金属单质Na、Mg能分别与非金属单质O2、Cl2反应生成氧化物和氯化物,请写出这些氧化物和氯化物的化学式。
⒉根据Na、Mg、O、Cl原子在反应中失去或得到电子的数目和该原子的最外层电子数目,推断其氧化物和氯化物中元素的化合价,将结果填入下表: 一些元素的原子得失电子的情况
Na2O、MgO、NaCl、MgCl2问题解决①金属最外层电子数﹤4时,易失去电子(化合价=+失去的电子数目)②非金属最外层电子数≥4时,易得到电子(化合价=最外层电子数-8)关系:元素化合价在数值上等于原子失去或得到的电子数目(失为正,得为负)2、原子核外电子排布规律随堂检测:1、19世纪末,人们开始揭示原子内部的秘密,最早发现
电子的科学家是( )
A、法国的拉瓦锡 B、瑞典的舍勒
C、英国的道尔顿 D、英国的汤姆生D2、下列四位科学家都对原子结构的认识起到过重要的
推动作用,其中首先提出原子核外的电子在一定轨道上
运动的是( )
A.汤姆生 B.道尔顿 C.玻尔 D.卢瑟福C
4、用下面的结构示意图的字母填空:
(1)属于金属原子的是_______________;
(2)属于非金属原子的是_____________;
(3)属于离子结构示意图的是_________;
(4)具有稳定结构的是_______________。随堂检测:ABCC3、已知最外层电子数相等的元素原子具有相似化学性质。下列原子中,与氧元素原子的化学性质相似的是( )
A. Ne B. Mg C. S D. CC
2、道尔顿、汤姆生、卢瑟福、波尔的原子结构
模型的特点?
3、科学家和古希腊哲学家在认识原子方法上有
什么区别吗?
4、请你谈谈从原子结构的演变得到什么启迪?原子结构模型的演变电子云1电子云2散射实验演示近代原子论发现电子带核原子结构模型轨道原子结构模型电子云模型小结思考归纳:观察教材P28页图1-30几种原子的核外电
子排布,归纳核外电子分层排布的规律。得出结论:1、第一层最多排2个电子,第二层最多排
8个电子,最外层最多排8个电子。2、稀有气体最外层是2个或8个,达到
稳定结构。(最外层)问题解决:请画出Na 、Cl两种原子的结构示意图。原子核外电子排布 1、原子核外电子的分层排布原子核电子层核电荷数该电子层上的电子He、Ne、Ar原子的核外电子分层排布示意图(分层运动)H、O、Mg原子的核外电子分层排布示意图核外电子分层排布电子按能量高低在核外分层排布。3、原子核外电子排布规律③最外层最多只能容纳 8个电子(K层为最外层是2个);? 次外层最多只能容纳18个电子 倒数第三层最多只能容纳32个电子; ② 每个电子层最多只能容纳2n2电子。①能量最低原理:电子总是尽先排布在能量最低的电子层里; 即由能量 低 高经验:电子排满K层,排 层,排满L层排 层LM注意:多条规律必须同时兼顾。 为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。+15第1层第2层第3层K层L层M层285原子结构示意图各层电子的数目 原子符号核电荷数电子层+12282失去电子+1228MgMg2++826+828得到电子OO2-交流与讨论:分析氧化镁的形成过程,你能得出什么结论?(从原子结构的变化去分析)得出结论:1、活泼金属与活泼非金属反应时,活泼金
属容易失去电子,而活泼非金属容易得到电子;使最外
层达到“稳定结构”。2、在化学反应过程中,原子核不发生变化,原子的最外
层电子数会发生变化。提出问题:产物中元素的化合价与得失电子的数目有什么
关系?结论1、活泼金属元素易失电子变为带正电荷的阳离子MgMg2+失 2e-(带2个单位正电荷)2、活泼非金属元素易得电子变为带负电荷的阴离子OO2-得 2e-
(带2个单位负电荷)MgO+12Mg2+O2-结论: 原子最外层的电子数小于8个时,在化学反应中总是得到或失去电子而达到最外层8电子的稳定结构。4、原子结构与元素性质的关系(结构决定性质)(1)稳定结构:即最外层为8电子的结构(K层为2个)
特点:原子既不容易失去电子又不容易得到电子(如他、Ne、Ar等)(2)不稳定结构:(如,失去: Na、Mg、Al 得到:F、O、Cl)最外层电子数﹤4时,容易失去电子最外层电子数≧4时,容易得到电子⒈金属单质Na、Mg能分别与非金属单质O2、Cl2反应生成氧化物和氯化物,请写出这些氧化物和氯化物的化学式。
⒉根据Na、Mg、O、Cl原子在反应中失去或得到电子的数目和该原子的最外层电子数目,推断其氧化物和氯化物中元素的化合价,将结果填入下表: 一些元素的原子得失电子的情况
Na2O、MgO、NaCl、MgCl2问题解决①金属最外层电子数﹤4时,易失去电子(化合价=+失去的电子数目)②非金属最外层电子数≥4时,易得到电子(化合价=最外层电子数-8)关系:元素化合价在数值上等于原子失去或得到的电子数目(失为正,得为负)2、原子核外电子排布规律随堂检测:1、19世纪末,人们开始揭示原子内部的秘密,最早发现
电子的科学家是( )
A、法国的拉瓦锡 B、瑞典的舍勒
C、英国的道尔顿 D、英国的汤姆生D2、下列四位科学家都对原子结构的认识起到过重要的
推动作用,其中首先提出原子核外的电子在一定轨道上
运动的是( )
A.汤姆生 B.道尔顿 C.玻尔 D.卢瑟福C
4、用下面的结构示意图的字母填空:
(1)属于金属原子的是_______________;
(2)属于非金属原子的是_____________;
(3)属于离子结构示意图的是_________;
(4)具有稳定结构的是_______________。随堂检测:ABCC3、已知最外层电子数相等的元素原子具有相似化学性质。下列原子中,与氧元素原子的化学性质相似的是( )
A. Ne B. Mg C. S D. CC
