必修1-专题1-原子结构模型的演变 -苏教版[上学期]
文档属性
| 名称 | 必修1-专题1-原子结构模型的演变 -苏教版[上学期] | 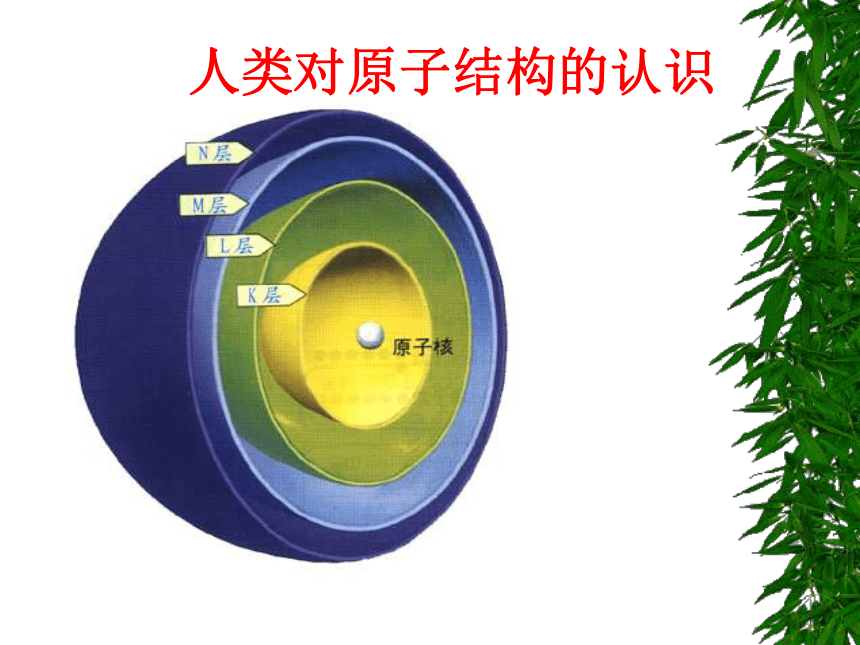 | |
| 格式 | rar | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-09-14 20:26:00 | ||
图片预览











文档简介
(共46张PPT)
人类对原子结构的认识
课程标准要求
1.通过从道尔顿原子结构模型到量子力学原子结构模型等原子结构模型演变的学习,了解科学家探索原子结构的艰难过程。
2.通过汤姆生原子结构模型、卢瑟福原子结构模型等的学习,体验科学实验、科学思维对创造性工作的重要作用。
3.了解钠、镁、氧等常见元素原子的核外电子分层排布的情况,化学反应中电子得失使最外层达到8电子稳定结构的事实。揭示化学反应的本质。
4.了解原子是由原子核和核外电子构成,绝大多数原子的原子核是由质子和中子构成。能根据原子组成符号判断原子的构成。知道同位素等概念。
两千多万种化学物质大多数由原子构成,而人类对原子的认识和探索已经历了2500多年.直到20世纪80年代,科学家才用扫描隧道显微镜观察到物体表面的原子.可你有没有思考过下列问题?
⑴原子到底是什么“东西”?
⑵科学家眼里的原子是怎样的?
⑶科学家是怎样探索原子结构的?有哪些科学家为探索原子结构作出了重大的贡献?
历史
公元前5世纪,希腊哲学家德谟克利特等人认为 :万物是由大量的不可分割的微粒构成的,即原子。
一、原子结构模型的演变
1.所有物质都是由非常微小的,不可再分的实心球体即原子组成的;
2.同种物质的原子其质量、大小和形状都相同,不同元素的原子不同,主要表现为质量的不同;
3.原子不能被分割;
4.原子是元素参加化学变化的最小单位,在化学反应中,原子仅仅是重新排列,而不会被创造或消失。
(一)道尔顿的原子学说-------提出原子论
1803年,英国化学家道尔顿阐述了他的化学原子论。主要观点有:
(二)几种原子结构模型 。
1.汤姆生的原子结构模型--------发现电子(带负电荷)
1897年,汤姆生证明假设原子带正电的部分像“流体”一样均匀分布在球形的原子内,而负电子则嵌在球体的某些固定位置。汤母生认为,正电荷均匀地分布在原子之中,而电子就像是葡萄干面包中的葡萄干一样散布在原子的正电荷之中,这就是原子结构的第一个模型——葡萄干面包式模型。
2.卢瑟福的原子结构模型-------发现原子核结构
1911年,英国物理学家卢瑟福做了一系列实验:当用一束平行的a粒子轰击金箔时,发现绝大多数a粒子穿过金箔不改变行进方向,只有极少数的a粒子产生偏转,其中个别的甚至反方向折回。大量实验发现绝大部分a粒子穿过金箔时不改变行进方向、第8000~10000个a粒子中才有一个大角度散射或反方向折回。根据a粒子散射实验,卢瑟福提出含核原子结构模型。他的主要观点是:
(1)每一个原子都有一个体积极小、极密实的核;
(2)原子核占有全部正电荷和几乎全部的原子质量;
(3)原子核被一个体积很大几乎什么也没有的空间包围着;
(4)原子核外的空间里极稀疏地散布着电子,其总电荷数恰好与原子核中的正电荷相等。
3.玻尔的原子结构模型------发现核外电子的能量
玻尔把化学、放射性和光谱学方面的实验事实与原子结构模型联系在一起,在研究氢原子光谱产生的原因中发展了原子结构理论。1913年,玻尔提出了新的原子结构模型,其要点如下:
(1)在原子中,电了不能沿着任意轨道绕核旋转,而只能沿着符合一定条件的轨道旋转。电子在轨道上运动时,不吸收或放出能量,处于一种稳定状态。
(2)原子中的电子在不同轨道运动时可具有不同的能量,电子运动时所处的能量状态称为能级。电子在轨道上运动时所具有的能量只能取某些不连续的数值(电子能量是量子化的)。
(3)只有当电子从某一轨道跃迁到另一轨道时,才有能量的吸收或放出。当电子从能量较高的(E2)轨道跃迁到能量较低的(E。)轨道时,原子就放出能量。放出的能量转变为一个辐射能的光子,其频率可由两个轨道的能量差决定。玻尔提出的原子结构模型,揭示了光谱线与原子结构的内在联系。由于这一开拓性的贡献,玻尔获得了1922年诺贝尔物理学奖。
4.原子的量子力学模型---------核外电子的运动和电子排布规律
玻尔的原子结构模型理论也不是十分完美,在解释氢以外的多电子原子的光谱线时,就只能做出近似的估计,无法定量计算。科学家们经过13年的艰苦修改、验证、论证,终于在1925年~1926年,在玻尔原子结构模型的基础上发展成为原子的量子力学模型,其核心是薛定锷波动方程。该模型已经受了半个多世纪的考验。
原子的量子力学模型包括了玻尔所采用的量子化能级的概念,即主量子数(主层)。此外还提出其他量子数以说明电子的能量,如亚层和轨道数。由于电子属于微观粒子,具有波粒二象性,它在核外的运动速度可以与光速相比,很难同时准确地测定它的速度和位置,只能用统计的方法来描述,因而引入了“电子云”的概念。
小结
原子结构模型的演变历史给我们的启迪
①化学认识发展的形式与科学认识发展的形式一样是继承、积累突破和革命。
②实验方法是科学研究的一种重要方法,实验手段的不断进步是化学发展的一个关键。
③科学研究、科学发现是无止境的。
核外电子分层排布
电子按能量高低在核外分层排布。
1 2 3 4 5 6 7
K L M N O P Q
由内到外,能量逐渐升高
核外电子排布的一般规律:
1、K层为最外层时,最多容纳电子数------------。
2、其他各层为最外层最多容纳电子数------------。
3、次外层最多容纳电子数--------------------------。
4、倒数第三层最多容纳电子数-------------------。
5、第n层最多容纳电子数-------------------------。
2个
8个
18个
32个
2n2个
注意:多条规律必须同时兼顾。
各层电子的数目
原子符号
核电荷数
电子层
4、离子结构示意图
辨析原子结构示意图和离子结构示意图
注意:任何原子都有趋于8电子(或2电子)稳定结构的倾向,因此活泼的原子会发生电子得失
5、离子化合物的形成
共价化合物的形成
原子
核电荷数=核内质子数=核外电子数=原子序数
阳离子:质子数=核外电子数+电荷数
阴离子:质子数=核外电子数-电荷数
核电荷数=核内质子数=原子序数≠核外电子数
离子
你知道的微粒有哪些?
原子:化学变化中的最小微粒。
什么是原子
原子核:原子的组成部分,位于原子的中心,由质子和中子构成,带正电的小微粒,所占的体积忽略不计.几乎集中了原子的所有质量。
原子核
二、原子的结构
1、原子的构成
2.理解几个概念
1、粒子的相对质量
原子的质量数:将原子核内所有质子和中子的相对质量,取整数加起来所得的数值叫质量数
质量数=质子数+中子数
电子
电子:原子的组成部分,位于原子核外围,带负电的小微粒,带一单位负电荷,是质子质量的1/1836,在原子中质量可以不计,电子云占有了原子几乎所有的体积。
质子
质子:原子核的组成部分,带正电的小微粒,一个质子带一个单位的正电荷,相对质量是1.007。
电子云:
电子围绕原子核作高速运动,就向云雾笼罩在原子核周围,我们形象称之为电子云。
相对质量:
是电子、质子、中子的质量与12C原子质量的1/12(1.661×10-27 kg)相比较所得的数值。
3. 质子、中子、电子的电性和电量怎样?
1个质子带一个单位正电荷
1个电子带一个单位负电荷
中子不显电性
中子
中子: 原子核的组成部分,不带电的小微粒,相对质量是1.008。
离子
离子:带电的原子或原子团。
分子
分子:保持物质化学性质的一种微粒。
质量数:
原子核内所有质子和中子的相对质量取整数加起来,所得数值称为质量数(A)。
用X表示元素, Z表示数质子,N表示中子数则原子的表达式为:
质量数(A)= 质子数(Z)+ 中子数(N)
核电荷数=核内质子数=核外电子数。(原子状态)
2、原子的表达方式
ZX
A
来表示一个质量数为A、质子数为Z的具体的X原子。
比如: 6 12 C表示质量数为12,原子核内有6个质子和6个中子的碳原子。
注意:
a、元素符号(X)
左上角写上质量数
左下角写上质子数
原子符号 X
b、
原子质量(m)
12C (m) 1/12
= 相对原子质量 = 摩尔质量 (g/mol) ≈质量数
c、原子与对应离子比较,电子数不等,质子数、中子、质量、相对原子质量、质量数仍相等。
Cl
17
35
-
a
b
+
d
X
c
a——代表质量数;
b——代表核电荷数;
c——代表离子的价态;
d——代表化合价
e ——代表原子个数
e
a、b、c、d、e各代表什么?
1. 氧原子的质量数为16,质子数为8,那么它的中子数是多少?( 8 )
2. 钠原子的质量数为23,中子数为12,那么它的质子数是多少?核外电子数是多少?
( 11,11 )
3. 硫的二价阴离子的核外电子数是18,中子数为17,那么它的质量数是多少?( 33 )
解:因为 S2- 的核外电子数是18,即硫原子得
到 2 个电子后,是18,那么硫原子的核外电子数是16,则16+17=33。
质子:决定元素的种类,与中子共
同决定原子的相对原子质量
中子:决定原子的种类,与质子共
同决定原子的相对原子质量
电子:最外层电子数决定元素的
化学性质
微粒数计算 ①
电子总数 质子总数 中子总数
D216O 1×2+8 10 (2-1)×2 +(16-8)
23Na35Cl 11+17 28 (23-11)+(35—17)
OH— 8+1+1 9 (16-8) +(1—1)
NH4+ 7+1×4-1 11 (14—7)+(1—1)×4
微粒数计算 ②
A、2g重水中多少个中子?
D2O ~ 中子
20g 10×6.02×1023个
2g x 个
B、R2-含x 个电子,质量数A ,mgR2-中多少个中子?
R2- ~ 中子
Ag [A—(X—2)] ×6.02×1023个
mg x 个
3、核素和同位素
⑵同位素定义:质子数相同而中子数不同的同一元素的不同原子互称为同位素。注意:Z同:表示同一元素N不同:质量数A不同,原子也不同
注意:Z同:同一元素 ;N不同:A不同,原子也不同
原子的种类是由质子数和中子数共同决定的。同 位素是原子的互称,是单质的互称。
⑴核素定义:具有一定质子数和一定中子数的原子
同种核素特征:质子数相同,中子数也相同.
氢元素:同一种核素 11H 11H+ 11H-
不同种核素 11H 12H 13H
⑶特性:(1)化学性质几乎完全相同。 1735 Cl、17 37 Cl
(2)原子个数百分比(即丰度)基本不变。
17 35 Cl 75.77% ; 17 37 Cl 24.23%
(3)物理性质不同:N不同, A不同, M不同,
m不同, d不同。
⑷元素、核素和同位素的关系
在天然元素中,多数元素含有多种核素,少数元素只含有一种核素(例如Na、K等)。某种元素跟核素和同位素的关系:
同位素
核素
核素
某种元素
⑸用途:(1) C :612C、613C、614C
614C每隔5568年它的质量就会减少一半,考古学家根据生物体内614C的含量,就可判断其生活的年代.
(2) 11H N=0 氕
12H(D) N=1 氘(重氢)
13H(T) N=2 氚(超重氢)
制氢弹
O:816O 8 17O 8 18O
H2O 水 18; D2O 重水 20; T2O 超重水 22
(3)U: 92234U 92235 U 92238U
铀-235 制原子弹
2760CO是恶性肿瘤的“克星”,也可用其辐射育种,刺激增长,保鲜,防腐.
练习
1、元素是质子数相同的( )的统称。
A.原子 B.微粒 C.原子及其对应的离子
2、11H 2、D2、T2、816O 2 、1H217O、D218O2 有
种原子, 种分子, 种元素,
; 属同位素。
3、1735Cl和1737Cl组成Cl,为什么Cl的原子量
≠(35+37)/ 2 ?
C
6
6
2
11H 、D、T
816O、 817O、818O
因为Cl原子的丰度不等
【4】1803年,英国科学家道尔顿提出了近代原子学说,他认为一切物质是由原子构成的,这些原子是微小的不可分割的实心球。1911年,英国科学家卢瑟福用一束平行高速运动的a粒子(a粒子是带两个单位正电荷的氦原子核)轰击金箔时(金原子的核电荷数为79,相对原子质量为197),发现大多数a粒子能穿透金箔,而且不改变原来的运动方向,但是也有一小部分a粒子改变了原来的运动路径,甚至有极少数的a粒子好像碰到了坚硬不可穿透的质点而被弹了回来①有一小部分a粒子改变了原来的运动路径。原因是a粒子途经金原子核附近时,受到斥力而稍微改变了运动方向。②大多数a粒子不改变原来的运动方向。原因是 。
③极少数a粒子被弹了回来。原因是 。
④按现在对原子、分子的认识,你认为道尔顿提出的近代原子学说中不确切的地方,请用“ ”划出,并在下方加以改正。
⑤金原子的核外电子数为 ,中子数为 。
金原子核被一个体积很大的几乎什么也没有的空间包围着a粒子穿越这个空间
a粒子撞击了金原子核而弹回(仪粒子撞击了带正电荷、质量大、体积很小的金原子核而被弹回)
一切 不可分割 实心球
一些 可分割 电子在原子核外的空间内做高速运动
79
118
例:硼有10B和11B两种同位素组成,硼元素的原子量 为10.8,求10B和11B在自然界中各自的百分比。
解:设10B所占百分比为x:
10 × x + 11 × (1-x) = 10.8
x = 0.2
∴10B占20%,11B占80%。
5、下列说法不正确的是( )
①、质子数相同的粒子一定属于同种元素
②、同位素的化学性质几乎完全相同
③、质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子
④、电子数相同的粒子不一定是同一种元素
⑤、一种元素只能有一种质量数
A、①②④⑤B、③④⑤C、②③⑤ D、①⑤
6、在微粒RO3n-中,共有X个核外电子,R原子的质量数为A,求R原子核内所含的中子数?若现有m克微粒RO3n-中,质子数为?R原子核内所含的中子数为?
人类对原子结构的认识
课程标准要求
1.通过从道尔顿原子结构模型到量子力学原子结构模型等原子结构模型演变的学习,了解科学家探索原子结构的艰难过程。
2.通过汤姆生原子结构模型、卢瑟福原子结构模型等的学习,体验科学实验、科学思维对创造性工作的重要作用。
3.了解钠、镁、氧等常见元素原子的核外电子分层排布的情况,化学反应中电子得失使最外层达到8电子稳定结构的事实。揭示化学反应的本质。
4.了解原子是由原子核和核外电子构成,绝大多数原子的原子核是由质子和中子构成。能根据原子组成符号判断原子的构成。知道同位素等概念。
两千多万种化学物质大多数由原子构成,而人类对原子的认识和探索已经历了2500多年.直到20世纪80年代,科学家才用扫描隧道显微镜观察到物体表面的原子.可你有没有思考过下列问题?
⑴原子到底是什么“东西”?
⑵科学家眼里的原子是怎样的?
⑶科学家是怎样探索原子结构的?有哪些科学家为探索原子结构作出了重大的贡献?
历史
公元前5世纪,希腊哲学家德谟克利特等人认为 :万物是由大量的不可分割的微粒构成的,即原子。
一、原子结构模型的演变
1.所有物质都是由非常微小的,不可再分的实心球体即原子组成的;
2.同种物质的原子其质量、大小和形状都相同,不同元素的原子不同,主要表现为质量的不同;
3.原子不能被分割;
4.原子是元素参加化学变化的最小单位,在化学反应中,原子仅仅是重新排列,而不会被创造或消失。
(一)道尔顿的原子学说-------提出原子论
1803年,英国化学家道尔顿阐述了他的化学原子论。主要观点有:
(二)几种原子结构模型 。
1.汤姆生的原子结构模型--------发现电子(带负电荷)
1897年,汤姆生证明假设原子带正电的部分像“流体”一样均匀分布在球形的原子内,而负电子则嵌在球体的某些固定位置。汤母生认为,正电荷均匀地分布在原子之中,而电子就像是葡萄干面包中的葡萄干一样散布在原子的正电荷之中,这就是原子结构的第一个模型——葡萄干面包式模型。
2.卢瑟福的原子结构模型-------发现原子核结构
1911年,英国物理学家卢瑟福做了一系列实验:当用一束平行的a粒子轰击金箔时,发现绝大多数a粒子穿过金箔不改变行进方向,只有极少数的a粒子产生偏转,其中个别的甚至反方向折回。大量实验发现绝大部分a粒子穿过金箔时不改变行进方向、第8000~10000个a粒子中才有一个大角度散射或反方向折回。根据a粒子散射实验,卢瑟福提出含核原子结构模型。他的主要观点是:
(1)每一个原子都有一个体积极小、极密实的核;
(2)原子核占有全部正电荷和几乎全部的原子质量;
(3)原子核被一个体积很大几乎什么也没有的空间包围着;
(4)原子核外的空间里极稀疏地散布着电子,其总电荷数恰好与原子核中的正电荷相等。
3.玻尔的原子结构模型------发现核外电子的能量
玻尔把化学、放射性和光谱学方面的实验事实与原子结构模型联系在一起,在研究氢原子光谱产生的原因中发展了原子结构理论。1913年,玻尔提出了新的原子结构模型,其要点如下:
(1)在原子中,电了不能沿着任意轨道绕核旋转,而只能沿着符合一定条件的轨道旋转。电子在轨道上运动时,不吸收或放出能量,处于一种稳定状态。
(2)原子中的电子在不同轨道运动时可具有不同的能量,电子运动时所处的能量状态称为能级。电子在轨道上运动时所具有的能量只能取某些不连续的数值(电子能量是量子化的)。
(3)只有当电子从某一轨道跃迁到另一轨道时,才有能量的吸收或放出。当电子从能量较高的(E2)轨道跃迁到能量较低的(E。)轨道时,原子就放出能量。放出的能量转变为一个辐射能的光子,其频率可由两个轨道的能量差决定。玻尔提出的原子结构模型,揭示了光谱线与原子结构的内在联系。由于这一开拓性的贡献,玻尔获得了1922年诺贝尔物理学奖。
4.原子的量子力学模型---------核外电子的运动和电子排布规律
玻尔的原子结构模型理论也不是十分完美,在解释氢以外的多电子原子的光谱线时,就只能做出近似的估计,无法定量计算。科学家们经过13年的艰苦修改、验证、论证,终于在1925年~1926年,在玻尔原子结构模型的基础上发展成为原子的量子力学模型,其核心是薛定锷波动方程。该模型已经受了半个多世纪的考验。
原子的量子力学模型包括了玻尔所采用的量子化能级的概念,即主量子数(主层)。此外还提出其他量子数以说明电子的能量,如亚层和轨道数。由于电子属于微观粒子,具有波粒二象性,它在核外的运动速度可以与光速相比,很难同时准确地测定它的速度和位置,只能用统计的方法来描述,因而引入了“电子云”的概念。
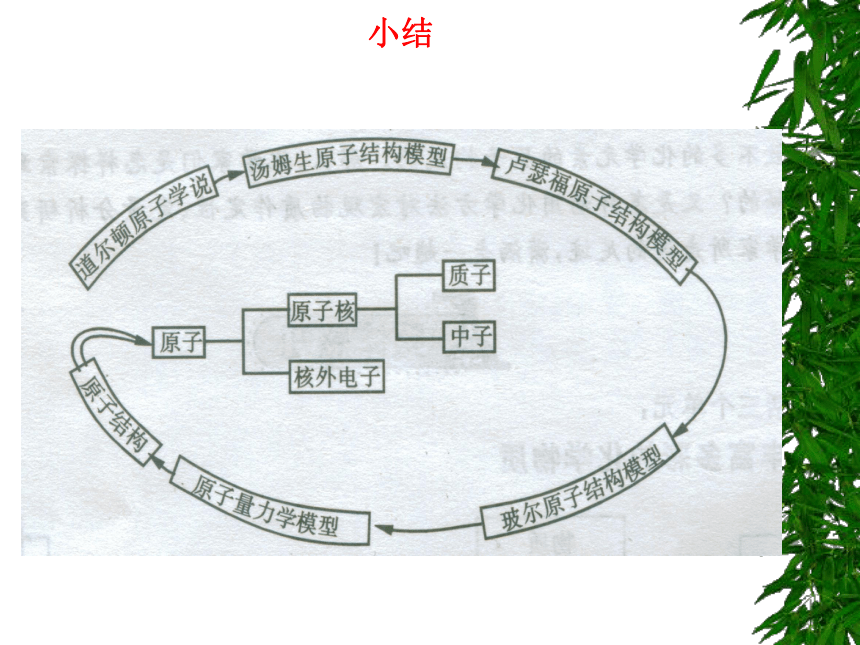
小结
原子结构模型的演变历史给我们的启迪
①化学认识发展的形式与科学认识发展的形式一样是继承、积累突破和革命。
②实验方法是科学研究的一种重要方法,实验手段的不断进步是化学发展的一个关键。
③科学研究、科学发现是无止境的。
核外电子分层排布
电子按能量高低在核外分层排布。
1 2 3 4 5 6 7
K L M N O P Q
由内到外,能量逐渐升高
核外电子排布的一般规律:
1、K层为最外层时,最多容纳电子数------------。
2、其他各层为最外层最多容纳电子数------------。
3、次外层最多容纳电子数--------------------------。
4、倒数第三层最多容纳电子数-------------------。
5、第n层最多容纳电子数-------------------------。
2个
8个
18个
32个
2n2个
注意:多条规律必须同时兼顾。
各层电子的数目
原子符号
核电荷数
电子层
4、离子结构示意图
辨析原子结构示意图和离子结构示意图
注意:任何原子都有趋于8电子(或2电子)稳定结构的倾向,因此活泼的原子会发生电子得失
5、离子化合物的形成
共价化合物的形成
原子
核电荷数=核内质子数=核外电子数=原子序数
阳离子:质子数=核外电子数+电荷数
阴离子:质子数=核外电子数-电荷数
核电荷数=核内质子数=原子序数≠核外电子数
离子
你知道的微粒有哪些?
原子:化学变化中的最小微粒。
什么是原子
原子核:原子的组成部分,位于原子的中心,由质子和中子构成,带正电的小微粒,所占的体积忽略不计.几乎集中了原子的所有质量。
原子核
二、原子的结构
1、原子的构成
2.理解几个概念
1、粒子的相对质量
原子的质量数:将原子核内所有质子和中子的相对质量,取整数加起来所得的数值叫质量数
质量数=质子数+中子数
电子
电子:原子的组成部分,位于原子核外围,带负电的小微粒,带一单位负电荷,是质子质量的1/1836,在原子中质量可以不计,电子云占有了原子几乎所有的体积。
质子
质子:原子核的组成部分,带正电的小微粒,一个质子带一个单位的正电荷,相对质量是1.007。
电子云:
电子围绕原子核作高速运动,就向云雾笼罩在原子核周围,我们形象称之为电子云。
相对质量:
是电子、质子、中子的质量与12C原子质量的1/12(1.661×10-27 kg)相比较所得的数值。
3. 质子、中子、电子的电性和电量怎样?
1个质子带一个单位正电荷
1个电子带一个单位负电荷
中子不显电性
中子
中子: 原子核的组成部分,不带电的小微粒,相对质量是1.008。
离子
离子:带电的原子或原子团。
分子
分子:保持物质化学性质的一种微粒。
质量数:
原子核内所有质子和中子的相对质量取整数加起来,所得数值称为质量数(A)。
用X表示元素, Z表示数质子,N表示中子数则原子的表达式为:
质量数(A)= 质子数(Z)+ 中子数(N)
核电荷数=核内质子数=核外电子数。(原子状态)
2、原子的表达方式
ZX
A
来表示一个质量数为A、质子数为Z的具体的X原子。
比如: 6 12 C表示质量数为12,原子核内有6个质子和6个中子的碳原子。
注意:
a、元素符号(X)
左上角写上质量数
左下角写上质子数
原子符号 X
b、
原子质量(m)
12C (m) 1/12
= 相对原子质量 = 摩尔质量 (g/mol) ≈质量数
c、原子与对应离子比较,电子数不等,质子数、中子、质量、相对原子质量、质量数仍相等。
Cl
17
35
-
a
b
+
d
X
c
a——代表质量数;
b——代表核电荷数;
c——代表离子的价态;
d——代表化合价
e ——代表原子个数
e
a、b、c、d、e各代表什么?
1. 氧原子的质量数为16,质子数为8,那么它的中子数是多少?( 8 )
2. 钠原子的质量数为23,中子数为12,那么它的质子数是多少?核外电子数是多少?
( 11,11 )
3. 硫的二价阴离子的核外电子数是18,中子数为17,那么它的质量数是多少?( 33 )
解:因为 S2- 的核外电子数是18,即硫原子得
到 2 个电子后,是18,那么硫原子的核外电子数是16,则16+17=33。
质子:决定元素的种类,与中子共
同决定原子的相对原子质量
中子:决定原子的种类,与质子共
同决定原子的相对原子质量
电子:最外层电子数决定元素的
化学性质
微粒数计算 ①
电子总数 质子总数 中子总数
D216O 1×2+8 10 (2-1)×2 +(16-8)
23Na35Cl 11+17 28 (23-11)+(35—17)
OH— 8+1+1 9 (16-8) +(1—1)
NH4+ 7+1×4-1 11 (14—7)+(1—1)×4
微粒数计算 ②
A、2g重水中多少个中子?
D2O ~ 中子
20g 10×6.02×1023个
2g x 个
B、R2-含x 个电子,质量数A ,mgR2-中多少个中子?
R2- ~ 中子
Ag [A—(X—2)] ×6.02×1023个
mg x 个
3、核素和同位素
⑵同位素定义:质子数相同而中子数不同的同一元素的不同原子互称为同位素。注意:Z同:表示同一元素N不同:质量数A不同,原子也不同
注意:Z同:同一元素 ;N不同:A不同,原子也不同
原子的种类是由质子数和中子数共同决定的。同 位素是原子的互称,是单质的互称。
⑴核素定义:具有一定质子数和一定中子数的原子
同种核素特征:质子数相同,中子数也相同.
氢元素:同一种核素 11H 11H+ 11H-
不同种核素 11H 12H 13H
⑶特性:(1)化学性质几乎完全相同。 1735 Cl、17 37 Cl
(2)原子个数百分比(即丰度)基本不变。
17 35 Cl 75.77% ; 17 37 Cl 24.23%
(3)物理性质不同:N不同, A不同, M不同,
m不同, d不同。
⑷元素、核素和同位素的关系
在天然元素中,多数元素含有多种核素,少数元素只含有一种核素(例如Na、K等)。某种元素跟核素和同位素的关系:
同位素
核素
核素
某种元素
⑸用途:(1) C :612C、613C、614C
614C每隔5568年它的质量就会减少一半,考古学家根据生物体内614C的含量,就可判断其生活的年代.
(2) 11H N=0 氕
12H(D) N=1 氘(重氢)
13H(T) N=2 氚(超重氢)
制氢弹
O:816O 8 17O 8 18O
H2O 水 18; D2O 重水 20; T2O 超重水 22
(3)U: 92234U 92235 U 92238U
铀-235 制原子弹
2760CO是恶性肿瘤的“克星”,也可用其辐射育种,刺激增长,保鲜,防腐.
练习
1、元素是质子数相同的( )的统称。
A.原子 B.微粒 C.原子及其对应的离子
2、11H 2、D2、T2、816O 2 、1H217O、D218O2 有
种原子, 种分子, 种元素,
; 属同位素。
3、1735Cl和1737Cl组成Cl,为什么Cl的原子量
≠(35+37)/ 2 ?
C
6
6
2
11H 、D、T
816O、 817O、818O
因为Cl原子的丰度不等
【4】1803年,英国科学家道尔顿提出了近代原子学说,他认为一切物质是由原子构成的,这些原子是微小的不可分割的实心球。1911年,英国科学家卢瑟福用一束平行高速运动的a粒子(a粒子是带两个单位正电荷的氦原子核)轰击金箔时(金原子的核电荷数为79,相对原子质量为197),发现大多数a粒子能穿透金箔,而且不改变原来的运动方向,但是也有一小部分a粒子改变了原来的运动路径,甚至有极少数的a粒子好像碰到了坚硬不可穿透的质点而被弹了回来①有一小部分a粒子改变了原来的运动路径。原因是a粒子途经金原子核附近时,受到斥力而稍微改变了运动方向。②大多数a粒子不改变原来的运动方向。原因是 。
③极少数a粒子被弹了回来。原因是 。
④按现在对原子、分子的认识,你认为道尔顿提出的近代原子学说中不确切的地方,请用“ ”划出,并在下方加以改正。
⑤金原子的核外电子数为 ,中子数为 。
金原子核被一个体积很大的几乎什么也没有的空间包围着a粒子穿越这个空间
a粒子撞击了金原子核而弹回(仪粒子撞击了带正电荷、质量大、体积很小的金原子核而被弹回)
一切 不可分割 实心球
一些 可分割 电子在原子核外的空间内做高速运动
79
118
例:硼有10B和11B两种同位素组成,硼元素的原子量 为10.8,求10B和11B在自然界中各自的百分比。
解:设10B所占百分比为x:
10 × x + 11 × (1-x) = 10.8
x = 0.2
∴10B占20%,11B占80%。
5、下列说法不正确的是( )
①、质子数相同的粒子一定属于同种元素
②、同位素的化学性质几乎完全相同
③、质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子
④、电子数相同的粒子不一定是同一种元素
⑤、一种元素只能有一种质量数
A、①②④⑤B、③④⑤C、②③⑤ D、①⑤
6、在微粒RO3n-中,共有X个核外电子,R原子的质量数为A,求R原子核内所含的中子数?若现有m克微粒RO3n-中,质子数为?R原子核内所含的中子数为?
