元素周期律[下学期]
图片预览



文档简介
课件11张PPT。二、元素周期律:1、随着原子序数的递增,元素原子的最外层电子呈周期性的变化。2、随着原子序数的递增,元素的化合价呈周期性的变化。3、随着原子序数的递增,元素的原子半径呈周期性的变化。元素周期律——元素的性质随着元素原子序数的递增而呈周期性的变化。1、元素的性质与元素在周期表中的位置关系 同主族:从上到下各元素原子的电子层数依次增多,原
子半径逐渐增大,失电子能力逐渐增强,得电子能力
逐渐减弱,因此元素的金属性逐渐增强,非金属性逐渐减弱。(即金属单质的还原性逐渐增强,非金属单质的氧化性逐渐减弱。)同周期:从左向右原子的核外电子层数相同,核电荷数依次增多,原子半径逐渐减小,失电子能力逐渐减
弱,得电子能力逐渐增强,因此,金属性逐渐减弱,
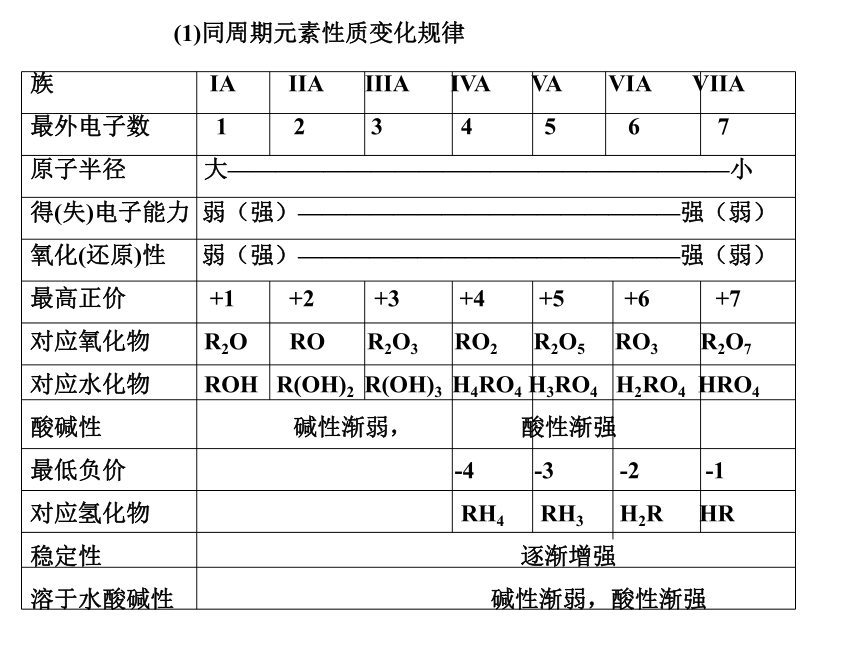
非金属性逐渐增强。同周期,同主族性质比较(1)同周期元素性质变化规律族 IA IIA IIIA IVA VA VIA VIIA
最外电子数 1 2 3 4 5 6 7
原子半径 大—————————————————————小
得(失)电子能力 弱(强)————————————————强(弱)
氧化(还原)性 弱(强)————————————————强(弱)
最高正价 +1 +2 +3 +4 +5 +6 +7
对应氧化物 R2O RO R2O3 RO2 R2O5 RO3 R2O7
对应水化物 ROH R(OH)2 R(OH)3 H4RO4 H3RO4 H2RO4 HRO4
酸碱性 碱性渐弱, 酸性渐强
最低负价 -4 -3 -2 -1
对应氢化物 RH4 RH3 H2R HR
稳定性 逐渐增强
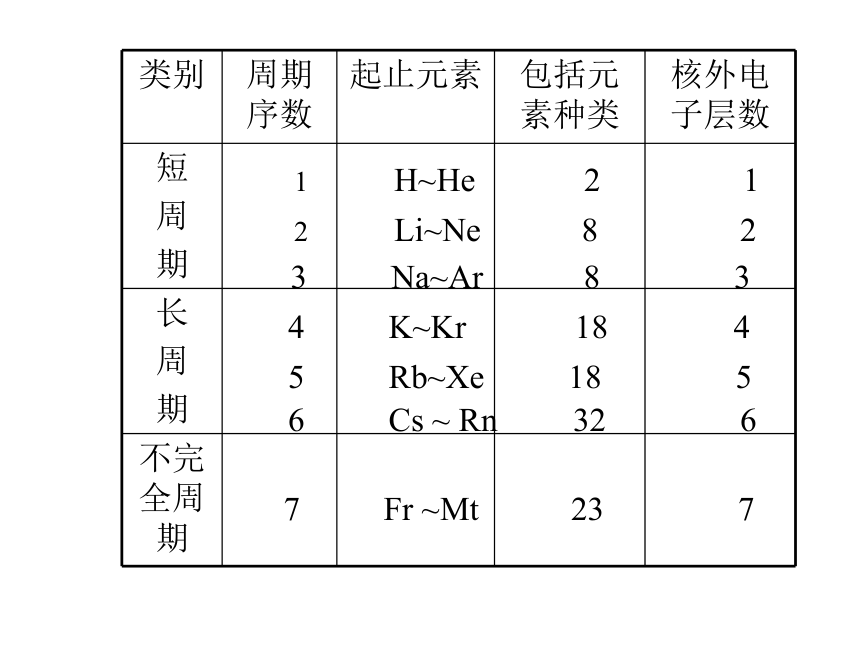
溶于水酸碱性 碱性渐弱,酸性渐强1 H~He 2 1
2 Li~Ne 8 2
3 Na~Ar 8 34 K~Kr 18 46 Cs ~ Rn 32 6 5 Rb~Xe 18 5 7 Fr ~Mt 23 7
(2)同族金增非递减,同周金减非增递 内容 同周期(从左到右) 同主族(从上到下)
电子层数 相同(等于周期序数) 逐渐增加
最外电子数 逐渐增加(1~8) 相同(等于族序数)
最高正价 +1~~+7 等于族序数
原子半径 逐渐减小 逐渐增大
得电子能力(氧化性) 逐渐增强 逐渐减弱
失电子能力(还原性) 逐渐减弱 逐渐增强
金属性 逐渐减弱 逐渐增强
非金属性 逐渐增强 逐渐减弱
最高价氧化物对应
水化物酸碱性 碱性渐弱酸性渐强 碱性渐强酸性渐弱
气态氢化物稳定性 逐渐增强 逐渐减弱1.元素是按什么规律排列的呢?2.元素在周期表中的位置与它的原子结构
及性质有怎样的联系呢?[问题]------元素周期表 根据元素周期律,把电子层数目相同的各种元素,按原子序数递增的顺序从左到右排成横行,再把不同横行中最外层电子数相同的元素,按电子层数递增的顺序从上而下排成纵行,这样排列得到的表就称为元素周期表。思考1:周期数和原子核外电子层数有什么关系?周期序数=该周期元素原子的核外电子层数思考2:主族序数和最外层电子数有什么关系?主族序数=该主族元素原子的最外层电子数主族元素:最高正价 + 最低负价 = 8 .元素排布分四区,三角变化有联系位置性质结构最外层电子数
电子层数(族)纵
(横)周期原子序数1.主要化合价
2.最高价氧化物及其水化物的组成
3.氢化物组成1.金属性与非金属性
2.“水化物”的酸碱性
3.氢化物的稳定性练习:(2)溴位于周期表中第4周期,第Ⅶ族,画出溴的原子结构示意图。 练习:
1、甲元素原子的核电荷数为17,乙元素的正二价离子跟氖原子的电子层结构相同:
(1)甲元素在周期表里位于第——周期第——主族,元素符号为——,它的气态氢化物的化学式为——,它的最高价氧化物对应的水化物化学式是——,
(2)乙元素在周期表里位于第——周期第——主族,元素符号为——,它的最高价氧化物对应的水化物化学式是——。
3.判断金属性和非金属性的依据证明金属性同条件下与水或酸,越易越强。
最高价氧化物所对应的水化物的碱性,越强越强
相互置换
电化学:原电池的负极,电解时后还原金属性强证明非金属性最高价氧化物所对应的水化物的酸性,越强越强
与H2反应的条件和生成氢化物的稳定性
相互置换
电解时后氧化的非金属性强
子半径逐渐增大,失电子能力逐渐增强,得电子能力
逐渐减弱,因此元素的金属性逐渐增强,非金属性逐渐减弱。(即金属单质的还原性逐渐增强,非金属单质的氧化性逐渐减弱。)同周期:从左向右原子的核外电子层数相同,核电荷数依次增多,原子半径逐渐减小,失电子能力逐渐减
弱,得电子能力逐渐增强,因此,金属性逐渐减弱,
非金属性逐渐增强。同周期,同主族性质比较(1)同周期元素性质变化规律族 IA IIA IIIA IVA VA VIA VIIA
最外电子数 1 2 3 4 5 6 7
原子半径 大—————————————————————小
得(失)电子能力 弱(强)————————————————强(弱)
氧化(还原)性 弱(强)————————————————强(弱)
最高正价 +1 +2 +3 +4 +5 +6 +7
对应氧化物 R2O RO R2O3 RO2 R2O5 RO3 R2O7
对应水化物 ROH R(OH)2 R(OH)3 H4RO4 H3RO4 H2RO4 HRO4
酸碱性 碱性渐弱, 酸性渐强
最低负价 -4 -3 -2 -1
对应氢化物 RH4 RH3 H2R HR
稳定性 逐渐增强
溶于水酸碱性 碱性渐弱,酸性渐强1 H~He 2 1
2 Li~Ne 8 2
3 Na~Ar 8 34 K~Kr 18 46 Cs ~ Rn 32 6 5 Rb~Xe 18 5 7 Fr ~Mt 23 7
(2)同族金增非递减,同周金减非增递 内容 同周期(从左到右) 同主族(从上到下)
电子层数 相同(等于周期序数) 逐渐增加
最外电子数 逐渐增加(1~8) 相同(等于族序数)
最高正价 +1~~+7 等于族序数
原子半径 逐渐减小 逐渐增大
得电子能力(氧化性) 逐渐增强 逐渐减弱
失电子能力(还原性) 逐渐减弱 逐渐增强
金属性 逐渐减弱 逐渐增强
非金属性 逐渐增强 逐渐减弱
最高价氧化物对应
水化物酸碱性 碱性渐弱酸性渐强 碱性渐强酸性渐弱
气态氢化物稳定性 逐渐增强 逐渐减弱1.元素是按什么规律排列的呢?2.元素在周期表中的位置与它的原子结构
及性质有怎样的联系呢?[问题]------元素周期表 根据元素周期律,把电子层数目相同的各种元素,按原子序数递增的顺序从左到右排成横行,再把不同横行中最外层电子数相同的元素,按电子层数递增的顺序从上而下排成纵行,这样排列得到的表就称为元素周期表。思考1:周期数和原子核外电子层数有什么关系?周期序数=该周期元素原子的核外电子层数思考2:主族序数和最外层电子数有什么关系?主族序数=该主族元素原子的最外层电子数主族元素:最高正价 + 最低负价 = 8 .元素排布分四区,三角变化有联系位置性质结构最外层电子数
电子层数(族)纵
(横)周期原子序数1.主要化合价
2.最高价氧化物及其水化物的组成
3.氢化物组成1.金属性与非金属性
2.“水化物”的酸碱性
3.氢化物的稳定性练习:(2)溴位于周期表中第4周期,第Ⅶ族,画出溴的原子结构示意图。 练习:
1、甲元素原子的核电荷数为17,乙元素的正二价离子跟氖原子的电子层结构相同:
(1)甲元素在周期表里位于第——周期第——主族,元素符号为——,它的气态氢化物的化学式为——,它的最高价氧化物对应的水化物化学式是——,
(2)乙元素在周期表里位于第——周期第——主族,元素符号为——,它的最高价氧化物对应的水化物化学式是——。
3.判断金属性和非金属性的依据证明金属性同条件下与水或酸,越易越强。
最高价氧化物所对应的水化物的碱性,越强越强
相互置换
电化学:原电池的负极,电解时后还原金属性强证明非金属性最高价氧化物所对应的水化物的酸性,越强越强
与H2反应的条件和生成氢化物的稳定性
相互置换
电解时后氧化的非金属性强
