核外电子排布及元素周期律[下学期]
图片预览





文档简介
课件26张PPT。回顾
随着原子序数的递增
元素原子的核外电子排布
元素原子半径
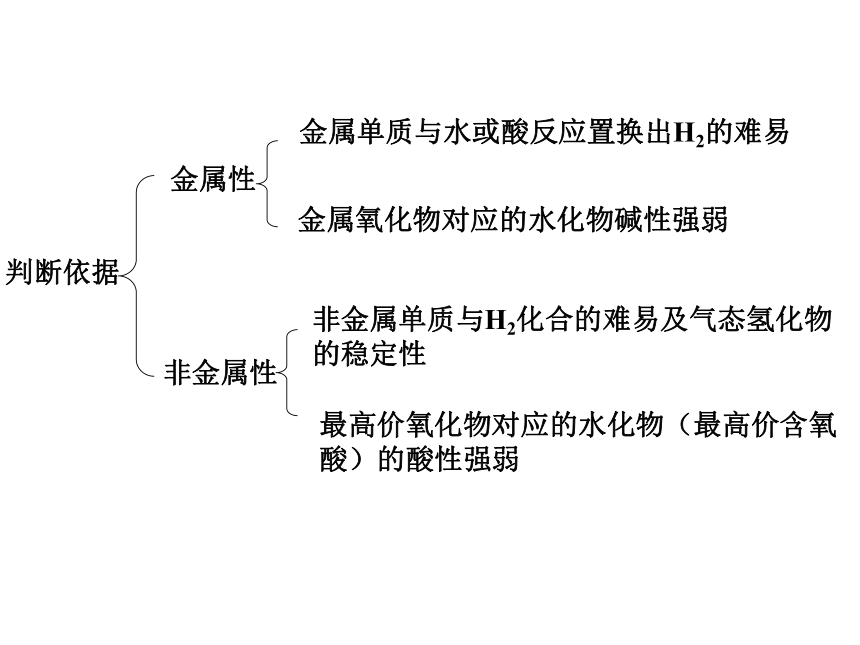
元素主要化合价呈现周期性变化 Na Mg Al Si P S Cl 金属性逐渐减弱,非金属性逐渐增强用结构观点解释从左到右→ 电子层数相同,核电荷数增多→原子半径减小→ 失电子能力逐渐减弱 得电子能力逐渐增强思考:锂与钠的金属性强弱比较。判断依据元素周期表及其应用Na
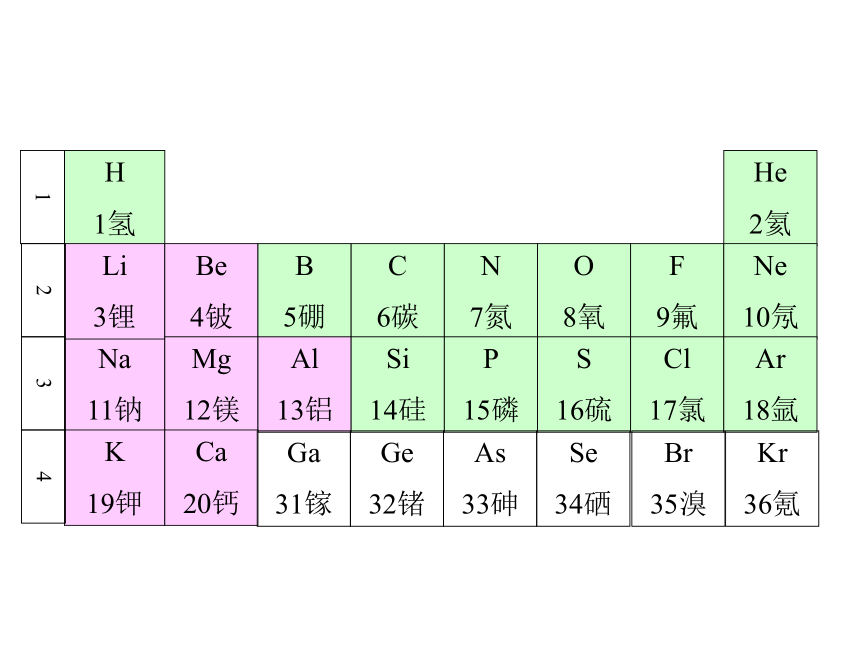
11钠H
1氢He
2氦Li
3锂Be
4铍B
5硼C
6碳N
7氮O
8氧F
9氟Ne
10氖Mg
12镁Al
13铝Si
14硅P
15磷S
16硫Cl
17氯Ar
18氩K
19钾Ca
20钙1234Ga
31镓Ge
32锗As
33砷Se
34硒Br
35溴Kr
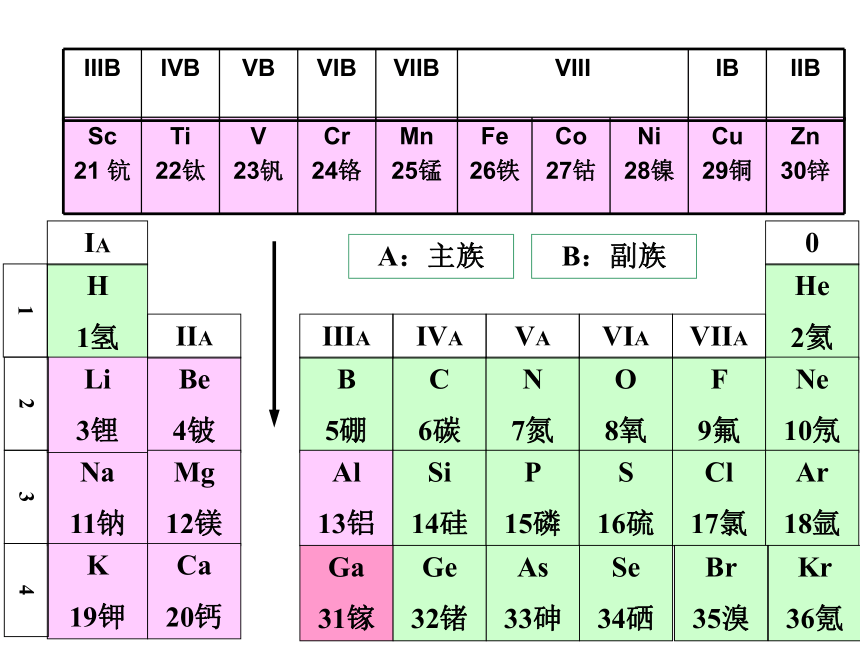
36氪元素周期表 元素周期律的具体表现形式编排原则: ⑴ 按原子序数的递增顺序从左到右排列 ⑵ 将电子层数相同的元素排列成一个横行
(周期) ⑶ 把最外层电子数相同的元素按电子层数
递增的顺序从上到下排成纵行。(族)A:主族B:副族Ga
31镓Ge
32锗As
33砷Se
34硒Br
35溴Kr
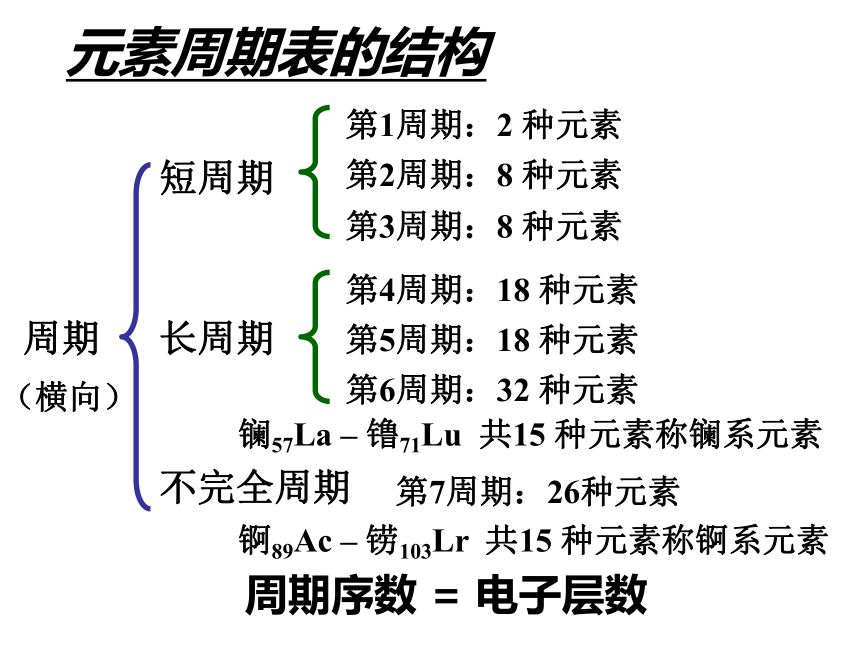
36氪元素周期表的结构周期短周期长周期第1周期:2 种元素第2周期:8 种元素第3周期:8 种元素第4周期:18 种元素第5周期:18 种元素第6周期:32 种元素不完全周期第7周期:26种元素镧57La – 镥71Lu 共15 种元素称镧系元素锕89Ac – 铹103Lr 共15 种元素称锕系元素周期序数 = 电子层数 (横向)元素周期表的结构 族主族:副族:ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA 第VIII 族:稀有气体元素主族序数 = 最外层电子数 (纵向) 零族:共七个主族:长短周期共同组成ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB 共七个副族:仅由长周期组成三个纵行,位于Ⅶ B 与ⅠB中间 其它周期表其它周期表其它周期表其它周期表练习与思考:1、推算原子序数为6、13、34、53、88的元素在周期表中的位置。23457IVAIIIAVIAVIIAIIA练习与思考:2、下列各组中的元素用原子序数表示,其中都属于主族的一组元素是( )
(A)14、24、34 (B)26、31、35
(C)5、15、20 (D)11、17、18C练习与思考:3、下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)D元素性质的递变规律同周期(左→右)项 目核电荷数同主族(上→下)电子层数原子半径化 合 价 相 同 逐渐减小 最高正价:+1 →+7 逐渐增大 负化合价:- 4 → -1 增 大 增 多 逐渐增大 最高正价=族序数 负化合价= -(8-族序数)主族元素原子的最外层电子叫做价电子 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强练习1金属性最强的元素(不包括放射性元素)是 ;
最活泼的非金属元素是 ;
最高价氧化物对应水化物的酸性最强的元素是 ;
最高价氧化物对应水化物的碱性最强的元素(不包括放射性元素)是 。CsFClCs原子结构表中位置元素性质原子序数= 核电荷数周期数= 电子层数主族序数=最外层电子数同位素-化学性质相同 相似性
递变性(从上至下,金属性增强,非金属性减弱)同周期同主族递变性(从左到右,金属性减弱,非金属性增强)电子层数最外层电子数金属性、非金属性强弱(主族)最外层电子数 = 最高正价 最外层电子数-8 = 负价原子结构决定元素在周期表中的位置,决定性质比较微粒半径大小的规律 ⑴ 同周期元素的原子或最高价离子(相同电荷)半径从左到右渐小 ⑵ 同主族元素的原子或离子半径从上到下渐大 ⑷ 同种元素的微粒:阳离子<中性原子<阴离子
价态越高,微粒半径越小。⑶ 核外电子排布相同的离子半径随电荷数的增加而减小 Na >Mg >Al >Si Na+ >Mg2+ >Al3+ Li < Na < K F- < Cl- < Br- O2 > F- > Na+ > Mg2+ > Al3+ (第二周期阴离子)(第三周期阳离子) Fe+3 < Fe2+ < Fe H+ < H < H-练习21、有a、b、c、d四种元素,a、b的阳离子与c、d的阴离子具有相同的电子层结构,a的阳离子的正电荷数小于b的阳离子,c的阴离子负电荷数大于d的阴离子,则它们的离子半径关系是( )
A、a>b>c>d B、b>a>d>c
C、c>a>d>b D、c>d>a>b
√元素周期律及元素周期表
的三大意义 ⑴ 学习和研究化学的规律和工具 ⑵ 研究发现新物质 ⑶ 论证了量变引起质变的规律性 预言新元素,研究新农药,寻找半导体材料、催化剂、耐高温耐腐蚀材料。练习3同一周期的X、Y、Z三元素,已知最高价氧化物对应水化物的化学式是:H3XO4、H2YO4、HZO4,则: (1)X、Y、Z的非金属性强弱顺序为_____________。(2)气态氢化物的化学式分别为________________,它们稳定性强弱为_____________________________。(3)最高价氧化物对应水化物的酸性强弱为_______ _________________________________。Z>Y>XXH3<H2Y<HZH3XO4<H2YO4<HZO4XH3、H2Y、HZ练习4X、Y、Z是主族的三种非金属元素,它们在周期表中的位置如图所示。试回答: (1)X元素单质的化学式是________。 (2)Y元素的原子结构示意图是________,Y与钠反应的化学反应方程式为____________ ___________________________________。(3)Z元素的名称是______,从元素原子得失电子的角度看,Z元素具有___________性;若从Z元素在周期表中所处位置看,它具有这种性质的原因是_________________________ _______________________________________。F2S + 2Na = Na2S砷既有金属性也有非金属它位于周期表的金属与非金属的分界线上练习51、两种短周期的元素X和Y,可组成化合物XY3,当Y的原子序数为m时,X的原子序数为(1)m-4 (2)m+4 (3)m+8 (4)m-2 (5)m+6。其中正确的组合是( )
A、(1)(2)
B、(1)(2)(3)
C、(1)(2)(5)
D、(1)(2)(3)(4)(5)
√
随着原子序数的递增
元素原子的核外电子排布
元素原子半径
元素主要化合价呈现周期性变化 Na Mg Al Si P S Cl 金属性逐渐减弱,非金属性逐渐增强用结构观点解释从左到右→ 电子层数相同,核电荷数增多→原子半径减小→ 失电子能力逐渐减弱 得电子能力逐渐增强思考:锂与钠的金属性强弱比较。判断依据元素周期表及其应用Na
11钠H
1氢He
2氦Li
3锂Be
4铍B
5硼C
6碳N
7氮O
8氧F
9氟Ne
10氖Mg
12镁Al
13铝Si
14硅P
15磷S
16硫Cl
17氯Ar
18氩K
19钾Ca
20钙1234Ga
31镓Ge
32锗As
33砷Se
34硒Br
35溴Kr
36氪元素周期表 元素周期律的具体表现形式编排原则: ⑴ 按原子序数的递增顺序从左到右排列 ⑵ 将电子层数相同的元素排列成一个横行
(周期) ⑶ 把最外层电子数相同的元素按电子层数
递增的顺序从上到下排成纵行。(族)A:主族B:副族Ga
31镓Ge
32锗As
33砷Se
34硒Br
35溴Kr
36氪元素周期表的结构周期短周期长周期第1周期:2 种元素第2周期:8 种元素第3周期:8 种元素第4周期:18 种元素第5周期:18 种元素第6周期:32 种元素不完全周期第7周期:26种元素镧57La – 镥71Lu 共15 种元素称镧系元素锕89Ac – 铹103Lr 共15 种元素称锕系元素周期序数 = 电子层数 (横向)元素周期表的结构 族主族:副族:ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA 第VIII 族:稀有气体元素主族序数 = 最外层电子数 (纵向) 零族:共七个主族:长短周期共同组成ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB 共七个副族:仅由长周期组成三个纵行,位于Ⅶ B 与ⅠB中间 其它周期表其它周期表其它周期表其它周期表练习与思考:1、推算原子序数为6、13、34、53、88的元素在周期表中的位置。23457IVAIIIAVIAVIIAIIA练习与思考:2、下列各组中的元素用原子序数表示,其中都属于主族的一组元素是( )
(A)14、24、34 (B)26、31、35
(C)5、15、20 (D)11、17、18C练习与思考:3、下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)D元素性质的递变规律同周期(左→右)项 目核电荷数同主族(上→下)电子层数原子半径化 合 价 相 同 逐渐减小 最高正价:+1 →+7 逐渐增大 负化合价:- 4 → -1 增 大 增 多 逐渐增大 最高正价=族序数 负化合价= -(8-族序数)主族元素原子的最外层电子叫做价电子 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强练习1金属性最强的元素(不包括放射性元素)是 ;
最活泼的非金属元素是 ;
最高价氧化物对应水化物的酸性最强的元素是 ;
最高价氧化物对应水化物的碱性最强的元素(不包括放射性元素)是 。CsFClCs原子结构表中位置元素性质原子序数= 核电荷数周期数= 电子层数主族序数=最外层电子数同位素-化学性质相同 相似性
递变性(从上至下,金属性增强,非金属性减弱)同周期同主族递变性(从左到右,金属性减弱,非金属性增强)电子层数最外层电子数金属性、非金属性强弱(主族)最外层电子数 = 最高正价 最外层电子数-8 = 负价原子结构决定元素在周期表中的位置,决定性质比较微粒半径大小的规律 ⑴ 同周期元素的原子或最高价离子(相同电荷)半径从左到右渐小 ⑵ 同主族元素的原子或离子半径从上到下渐大 ⑷ 同种元素的微粒:阳离子<中性原子<阴离子
价态越高,微粒半径越小。⑶ 核外电子排布相同的离子半径随电荷数的增加而减小 Na >Mg >Al >Si Na+ >Mg2+ >Al3+ Li < Na < K F- < Cl- < Br- O2 > F- > Na+ > Mg2+ > Al3+ (第二周期阴离子)(第三周期阳离子) Fe+3 < Fe2+ < Fe H+ < H < H-练习21、有a、b、c、d四种元素,a、b的阳离子与c、d的阴离子具有相同的电子层结构,a的阳离子的正电荷数小于b的阳离子,c的阴离子负电荷数大于d的阴离子,则它们的离子半径关系是( )
A、a>b>c>d B、b>a>d>c
C、c>a>d>b D、c>d>a>b
√元素周期律及元素周期表
的三大意义 ⑴ 学习和研究化学的规律和工具 ⑵ 研究发现新物质 ⑶ 论证了量变引起质变的规律性 预言新元素,研究新农药,寻找半导体材料、催化剂、耐高温耐腐蚀材料。练习3同一周期的X、Y、Z三元素,已知最高价氧化物对应水化物的化学式是:H3XO4、H2YO4、HZO4,则: (1)X、Y、Z的非金属性强弱顺序为_____________。(2)气态氢化物的化学式分别为________________,它们稳定性强弱为_____________________________。(3)最高价氧化物对应水化物的酸性强弱为_______ _________________________________。Z>Y>XXH3<H2Y<HZH3XO4<H2YO4<HZO4XH3、H2Y、HZ练习4X、Y、Z是主族的三种非金属元素,它们在周期表中的位置如图所示。试回答: (1)X元素单质的化学式是________。 (2)Y元素的原子结构示意图是________,Y与钠反应的化学反应方程式为____________ ___________________________________。(3)Z元素的名称是______,从元素原子得失电子的角度看,Z元素具有___________性;若从Z元素在周期表中所处位置看,它具有这种性质的原因是_________________________ _______________________________________。F2S + 2Na = Na2S砷既有金属性也有非金属它位于周期表的金属与非金属的分界线上练习51、两种短周期的元素X和Y,可组成化合物XY3,当Y的原子序数为m时,X的原子序数为(1)m-4 (2)m+4 (3)m+8 (4)m-2 (5)m+6。其中正确的组合是( )
A、(1)(2)
B、(1)(2)(3)
C、(1)(2)(5)
D、(1)(2)(3)(4)(5)
√
