元素周期律[下学期]
图片预览







文档简介
课件24张PPT。复 习 回 忆写出锂、氖、钾、氯的原子结构示意图要求:必须掌握原子序数1~20的元素
会写出元素符号、中文名称
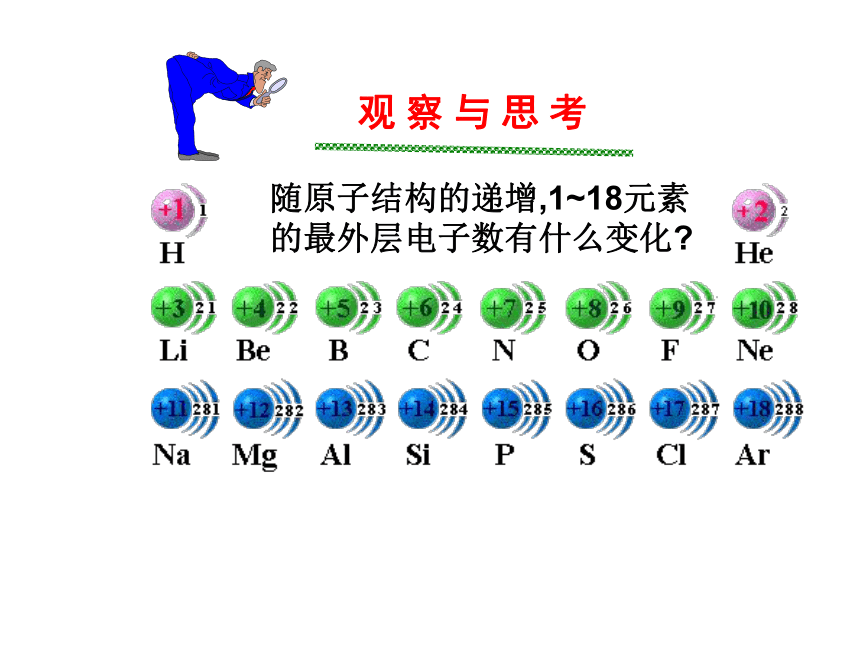
会写出原子结构示意图观 察 与 思 考随原子结构的递增,1~18元素
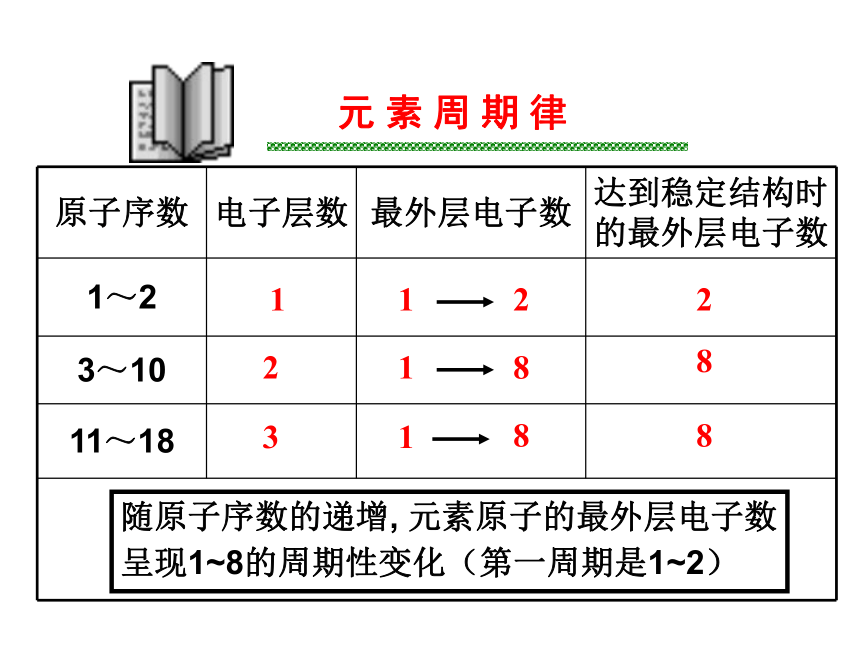
的最外层电子数有什么变化?元 素 周 期 律112221883188随原子序数的递增, 元素原子的最外层电子数
呈现1~8的周期性变化(第一周期是1~2)观 察 与 思 考阅读课本P4表1-2 内容思考:随原子结构的递增, 元素的原
子半径有什么变化?逐渐减小逐渐减小结论:随原子序数的递增, 元素原子
的半径呈现由大到小的周期性变化交 流 与 讨 论根据表1-2 中半径数据进行横向和纵向比较,
想一想:影响半径的因素是什么?
怎样比较粒子半径大小?影响原子半径的因素:1、核电荷数(质子数)
2、电子层数(核外电子数)比较粒子半径大小的一般规律1、当电子层数相同时,核电荷数越大,原子半径越小
2、最外层电子数相同时,电子层数多,原子半径越大
3、同一元素,电子越多,原子半径越大
阳离子半径<原子半径 阴离子半径>原子半径
4、核外电子排布结构相同,核电荷数越大,粒子半径越小交 流 与 实 践随原子结构的递增,元素原子的最外层电子的排
布呈现周期性变化,元素原子的半径呈现周期性
变化,那元素的性质有没有周期性变化呢?根据课本P5 信息提示 部分内容,思考:
以第三周期的元素为例,怎样比较Na、Mg、Al
的金属性强弱?怎样比较Si、P、S、Cl的非金属
性的强弱?元素的金属性——
元素的非金属性——元素失电子的能力元素得电子的能力元素金属性强弱的判断依据金属单质与水反应容易程度 金属单质与酸反应容易程度最高价氧化物对应水化物的碱性强弱 金属单质间的置换反应 元素非金属性强弱的判断依据 非金属 单质与氢气反应的难易 气态氢化物的稳定性强弱 最高价氧化物对应水化物的酸性强弱 非金属单质间的置换反应 习 题 巩 固下列说法正确的是 ( )
A、半径S>Cl,所以非金属性S>Cl
B、氢氧化钾是强碱,而氢氧化铝呈两性,
所以金属性K>Al
C、HClO的酸性弱于碳酸,所以非金属性ClD、H2S没有HCl稳定性好,所以非金属性S 2NaOH + H2 ↑Mg + 2H2O ═
Mg(OH)2 + H2 ↑
(缓慢)实 验 探 究实 验 探 究第二组:Mg、Al与盐酸反应 反应迅速,产生大量气泡,试管发热刚开始时反应较慢,缓缓产生气泡结论: Mg 的金属性比AlMg + 2H+ ═
Mg2+ +H2 ↑2Al + 6 H+ ═
2Al 3+ + 3H2 ↑实 验 探 究元素的金属性:Na>Mg>Al强碱中强碱两性氢氧化物元素金属性强弱的判断阅读分析P6表1-4内容,思考Si、P、S、Cl
的单质与氢气化合的难易如何变化?
气态氢化物的稳定性如何变化?
在此基础上比较Si、P、S、Cl非金属性的强弱Si、P、S、Cl的单质与氢气化合越来越容易
Si、P、S、Cl的气态氢化物越来越稳定
所以Si、P、S、Cl的非金属性逐渐增强小结:随原子序数的递增,同周期元素的金属性
逐渐减弱,非金属性逐渐增强,呈现周期性变化元素金属性强弱的判断阅读分析P6表1-4和表1-5有关化合价的内容,
思考元素的最高正价和最低负价如何变化?
最高正价和最低负价有何关系?小结:随原子序数的递增,元素的最高正价由
+1→+7,最低负价由- 4 →-1,呈现周期性变化最高正价+│最低负价│ = 8金属无负价 F无正价、O不考虑正价①电子层数:电子层数越多,原子半径越大②核电荷数:核电荷数越大,原子半径越小其原子的半径越小具有相同电子层数的原子:核电荷数越大核对外层电子的吸引力增强原子失电子能力减弱,
得电子能力增强理 论 分 析随着原子序数的递增核外电子排布呈周期性变化元素性质呈周期性变化元素周期律最外层电子数 1→8(K层电子数 1→2)原子半径 大→小化合价:+1→+7 -4→-1(稀有气体元素为零)决定了归纳出引起了金属性与非金属性知 识 总 结 元素的性质随着原子序数的递增
而呈现周期性的变化规律。 元素周期律是元素原子的核外电子排布随着元素
核电荷数的递增而呈现周期性的变化的必然结果。元素周期律——元 素 周 期 律 门捷列夫不自觉地应用黑格尔
的量转化为质的规律,完成了
科学史上一个勋业。
—— 恩格斯19世纪中叶门捷列夫
发现了元素周期律元 素 周 期 律 ? 元素的性质呈周期性变化的根本原因是 ( )
A.元素原子量的递增,量变引起质变
B.元素的原子半径呈周期性变化
C.元素原子的核外电子排布呈周期性变化
D.元素的金属性和非金属性呈周期性变化习 题 巩 固 1、用元素符号(化学式)回答原子序数11~18的元素的有关问题:1)除稀有气体外,原子半径最大的是 :2)最高价氧化物的水化物碱性最强的是 ; 最高价氧化物的水化物呈两性的是 ;最高价氧化物的水化物酸性最强的是 ; 3)能形成气态氢化物且最稳定的是 。NaNaOHHClO4Al(OH)3HCl巩固提高2、电子层数相同的X、Y、Z三种元素,已知最高价氧化物对应的水化物的酸性是 HXO4 > H2YO4 > H3ZO4,则下列说法判断错误的是( )
A. 核电荷数 X > Y > Z
B. 气态氢化物稳定性 ZH3 > H2Y > HX
C. 元素的非金属性 X > Y > Z
D. 单质的氧化性 X > Y > Z 巩固提高B巩固提高3、下列递变情况正确的是:( )
A. Na、Mg、Al最外层电子数依次增多,其单质的还原性依次增强
B. P、S、Cl最高正价依次升高,对应气态氢化物稳定性增强
C. C、N、O原子半径依次增大
D. Na、K、Rb氧化物的水化物碱性依次增强BD你能试一试吗:
用实验证明氯气的活泼性比硫强——非金属性Si
会写出元素符号、中文名称
会写出原子结构示意图观 察 与 思 考随原子结构的递增,1~18元素
的最外层电子数有什么变化?元 素 周 期 律112221883188随原子序数的递增, 元素原子的最外层电子数
呈现1~8的周期性变化(第一周期是1~2)观 察 与 思 考阅读课本P4表1-2 内容思考:随原子结构的递增, 元素的原
子半径有什么变化?逐渐减小逐渐减小结论:随原子序数的递增, 元素原子
的半径呈现由大到小的周期性变化交 流 与 讨 论根据表1-2 中半径数据进行横向和纵向比较,
想一想:影响半径的因素是什么?
怎样比较粒子半径大小?影响原子半径的因素:1、核电荷数(质子数)
2、电子层数(核外电子数)比较粒子半径大小的一般规律1、当电子层数相同时,核电荷数越大,原子半径越小
2、最外层电子数相同时,电子层数多,原子半径越大
3、同一元素,电子越多,原子半径越大
阳离子半径<原子半径 阴离子半径>原子半径
4、核外电子排布结构相同,核电荷数越大,粒子半径越小交 流 与 实 践随原子结构的递增,元素原子的最外层电子的排
布呈现周期性变化,元素原子的半径呈现周期性
变化,那元素的性质有没有周期性变化呢?根据课本P5 信息提示 部分内容,思考:
以第三周期的元素为例,怎样比较Na、Mg、Al
的金属性强弱?怎样比较Si、P、S、Cl的非金属
性的强弱?元素的金属性——
元素的非金属性——元素失电子的能力元素得电子的能力元素金属性强弱的判断依据金属单质与水反应容易程度 金属单质与酸反应容易程度最高价氧化物对应水化物的碱性强弱 金属单质间的置换反应 元素非金属性强弱的判断依据 非金属 单质与氢气反应的难易 气态氢化物的稳定性强弱 最高价氧化物对应水化物的酸性强弱 非金属单质间的置换反应 习 题 巩 固下列说法正确的是 ( )
A、半径S>Cl,所以非金属性S>Cl
B、氢氧化钾是强碱,而氢氧化铝呈两性,
所以金属性K>Al
C、HClO的酸性弱于碳酸,所以非金属性Cl
Mg(OH)2 + H2 ↑
(缓慢)实 验 探 究实 验 探 究第二组:Mg、Al与盐酸反应 反应迅速,产生大量气泡,试管发热刚开始时反应较慢,缓缓产生气泡结论: Mg 的金属性比AlMg + 2H+ ═
Mg2+ +H2 ↑2Al + 6 H+ ═
2Al 3+ + 3H2 ↑实 验 探 究元素的金属性:Na>Mg>Al强碱中强碱两性氢氧化物元素金属性强弱的判断阅读分析P6表1-4内容,思考Si、P、S、Cl
的单质与氢气化合的难易如何变化?
气态氢化物的稳定性如何变化?
在此基础上比较Si、P、S、Cl非金属性的强弱Si、P、S、Cl的单质与氢气化合越来越容易
Si、P、S、Cl的气态氢化物越来越稳定
所以Si、P、S、Cl的非金属性逐渐增强小结:随原子序数的递增,同周期元素的金属性
逐渐减弱,非金属性逐渐增强,呈现周期性变化元素金属性强弱的判断阅读分析P6表1-4和表1-5有关化合价的内容,
思考元素的最高正价和最低负价如何变化?
最高正价和最低负价有何关系?小结:随原子序数的递增,元素的最高正价由
+1→+7,最低负价由- 4 →-1,呈现周期性变化最高正价+│最低负价│ = 8金属无负价 F无正价、O不考虑正价①电子层数:电子层数越多,原子半径越大②核电荷数:核电荷数越大,原子半径越小其原子的半径越小具有相同电子层数的原子:核电荷数越大核对外层电子的吸引力增强原子失电子能力减弱,
得电子能力增强理 论 分 析随着原子序数的递增核外电子排布呈周期性变化元素性质呈周期性变化元素周期律最外层电子数 1→8(K层电子数 1→2)原子半径 大→小化合价:+1→+7 -4→-1(稀有气体元素为零)决定了归纳出引起了金属性与非金属性知 识 总 结 元素的性质随着原子序数的递增
而呈现周期性的变化规律。 元素周期律是元素原子的核外电子排布随着元素
核电荷数的递增而呈现周期性的变化的必然结果。元素周期律——元 素 周 期 律 门捷列夫不自觉地应用黑格尔
的量转化为质的规律,完成了
科学史上一个勋业。
—— 恩格斯19世纪中叶门捷列夫
发现了元素周期律元 素 周 期 律 ? 元素的性质呈周期性变化的根本原因是 ( )
A.元素原子量的递增,量变引起质变
B.元素的原子半径呈周期性变化
C.元素原子的核外电子排布呈周期性变化
D.元素的金属性和非金属性呈周期性变化习 题 巩 固 1、用元素符号(化学式)回答原子序数11~18的元素的有关问题:1)除稀有气体外,原子半径最大的是 :2)最高价氧化物的水化物碱性最强的是 ; 最高价氧化物的水化物呈两性的是 ;最高价氧化物的水化物酸性最强的是 ; 3)能形成气态氢化物且最稳定的是 。NaNaOHHClO4Al(OH)3HCl巩固提高2、电子层数相同的X、Y、Z三种元素,已知最高价氧化物对应的水化物的酸性是 HXO4 > H2YO4 > H3ZO4,则下列说法判断错误的是( )
A. 核电荷数 X > Y > Z
B. 气态氢化物稳定性 ZH3 > H2Y > HX
C. 元素的非金属性 X > Y > Z
D. 单质的氧化性 X > Y > Z 巩固提高B巩固提高3、下列递变情况正确的是:( )
A. Na、Mg、Al最外层电子数依次增多,其单质的还原性依次增强
B. P、S、Cl最高正价依次升高,对应气态氢化物稳定性增强
C. C、N、O原子半径依次增大
D. Na、K、Rb氧化物的水化物碱性依次增强BD你能试一试吗:
用实验证明氯气的活泼性比硫强——非金属性Si
