元素周期律[下学期]
图片预览







文档简介
课件25张PPT。伟大的化学家
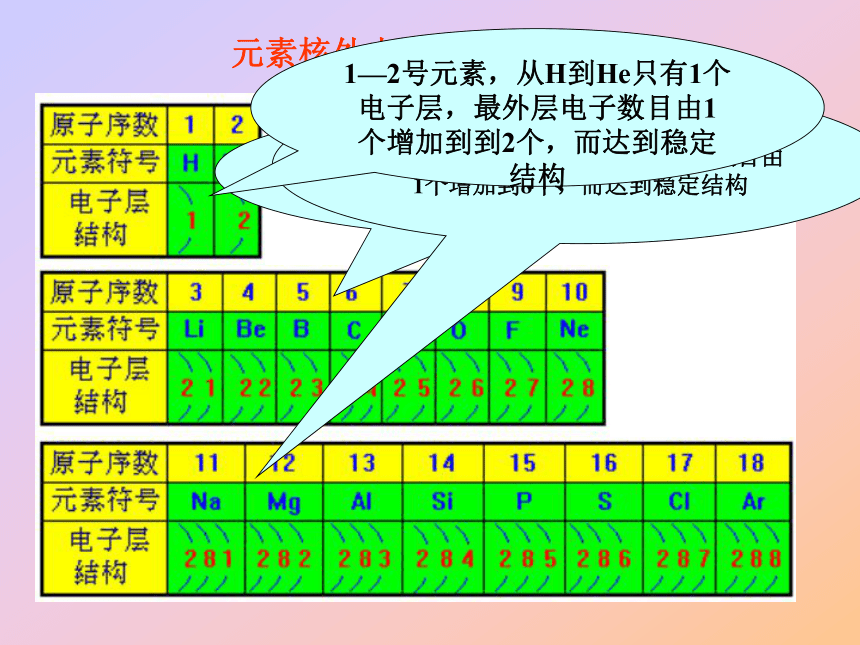
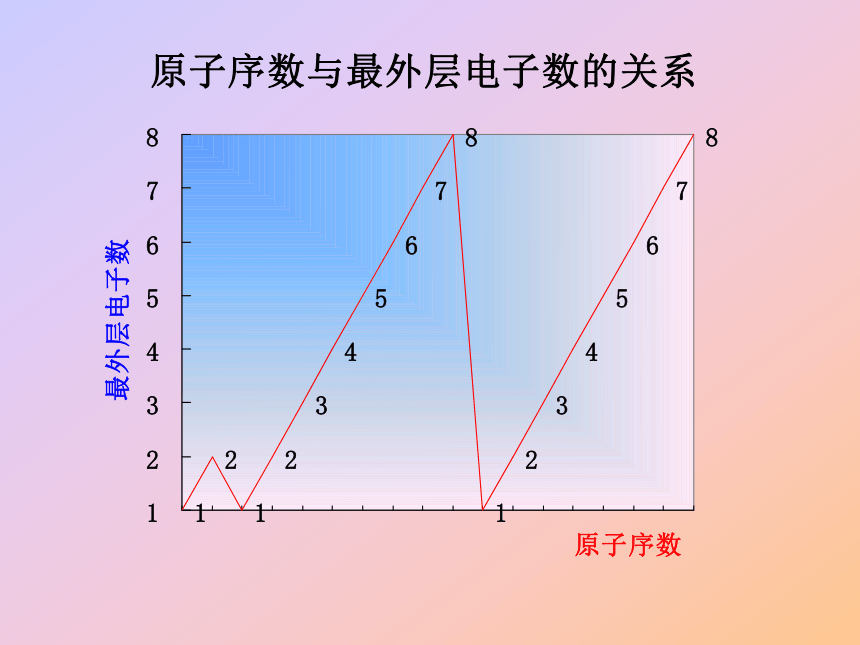
门捷列夫 元 素 周 期 律化学史话 1875年,法国化学家布瓦博德朗在分析闪锌矿时发现一种新元素,他将它命名为镓,并把测得的关于镓的主要性质公布了,不久,他收到门捷列夫的来信,门捷列夫在信中指出:关于镓的比重不应该是4.7,而是5.9—6.0,当时布瓦博德朗很疑惑,他是唯一手里掌握镓的人,门捷列夫怎么知道家镓的比重呢?1876年,布瓦博德朗重做实验,他将金属镓提纯,重新测定,结果镓的比重确定为5.94,这使他大为惊奇。 门捷列夫预言的依据是什么呢? 元素间到底存在什么样的内在联系和变化规律呢? 探究元素和化合物应从哪里入手? 通过对1~18号元素的原子结构示意图的比较,分析原子的核外电子层数和最外层电子数的变化有何规律﹖探究活动13—10号元素,从Li 到Ne有2个电子层,随原子序数的增大,最外层电子数目由1个增加到8个,而达到稳定结构11—18号元素,从Na 到Ar有3个电子层,随原子序数的增大,最外层电子数目由1个增加到8个,而达到稳定结构元素核外电子排布情况1—2号元素,从H到He只有1个电子层,最外层电子数目由1个增加到到2个,而达到稳定结构? 通过对3~9号和11~17号元素的原子半径的比较,请讨论分析,随着原子序数的递增,元素的原子半径有怎样的变化规律﹖探究活动2大→小大→小?深入探讨1 为什么3-9号和11-17号元素,原子半径出现从大到小的周期性变化?原子半径受哪些因素制约? 影响原
子半径
大小的
因素①电子层数:②核电荷数:核电荷数增多,使原子半径有减小的趋向③核外电子数: 电子数增多,增加了相互排斥,使原子
(最主要因素) ( 当电子层数相同时,核电荷数的影响较大)半径有增大的倾向。电子层数越多,原子半径越大【课堂练习】 1.下列元素的原子半径依次减小的是( )
A. Na、Mg、Al B. N、O、F
C. P、Si、Al D. C、Si、P2.下列各组微粒半径(r)之比大于1的是( )
A. rCl / rF B. rO/rF C. rMg/rNa D. rF/rCl 通过对1~18号元素的原子结构示意图的比较,分析元素的主要化合价(最高正价和最低负价)变化有何规律﹖探究活动3主要化合价1~18号元素?元素主要化合价的周期性变化深入探讨2 元素的主要化合价与最外层电子数有何关系?元素的最高正价等于最外层电子数;( 1~20号元素中,除了O、F外)
②氟无正价,氧无最高正价 。 最低负价与最高正价的关系为:
最高正价+ /最低负价/ = 8
3、下列元素的最高价氧化物或气态氢化物的化学式是正确的是( )
A.H2S B.SO2 C.P2O3 D.H2O2
4、下列元素的最高正化合价与最低负化合价绝对值的差等于6的是( )
A.N B.S C.F D.Cl【课堂练习】 随着核电荷数的递增,原子的核外电子排布、原子半径、元素的主要化合价都呈周期性的变化。结论: 知识小结:
1、理解原子核外电子排布、原子半径和主要化合价随着原 子序数递增而呈现的周期性变化。 2、学会微粒半径大小的比较方法。能力小结:
1、学会观察、分析、归纳总结的能力。
2、掌握用事实和数据分析、总结规律、透过现象看本质的科学方法。方法小结:
1、学会用探究法去研究问题。
2、学会通过表格和函数图象来分析数据得出结论。思考:1、如何比较元素的金属性和非金属性的强弱,并设计实验验证元素的金属性和非金属性的强弱,写出实验方案。谢谢指导! !温岭二中 江优瑾
门捷列夫 元 素 周 期 律化学史话 1875年,法国化学家布瓦博德朗在分析闪锌矿时发现一种新元素,他将它命名为镓,并把测得的关于镓的主要性质公布了,不久,他收到门捷列夫的来信,门捷列夫在信中指出:关于镓的比重不应该是4.7,而是5.9—6.0,当时布瓦博德朗很疑惑,他是唯一手里掌握镓的人,门捷列夫怎么知道家镓的比重呢?1876年,布瓦博德朗重做实验,他将金属镓提纯,重新测定,结果镓的比重确定为5.94,这使他大为惊奇。 门捷列夫预言的依据是什么呢? 元素间到底存在什么样的内在联系和变化规律呢? 探究元素和化合物应从哪里入手? 通过对1~18号元素的原子结构示意图的比较,分析原子的核外电子层数和最外层电子数的变化有何规律﹖探究活动13—10号元素,从Li 到Ne有2个电子层,随原子序数的增大,最外层电子数目由1个增加到8个,而达到稳定结构11—18号元素,从Na 到Ar有3个电子层,随原子序数的增大,最外层电子数目由1个增加到8个,而达到稳定结构元素核外电子排布情况1—2号元素,从H到He只有1个电子层,最外层电子数目由1个增加到到2个,而达到稳定结构? 通过对3~9号和11~17号元素的原子半径的比较,请讨论分析,随着原子序数的递增,元素的原子半径有怎样的变化规律﹖探究活动2大→小大→小?深入探讨1 为什么3-9号和11-17号元素,原子半径出现从大到小的周期性变化?原子半径受哪些因素制约? 影响原
子半径
大小的
因素①电子层数:②核电荷数:核电荷数增多,使原子半径有减小的趋向③核外电子数: 电子数增多,增加了相互排斥,使原子
(最主要因素) ( 当电子层数相同时,核电荷数的影响较大)半径有增大的倾向。电子层数越多,原子半径越大【课堂练习】 1.下列元素的原子半径依次减小的是( )
A. Na、Mg、Al B. N、O、F
C. P、Si、Al D. C、Si、P2.下列各组微粒半径(r)之比大于1的是( )
A. rCl / rF B. rO/rF C. rMg/rNa D. rF/rCl 通过对1~18号元素的原子结构示意图的比较,分析元素的主要化合价(最高正价和最低负价)变化有何规律﹖探究活动3主要化合价1~18号元素?元素主要化合价的周期性变化深入探讨2 元素的主要化合价与最外层电子数有何关系?元素的最高正价等于最外层电子数;( 1~20号元素中,除了O、F外)
②氟无正价,氧无最高正价 。 最低负价与最高正价的关系为:
最高正价+ /最低负价/ = 8
3、下列元素的最高价氧化物或气态氢化物的化学式是正确的是( )
A.H2S B.SO2 C.P2O3 D.H2O2
4、下列元素的最高正化合价与最低负化合价绝对值的差等于6的是( )
A.N B.S C.F D.Cl【课堂练习】 随着核电荷数的递增,原子的核外电子排布、原子半径、元素的主要化合价都呈周期性的变化。结论: 知识小结:
1、理解原子核外电子排布、原子半径和主要化合价随着原 子序数递增而呈现的周期性变化。 2、学会微粒半径大小的比较方法。能力小结:
1、学会观察、分析、归纳总结的能力。
2、掌握用事实和数据分析、总结规律、透过现象看本质的科学方法。方法小结:
1、学会用探究法去研究问题。
2、学会通过表格和函数图象来分析数据得出结论。思考:1、如何比较元素的金属性和非金属性的强弱,并设计实验验证元素的金属性和非金属性的强弱,写出实验方案。谢谢指导! !温岭二中 江优瑾
