元素周期律[下学期]
图片预览




文档简介
课件27张PPT。 第一单元 核外电子排布与周期律元 素 周 期 律《镓的故事》 化学史话 1875年法国化学家布瓦博德朗发现了镓,并把
测得的关于镓的主要性质公布了。不久收到了俄国
化学家门捷列夫的来信,指出镓的比重不应该是4.7,
而是5.9-6.0…… 第二年他重新测定,结果镓的比重
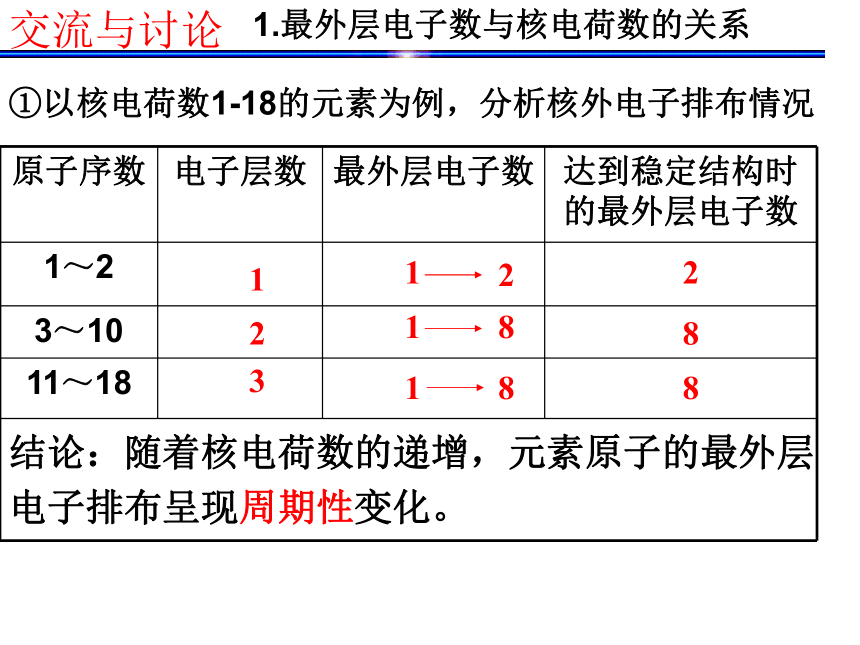
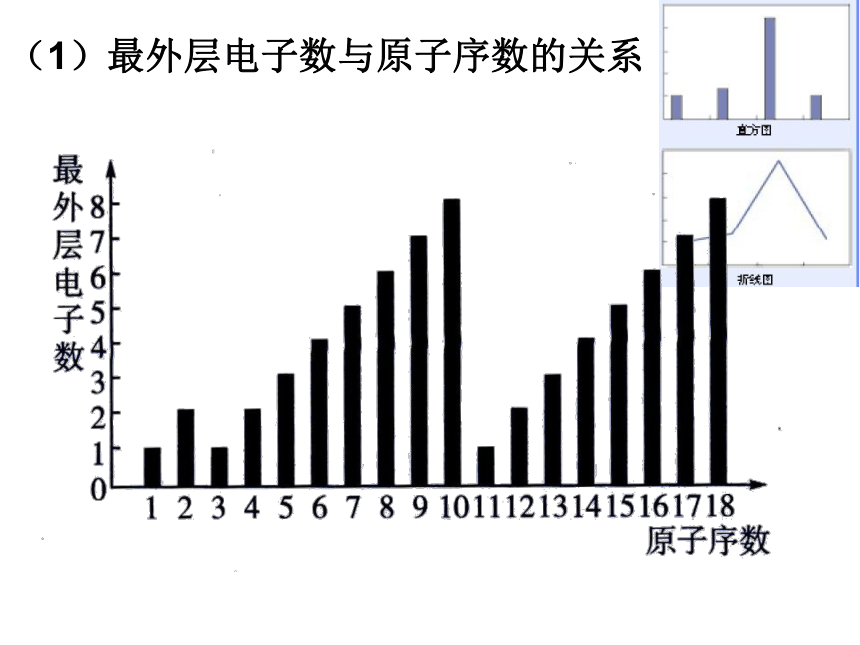
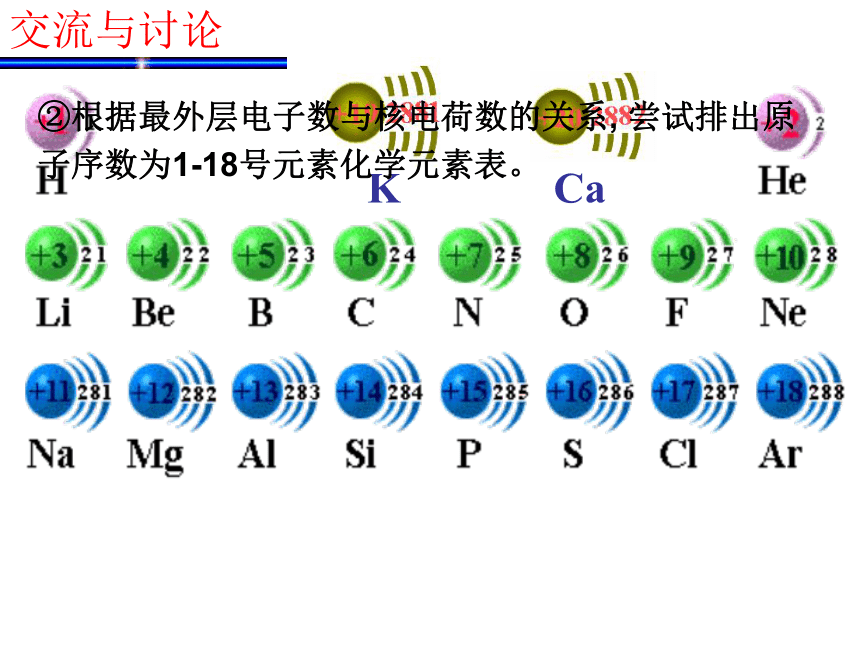
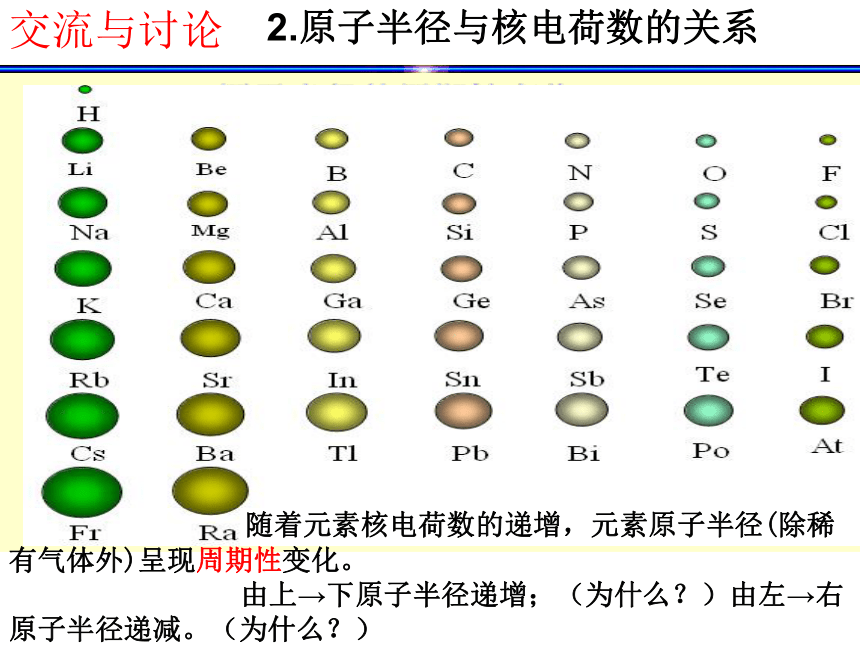
确实为5.94。 门捷列夫预言的依据是什么呢? 1.最外层电子数与核电荷数的关系123288①以核电荷数1-18的元素为例,分析核外电子排布情况 交流与讨论结论:随着核电荷数的递增,元素原子的最外层
电子排布呈现周期性变化。(1)最外层电子数与原子序数的关系KCa②根据最外层电子数与核电荷数的关系, 尝试排出原子序数为1-18号元素化学元素表。交流与讨论 请画出原子半径、主要化合价与核电荷数的关系曲线,并得出结论。交流与讨论2.原子半径与核电荷数的关系 随着元素核电荷数的递增,元素原子半径(除稀有气体外)呈现周期性变化。
由上→下原子半径递增;(为什么?)由左→右原子半径递减。(为什么?)交流与讨论
⑷ 对于同种元素:
①阴离子半径 > 原子半径 > 阳离子半径
②阳离子所带正电荷数越多,则离子半径______
③阴离子所带负电荷数越多,则离子半径______变小增大越小越小越大。⑴一般情况下,电子层数相同时,随着核电荷数的递增,
原子半径逐渐_____⑵一般情况下,最外层电子数相同时,随着核电荷数的递
增, 原子半径逐渐____⑶ 对于电子层结构相同的离子,核电荷数越大,则离子半
径____一:微粒半径大小比较规律练习1:1.下列各组微粒半径大小比较中,不正确的是( )
r(K) > r(Na) > r(Li)
r(Mg2+) > r(Na+) > r(F-)
r(Na+) > r(Mg2+) > r(Al3+)
R(Cl -) > r(F-) > r(F)2.下列各组微粒,半径由小到大的顺序排列的是( )
Mg2+ 、 Na+ 、 K+
S2- 、 O2- 、 F-
Al 、Si 、P
B 、C 、NBA结论:随着核电荷数的递增,元素化合价呈现
周期性变化。 3. 主要化合价与核电荷数的关系① 分析主要化合价与核电荷数的关系交流与讨论3. 主要化合价与核电荷数的关系②寻求原子序数为11~17的元素的最高化合价和最低化合价的数值与原子核外最外层电子数的关系最高正价数=原子核外最外层电子数最低负化合价的绝对值=8-原子核外最外层电子数11~17号元素:交流与讨论③元素化合价与原子序数的关系二:常见元素化合价的一般规律①1~20号元素中,除了O、F外,
元素的最高正价等于最外层电子数;
最低负价与最高正价的关系为:
最高正价+ /最低负价/ = 8{②金属元素无负价(除零价外,在化学反应中只显正价);
既有正价又有负价的元素一定是非金属元素;③氟无正价,氧无最高正价 。三:元素的金属性和非金属性的判断 1:金属性及其判定
(1):金属性和金属活动性的区别。
金属性——金属气态原子失去电子能力的性质;
金属活动性——水溶液中,金属原子失去电子能力的性质;
二者顺序基本上一致,极少数例外,如:Sn、Pb。 活动与探究 通过实验1、2、3和分析表1- 4、1- 5归纳元素金属性和非金属性?NaOH 强碱Mg(OH)2中强碱Al(OH)3
?金属性 Na > Mg > AlAl(OH)3两性氢氧化物NaOH 强碱Mg(OH)2中强碱金属性 Na > Mg > Al金属性 Na > Mg > Al (2)金属性强弱的比较 根据原子结构:原子半径(电子层数)越大,最外层电子数越少。金属性越强,反之则越弱。
根据周期表中的位置:同周期中,从左到右,随原子序数增加,金属性减弱;同主族中,由上到下,随原子序数增加,金属性增强;最强的金属为Cs。
根据实验:
A:跟水或酸反应置换氢的难易。越易者金属性越强。
B:最高价氧化物的水化物碱性强弱。碱性越强者金属性越强。
C:根据金属活动性顺序表(极少数例外)。
D:与盐溶液的置换反应。
2.非金属性及其判定 (1) 、元素的非金属性和非金属单质的活泼性的区别:
非金属性:指非金属原子得电子能力的性质。
非金属单质的活泼性:指单质分子与其他物质反应的难易。
二者不一定一致,如非金属性N>P,而单质活泼性N2 ②、根据周期表中的位置:
同周期中,从左至右,随原子序数增加、非金属性增强。
同主族中,由上到下,随原子序数增加非金属性减弱。最强的非金属为F。
③根据实验:
a.与氢气化合的难易及氢化物的稳定性。越易越稳定者非金属性越强。
b.最高价氧化物的水化物酸性强弱,越强者非金属性越强。
c.与盐溶液之间的置换反应。
d.与同种金属反应的难易。如:2Cu+S==Cu2S、Cu+Cl2==CuCl2。
高温光照或点燃爆炸化合磷蒸气加热稀有气体元素金属性逐渐减弱,非金属性逐渐增强金属性逐渐减弱,非金属性逐渐增强练习2: X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是( )
A:x原子的电子层数比Y原子的电子层数多
B:x的氢化物的沸点比Y的氢化物的沸点低
C:x的气态氢化物比Y的气态氢化物稳定
D:Y的单质能将X从NaX的溶液中置换出来C四:元素周期律1、概念:
元素性质随着原子序数的递增而呈现周期性变化的规律。
2、元素性质的周期性变化具体表现:
(1)、核外电子排布的周期性变化规律;
(2)、主要化合价的周期性变化规律;
(3)、金属性和非金属性的周期性变化规律;
(4)、原子半径的周期性变化规律。
讨论:元素周期律的实质是什么?
元素周期律是元素原子的核外电子排布呈周期性变化的必然结果。
练习3: 同周期的X、Y、Z三种元素,已知如下关系HXO4 ,H2YO4,H3ZO4的酸性依次减弱,则下列判断正确的是( )
A:原子半径X最大,Z最小
B:非金属性X最强,Z最弱
C:气态氢化物中HX最不稳定
D:三种元素的原子得电子形成离子X-、Y2-、Z3-时,放出的能量Z最小BD巩固练习4:原子序数为1-18的元素,随着核电荷数的递增
不呈周期性变化的是( )
(A)相对原子质量 (B)主要化合价
(C)原子半径 (D)电子层数AD5:下列各组元素递变情况错误的是 ( )
(A)Li、Be、B 原子最外层电子数依次增多
(B) P、S、Cl 元素最高正化合价依次升高
(C)B、C、N、O、F原子半径依次增大
(D)Li、Na、K、Rb的金属性依次增强C6.下列元素的原子半径依次减小的是( )
A. Na、Mg、Al B. N、O、F
C. P、Si、Al D. C、Si、Na7.下列有关元素周期律的叙述,正确的是( )
A. 元素周期律的本质是元素原子核外电子排布呈周期性变化
B. 元素周期律的本质是原子半径呈周期性变化
C. 元素周期律的本质是元素的性质随原子序数的递增呈周期性变化
D. 元素周期律的本质是元素的性质随原子量的递增而呈周期性变化ABA巩固练习
测得的关于镓的主要性质公布了。不久收到了俄国
化学家门捷列夫的来信,指出镓的比重不应该是4.7,
而是5.9-6.0…… 第二年他重新测定,结果镓的比重
确实为5.94。 门捷列夫预言的依据是什么呢? 1.最外层电子数与核电荷数的关系123288①以核电荷数1-18的元素为例,分析核外电子排布情况 交流与讨论结论:随着核电荷数的递增,元素原子的最外层
电子排布呈现周期性变化。(1)最外层电子数与原子序数的关系KCa②根据最外层电子数与核电荷数的关系, 尝试排出原子序数为1-18号元素化学元素表。交流与讨论 请画出原子半径、主要化合价与核电荷数的关系曲线,并得出结论。交流与讨论2.原子半径与核电荷数的关系 随着元素核电荷数的递增,元素原子半径(除稀有气体外)呈现周期性变化。
由上→下原子半径递增;(为什么?)由左→右原子半径递减。(为什么?)交流与讨论
⑷ 对于同种元素:
①阴离子半径 > 原子半径 > 阳离子半径
②阳离子所带正电荷数越多,则离子半径______
③阴离子所带负电荷数越多,则离子半径______变小增大越小越小越大。⑴一般情况下,电子层数相同时,随着核电荷数的递增,
原子半径逐渐_____⑵一般情况下,最外层电子数相同时,随着核电荷数的递
增, 原子半径逐渐____⑶ 对于电子层结构相同的离子,核电荷数越大,则离子半
径____一:微粒半径大小比较规律练习1:1.下列各组微粒半径大小比较中,不正确的是( )
r(K) > r(Na) > r(Li)
r(Mg2+) > r(Na+) > r(F-)
r(Na+) > r(Mg2+) > r(Al3+)
R(Cl -) > r(F-) > r(F)2.下列各组微粒,半径由小到大的顺序排列的是( )
Mg2+ 、 Na+ 、 K+
S2- 、 O2- 、 F-
Al 、Si 、P
B 、C 、NBA结论:随着核电荷数的递增,元素化合价呈现
周期性变化。 3. 主要化合价与核电荷数的关系① 分析主要化合价与核电荷数的关系交流与讨论3. 主要化合价与核电荷数的关系②寻求原子序数为11~17的元素的最高化合价和最低化合价的数值与原子核外最外层电子数的关系最高正价数=原子核外最外层电子数最低负化合价的绝对值=8-原子核外最外层电子数11~17号元素:交流与讨论③元素化合价与原子序数的关系二:常见元素化合价的一般规律①1~20号元素中,除了O、F外,
元素的最高正价等于最外层电子数;
最低负价与最高正价的关系为:
最高正价+ /最低负价/ = 8{②金属元素无负价(除零价外,在化学反应中只显正价);
既有正价又有负价的元素一定是非金属元素;③氟无正价,氧无最高正价 。三:元素的金属性和非金属性的判断 1:金属性及其判定
(1):金属性和金属活动性的区别。
金属性——金属气态原子失去电子能力的性质;
金属活动性——水溶液中,金属原子失去电子能力的性质;
二者顺序基本上一致,极少数例外,如:Sn、Pb。 活动与探究 通过实验1、2、3和分析表1- 4、1- 5归纳元素金属性和非金属性?NaOH 强碱Mg(OH)2中强碱Al(OH)3
?金属性 Na > Mg > AlAl(OH)3两性氢氧化物NaOH 强碱Mg(OH)2中强碱金属性 Na > Mg > Al金属性 Na > Mg > Al (2)金属性强弱的比较 根据原子结构:原子半径(电子层数)越大,最外层电子数越少。金属性越强,反之则越弱。
根据周期表中的位置:同周期中,从左到右,随原子序数增加,金属性减弱;同主族中,由上到下,随原子序数增加,金属性增强;最强的金属为Cs。
根据实验:
A:跟水或酸反应置换氢的难易。越易者金属性越强。
B:最高价氧化物的水化物碱性强弱。碱性越强者金属性越强。
C:根据金属活动性顺序表(极少数例外)。
D:与盐溶液的置换反应。
2.非金属性及其判定 (1) 、元素的非金属性和非金属单质的活泼性的区别:
非金属性:指非金属原子得电子能力的性质。
非金属单质的活泼性:指单质分子与其他物质反应的难易。
二者不一定一致,如非金属性N>P,而单质活泼性N2
同周期中,从左至右,随原子序数增加、非金属性增强。
同主族中,由上到下,随原子序数增加非金属性减弱。最强的非金属为F。
③根据实验:
a.与氢气化合的难易及氢化物的稳定性。越易越稳定者非金属性越强。
b.最高价氧化物的水化物酸性强弱,越强者非金属性越强。
c.与盐溶液之间的置换反应。
d.与同种金属反应的难易。如:2Cu+S==Cu2S、Cu+Cl2==CuCl2。
高温光照或点燃爆炸化合磷蒸气加热稀有气体元素金属性逐渐减弱,非金属性逐渐增强金属性逐渐减弱,非金属性逐渐增强练习2: X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是( )
A:x原子的电子层数比Y原子的电子层数多
B:x的氢化物的沸点比Y的氢化物的沸点低
C:x的气态氢化物比Y的气态氢化物稳定
D:Y的单质能将X从NaX的溶液中置换出来C四:元素周期律1、概念:
元素性质随着原子序数的递增而呈现周期性变化的规律。
2、元素性质的周期性变化具体表现:
(1)、核外电子排布的周期性变化规律;
(2)、主要化合价的周期性变化规律;
(3)、金属性和非金属性的周期性变化规律;
(4)、原子半径的周期性变化规律。
讨论:元素周期律的实质是什么?
元素周期律是元素原子的核外电子排布呈周期性变化的必然结果。
练习3: 同周期的X、Y、Z三种元素,已知如下关系HXO4 ,H2YO4,H3ZO4的酸性依次减弱,则下列判断正确的是( )
A:原子半径X最大,Z最小
B:非金属性X最强,Z最弱
C:气态氢化物中HX最不稳定
D:三种元素的原子得电子形成离子X-、Y2-、Z3-时,放出的能量Z最小BD巩固练习4:原子序数为1-18的元素,随着核电荷数的递增
不呈周期性变化的是( )
(A)相对原子质量 (B)主要化合价
(C)原子半径 (D)电子层数AD5:下列各组元素递变情况错误的是 ( )
(A)Li、Be、B 原子最外层电子数依次增多
(B) P、S、Cl 元素最高正化合价依次升高
(C)B、C、N、O、F原子半径依次增大
(D)Li、Na、K、Rb的金属性依次增强C6.下列元素的原子半径依次减小的是( )
A. Na、Mg、Al B. N、O、F
C. P、Si、Al D. C、Si、Na7.下列有关元素周期律的叙述,正确的是( )
A. 元素周期律的本质是元素原子核外电子排布呈周期性变化
B. 元素周期律的本质是原子半径呈周期性变化
C. 元素周期律的本质是元素的性质随原子序数的递增呈周期性变化
D. 元素周期律的本质是元素的性质随原子量的递增而呈周期性变化ABA巩固练习
