元素周期律[下学期]
图片预览

文档简介
元素周期律学案(第I 课时)
[课前准备]
画出核电荷数为1~18的元素原子结构示意图。(分三行,1、2号元素一行,3~10为一行,11~18为一行)
[教学过程]
[探究活动1]
1、仔细观察预习作业,讨论后总结规律如下表1:
原子序数 电子层数 最外层电子数 达到稳定结构时最外层电子数
1~2
3~10
11~18
结论:随着核电荷数的增加,原子的最外层电子排布呈 变化。
2、画出函数图象(横坐标---原子序数,纵坐标---原子的最外层电子数)
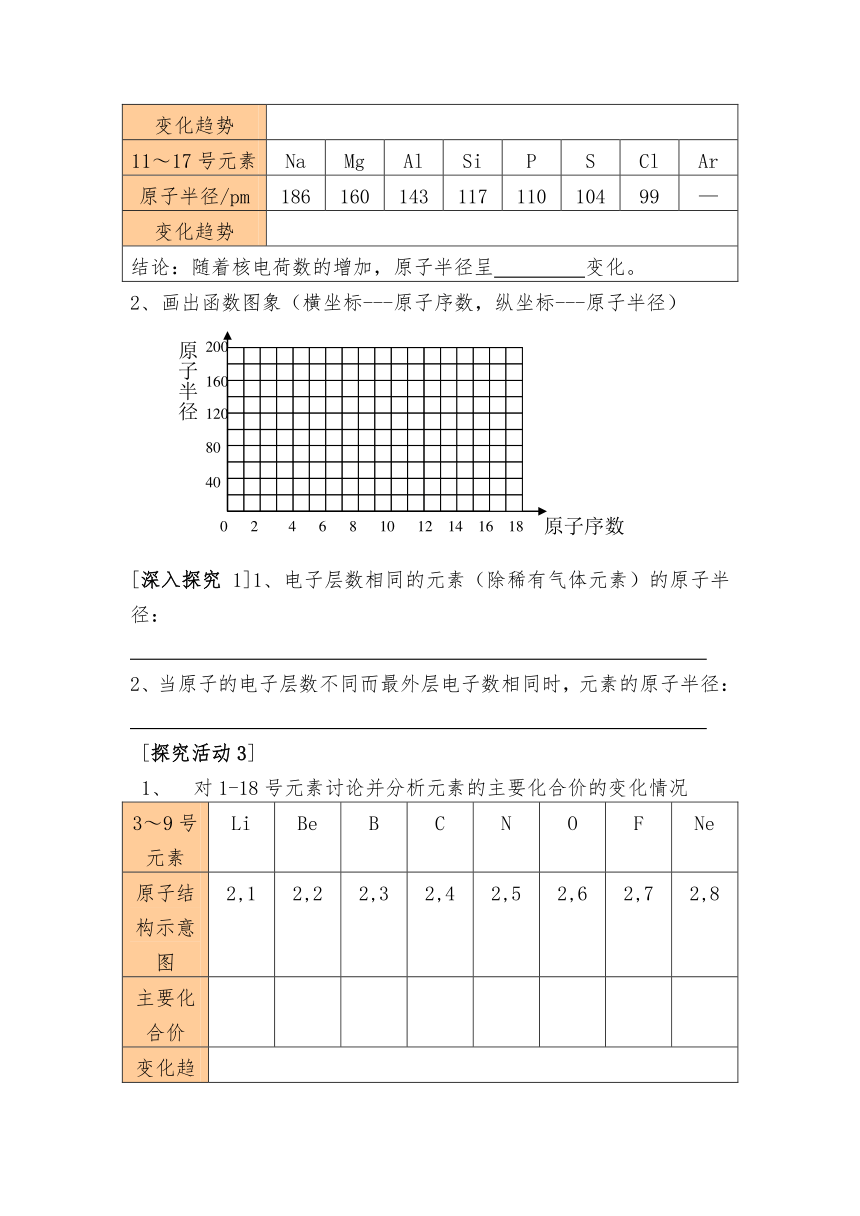
[探究活动2] 仔细观察所给表格,完成表2的填空;并请相互讨论随着元素核电荷数的递增,元素的原子半径变化有何规律,总结如下。
3~9号元素 Li Be B C N O F Ne
原子半径/pm 152 111 88 77 70 66 64 —
变化趋势
11~17号元素 Na Mg Al Si P S Cl Ar
原子半径/pm 186 160 143 117 110 104 99 —
变化趋势
结论:随着核电荷数的增加,原子半径呈 变化。
2、画出函数图象(横坐标---原子序数,纵坐标---原子半径)
[深入探究1]1、电子层数相同的元素(除稀有气体元素)的原子半径:
2、当原子的电子层数不同而最外层电子数相同时,元素的原子半径:
[探究活动3]
1、 对1-18号元素讨论并分析元素的主要化合价的变化情况
3~9号元素 Li Be B C N O F Ne
原子结构示意图 2,1 2,2 2,3 2,4 2,5 2,6 2,7 2,8
主要化合价
变化趋势
11~17号元素 Na Mg Al Si P S Cl Ar
原子结构示意图 2,8,1 2,8,2 2,8,3 2,8,4 2,8,5 2,8,6 2,8,7 2,8,8
主要化合价
变化趋势
结论:随着核电荷数的增加,元素的主要化合价呈 变化。
2、画出函数图象(横坐标---原子序数,纵坐标---元素的主要化合价)
[深入探究2](1)、原子序数为11~17的元素的最高化合价和最低化合价的变化规律是 。
(2)、序数为11~17的元素的最高化合价和最低化合价的数值与原子核外最外层电子数的关系是 。
[思考] 1、如何比较元素的金属性和非金属性的强弱,并设计实验验证元素的金属性和非金属性的强弱。
[反馈练习]
1、原子序数为1~18的元素,随着核电荷数的递增而呈现周期性变化的是( )
A.电子层数 B.核外电子数 C.原子半径 D.最外层电子数
2、下列元素中,原子半径最大的是( )
A.锂 B.钠 C.氟 D.氯
3、下列各组元素性质递变情况错误的是( )
A.Li、Be、B原子最外层电子数依次升高
B.P、S、Cl元素最高正化合价依次升高
C.B、C、N、O、F原 子半径依次升高
D.Li、Na、K的原子半径依次增大
4、一般来说,非金属元素R的原子最外层电子数为N,则这种元素的最高正化合价为 ,最低负化合价为 。
5、填写下列空白:
(1)原子种类由 决定。
(2)元素种类由 决定。
(3)原子的质量主要集中在 上。
(4)原子的质量数= +
(5)1~18号元素的化合价主要由 决定。
6、某元素原子核外有3个电子层,该元素最高正化合价与最低负化合价绝对值相等,则这种元素的名称是 ,元素符号为 ,最高价氧化物的化学式为 ,气态氢化物的化学式为 。
原子序数
0 2 4 6 8 10 12 14 16 18
8
6
4
2
最外层电子数
原子序数
0 2 4 6 8 10 12 14 16 18
原子半径
200
120
80
40
0 2 4 6 8 10 12 14 16 18
原子序数
元素的主要化合价
8
6
4
2
-2
-4
160
[课前准备]
画出核电荷数为1~18的元素原子结构示意图。(分三行,1、2号元素一行,3~10为一行,11~18为一行)
[教学过程]
[探究活动1]
1、仔细观察预习作业,讨论后总结规律如下表1:
原子序数 电子层数 最外层电子数 达到稳定结构时最外层电子数
1~2
3~10
11~18
结论:随着核电荷数的增加,原子的最外层电子排布呈 变化。
2、画出函数图象(横坐标---原子序数,纵坐标---原子的最外层电子数)
[探究活动2] 仔细观察所给表格,完成表2的填空;并请相互讨论随着元素核电荷数的递增,元素的原子半径变化有何规律,总结如下。
3~9号元素 Li Be B C N O F Ne
原子半径/pm 152 111 88 77 70 66 64 —
变化趋势
11~17号元素 Na Mg Al Si P S Cl Ar
原子半径/pm 186 160 143 117 110 104 99 —
变化趋势
结论:随着核电荷数的增加,原子半径呈 变化。
2、画出函数图象(横坐标---原子序数,纵坐标---原子半径)
[深入探究1]1、电子层数相同的元素(除稀有气体元素)的原子半径:
2、当原子的电子层数不同而最外层电子数相同时,元素的原子半径:
[探究活动3]
1、 对1-18号元素讨论并分析元素的主要化合价的变化情况
3~9号元素 Li Be B C N O F Ne
原子结构示意图 2,1 2,2 2,3 2,4 2,5 2,6 2,7 2,8
主要化合价
变化趋势
11~17号元素 Na Mg Al Si P S Cl Ar
原子结构示意图 2,8,1 2,8,2 2,8,3 2,8,4 2,8,5 2,8,6 2,8,7 2,8,8
主要化合价
变化趋势
结论:随着核电荷数的增加,元素的主要化合价呈 变化。
2、画出函数图象(横坐标---原子序数,纵坐标---元素的主要化合价)
[深入探究2](1)、原子序数为11~17的元素的最高化合价和最低化合价的变化规律是 。
(2)、序数为11~17的元素的最高化合价和最低化合价的数值与原子核外最外层电子数的关系是 。
[思考] 1、如何比较元素的金属性和非金属性的强弱,并设计实验验证元素的金属性和非金属性的强弱。
[反馈练习]
1、原子序数为1~18的元素,随着核电荷数的递增而呈现周期性变化的是( )
A.电子层数 B.核外电子数 C.原子半径 D.最外层电子数
2、下列元素中,原子半径最大的是( )
A.锂 B.钠 C.氟 D.氯
3、下列各组元素性质递变情况错误的是( )
A.Li、Be、B原子最外层电子数依次升高
B.P、S、Cl元素最高正化合价依次升高
C.B、C、N、O、F原 子半径依次升高
D.Li、Na、K的原子半径依次增大
4、一般来说,非金属元素R的原子最外层电子数为N,则这种元素的最高正化合价为 ,最低负化合价为 。
5、填写下列空白:
(1)原子种类由 决定。
(2)元素种类由 决定。
(3)原子的质量主要集中在 上。
(4)原子的质量数= +
(5)1~18号元素的化合价主要由 决定。
6、某元素原子核外有3个电子层,该元素最高正化合价与最低负化合价绝对值相等,则这种元素的名称是 ,元素符号为 ,最高价氧化物的化学式为 ,气态氢化物的化学式为 。
原子序数
0 2 4 6 8 10 12 14 16 18
8
6
4
2
最外层电子数
原子序数
0 2 4 6 8 10 12 14 16 18
原子半径
200
120
80
40
0 2 4 6 8 10 12 14 16 18
原子序数
元素的主要化合价
8
6
4
2
-2
-4
160
