元素周期表二[下学期]
图片预览





文档简介
课件17张PPT。元素的性质与原子结构1、碱金属元素学习目的
深刻理解和掌握元素性质与
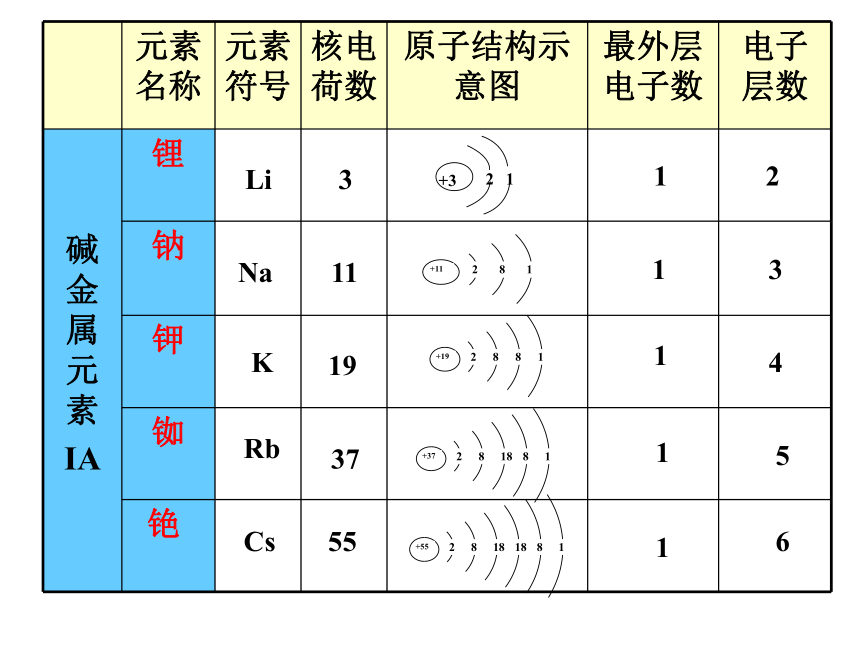
原子结构的关系Li312Na1113K1914Rb3715Cs5516思考:由表格你能发现碱金属元素的
原子结构有什么异同?同:异:原子的最外层电子数都为1随着核电荷数的增加,原子的电子层数递增探讨元素的性质讨论:钠能与氧气、氯气、水反应生成+1价的钠离子,那么锂、钾、铷和铯能与以上物质反应吗?实验:钾和钠分别和水及和氧气反应 钠与氧气反应 钾与氧气反应 钠与水反应 钾与水反应实验现象及结论:在空气中,钾和钠都能燃烧,
但钾比钠燃烧更剧烈在常温的水中,钾和钠都能与水反应,
但钾比钠反应更剧烈 比较上面反应的异同: 钠、钾与氧气反应的比较钠、钾、铷、铯与水反应的比较 1、它们化学性质为什么会相似呢?思
考:最外层电子数相同决定化学性质相似Li
Na
K
Rb
Cs核电荷数增加电子层数增多原子半径增大决定原子核对核外电子
的吸引力逐渐减弱失电子能力逐渐增强 还原性逐渐增强
金属性逐渐增强2、它们化学反应虽相似,但与水、氧气反应的剧烈程度却不同,又为什么呢?联想1:总结1:结构相似,性质相似在元素周期表的同一纵行中,
各原子的最外层电子数都相同,
即结构都相似,性质也相似。引申1:同一族中各元素的化学性质都相似总结2:引申2:结构递变,性质递变在元素周期表的同一纵行中,各原子由上而下原子的电子层数增多,原子核对最外层电子数的吸引能力逐渐减弱,失电子能力逐渐增强,故同一纵行由上而下,金属性逐渐增强。联想2: 在同一族中,由上而下,各原子的
金属性逐渐增强.以上这些是碱金属的化学性质的对比,
那么它们的物理性质又有何种相似性
和递变性?小知识:
金属性指的是金属的还原性;
比较金属性强弱的方法有….1、单质跟水(或酸)反应置换出氢的难易程度。2、最高价氧化物的水化物—氢氧化物 的碱性强弱。3、置换反应总结同一主族的元素同:异:最外层电子数相同结构相似性质相似随着核电荷数增多,电子
层数也递增,半径增大结构递变性质递变同一主族的元素,随着核电荷数增多,
金属性逐渐增强,非金属性逐渐减弱。
深刻理解和掌握元素性质与
原子结构的关系Li312Na1113K1914Rb3715Cs5516思考:由表格你能发现碱金属元素的
原子结构有什么异同?同:异:原子的最外层电子数都为1随着核电荷数的增加,原子的电子层数递增探讨元素的性质讨论:钠能与氧气、氯气、水反应生成+1价的钠离子,那么锂、钾、铷和铯能与以上物质反应吗?实验:钾和钠分别和水及和氧气反应 钠与氧气反应 钾与氧气反应 钠与水反应 钾与水反应实验现象及结论:在空气中,钾和钠都能燃烧,
但钾比钠燃烧更剧烈在常温的水中,钾和钠都能与水反应,
但钾比钠反应更剧烈 比较上面反应的异同: 钠、钾与氧气反应的比较钠、钾、铷、铯与水反应的比较 1、它们化学性质为什么会相似呢?思
考:最外层电子数相同决定化学性质相似Li
Na
K
Rb
Cs核电荷数增加电子层数增多原子半径增大决定原子核对核外电子
的吸引力逐渐减弱失电子能力逐渐增强 还原性逐渐增强
金属性逐渐增强2、它们化学反应虽相似,但与水、氧气反应的剧烈程度却不同,又为什么呢?联想1:总结1:结构相似,性质相似在元素周期表的同一纵行中,
各原子的最外层电子数都相同,
即结构都相似,性质也相似。引申1:同一族中各元素的化学性质都相似总结2:引申2:结构递变,性质递变在元素周期表的同一纵行中,各原子由上而下原子的电子层数增多,原子核对最外层电子数的吸引能力逐渐减弱,失电子能力逐渐增强,故同一纵行由上而下,金属性逐渐增强。联想2: 在同一族中,由上而下,各原子的
金属性逐渐增强.以上这些是碱金属的化学性质的对比,
那么它们的物理性质又有何种相似性
和递变性?小知识:
金属性指的是金属的还原性;
比较金属性强弱的方法有….1、单质跟水(或酸)反应置换出氢的难易程度。2、最高价氧化物的水化物—氢氧化物 的碱性强弱。3、置换反应总结同一主族的元素同:异:最外层电子数相同结构相似性质相似随着核电荷数增多,电子
层数也递增,半径增大结构递变性质递变同一主族的元素,随着核电荷数增多,
金属性逐渐增强,非金属性逐渐减弱。
