元素周期表及其应用[下学期]
图片预览




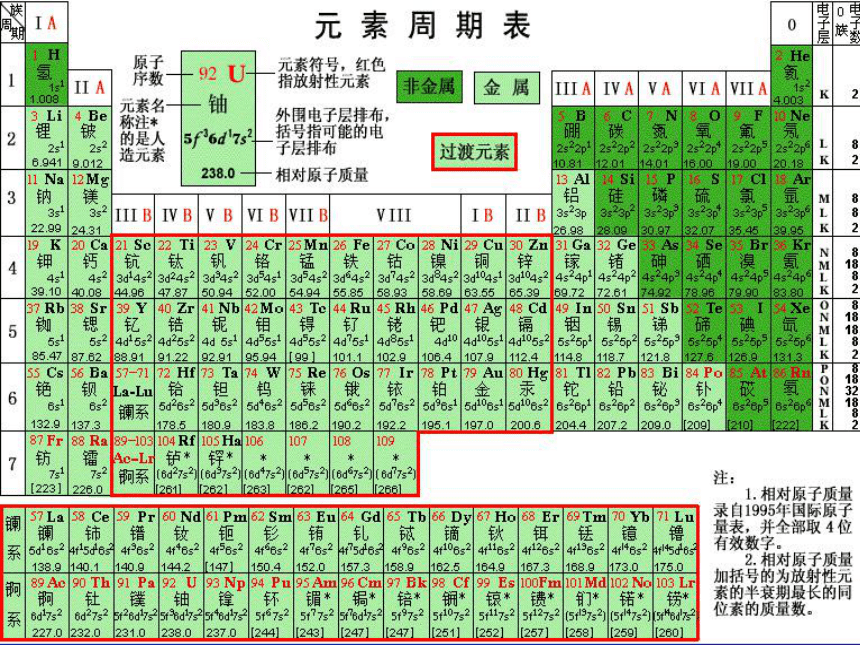
文档简介
课件21张PPT。第一单元第三课元素周期表及其应用元素周期表编制主要历史年表1829年德国贝德莱纳提出“三元素组”
1862年法国尚古多绘出“螺旋图”
1864年德国迈尔列出“六元素表”
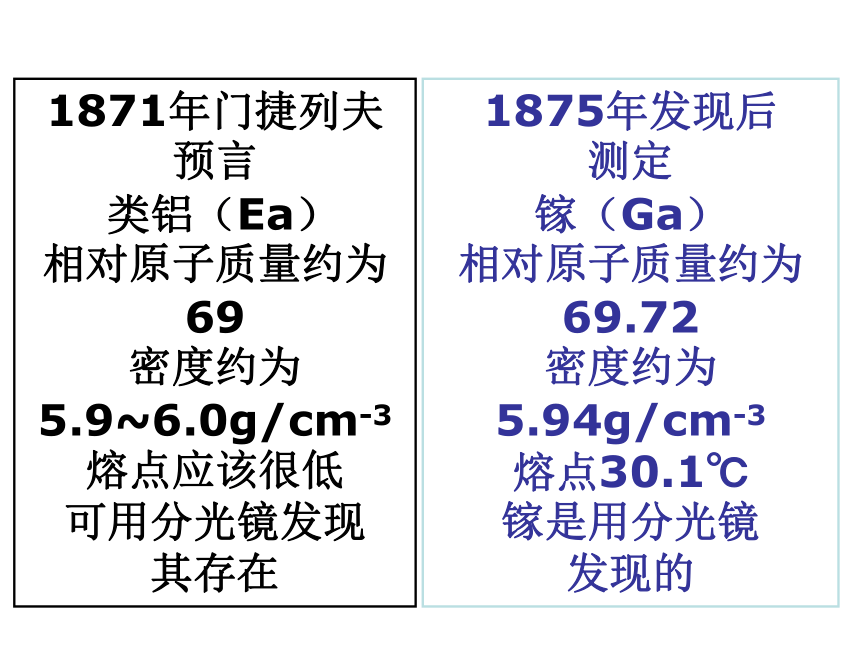
1865年英国纽兰兹排出“八音律” 1869年门捷列夫提出元素周期律,发表了第一张周期律的图表,1871年由竖排改为横排发表了第二张周期律图表,并预言当时尚未被发现元素的性质和存在,并留下了空位。1869年 门捷列夫发表的第一张元素周期表1871年门捷列夫
预言
类铝(Ea)
相对原子质量约为69
密度约为5.9~6.0g/cm-3
熔点应该很低
可用分光镜发现
其存在1875年发现后
测定
镓(Ga)
相对原子质量约为69.72
密度约为5.94g/cm-3
熔点30.1℃
镓是用分光镜
发现的思考1: 阅读元素周期表,思考交流以下问题:
1、元素周期表有几行几列?
2、什么叫周期?什么叫族?
3、有几种类型的族?族是如何排列的?
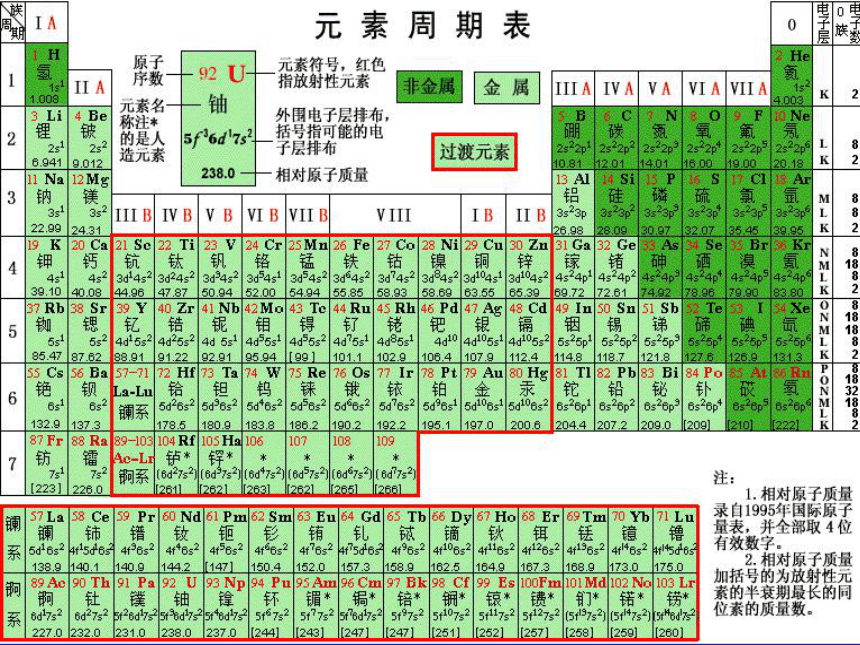
4、如何确定周期和主族序数?7行,18列。在周期表中,每个横行称为周期;
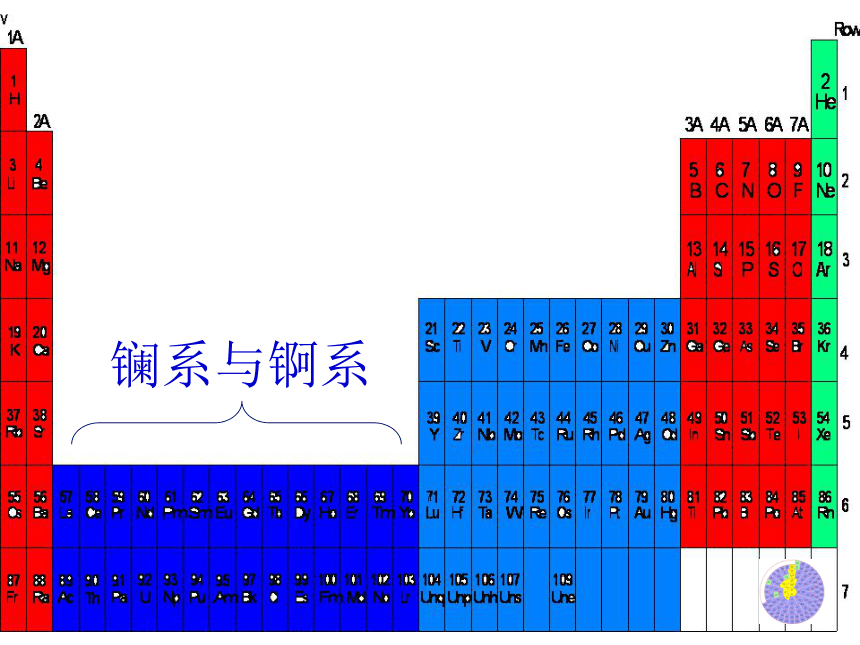
在周期表中,每个纵行称为族;镧系与锕系一:元素周期表的结构288181832未排满21018365486--------短 周 期长 周 期不完全周期1、周期的分类及各周期元素种类一:元素周期表的结构族主族:副族:Ⅷ族:0 族:ⅠA→ⅦAⅢB→ⅦB→ⅠB→ⅡB包括8、9、10三列由稀有气体元素组成一:元素周期表的结构2、18个纵行的相对位置ⅠAⅡAⅢBⅣBⅤBⅥBⅦBⅧⅧⅧⅠBⅡBⅢAⅣAⅤAⅥAⅦAO试一试 1、写出氮、铝、氖元素在周期表中的位置?
2、指出下列主族元素在周期表中的位置,并推测其主要化合价?N:第二周期,ⅤA族;Al:第三周期,ⅢA族;Ne:第二周期,0族;X:第四周期,ⅠA 族,正一价;
Y:第五周期,ⅦA族,负一价。二:位置、结构、性质的关系1、周期数:
电子层数==周期数(电子层数决定周期数)
2、族序数:
最外层电子数==主族序数==最高正价数三:主族元素性质的递变规律Na、 Mg、 Al、 Si、 P、 S、 Cl。金属性逐渐减弱,非金属逐渐增强为什么有这样的规律? 原子半径逐渐减小,原子失电子能力逐渐减弱,得电子能力逐渐增强。三:主族元素性质的递变规律为什么有这样的规律?金属性增强非金属性增强原子半径逐渐增大原子半径逐渐减小四:元素的性质与周期表的关系金属性逐渐减弱,非金属逐渐增强金属性逐渐增强,非金属逐渐减弱金属性增强
非金属性增强
问题1、最活泼的金属是什么?
2、最活泼的非金属是什么?
3、预测:砹的有关性质怎样?铯:Cs氟:F1、砹单质常温下为黑色固体;
2、砹与氢气不易化合,砹化氢不稳定;
3、砹化银难溶于水;
4、砹化氢水溶液呈强酸性。五:元素周期表的应用1、预测元素的性质;
(如:推测砹元素的性质)。
2、启发人们在一定区域内寻找新物质,寻找不同用途的元素。
(如:农药元素,半导体材料,催化剂,耐高温、耐腐蚀的合金材料)。练习1: 据国外有关资料报道,在独居石(一种共生矿,化学成分为Ce、La、Nb,…的磷酸盐)中,查明有尚未命名的116、125、126号元素。试判断,其中第116号元素应位于周期表的( )
A、第6周期ⅣA族; B、第7周期ⅥA族
C、第7周期ⅧA族; D、第8周期ⅥA族B练习2: 可能存在的第119号未知元素,有人称为“类钫”,根据周期表结构及元素性质变化趋势,有关“类钫”的预测,说法正确的是( )
A:“类钫”在化合物中是+1价;
B:“类钫”具有放射性
C:“类钫”单质的密度小于1g/cm-3
D:“类钫”单质有较高的熔点AB
1862年法国尚古多绘出“螺旋图”
1864年德国迈尔列出“六元素表”
1865年英国纽兰兹排出“八音律” 1869年门捷列夫提出元素周期律,发表了第一张周期律的图表,1871年由竖排改为横排发表了第二张周期律图表,并预言当时尚未被发现元素的性质和存在,并留下了空位。1869年 门捷列夫发表的第一张元素周期表1871年门捷列夫
预言
类铝(Ea)
相对原子质量约为69
密度约为5.9~6.0g/cm-3
熔点应该很低
可用分光镜发现
其存在1875年发现后
测定
镓(Ga)
相对原子质量约为69.72
密度约为5.94g/cm-3
熔点30.1℃
镓是用分光镜
发现的思考1: 阅读元素周期表,思考交流以下问题:
1、元素周期表有几行几列?
2、什么叫周期?什么叫族?
3、有几种类型的族?族是如何排列的?
4、如何确定周期和主族序数?7行,18列。在周期表中,每个横行称为周期;
在周期表中,每个纵行称为族;镧系与锕系一:元素周期表的结构288181832未排满21018365486--------短 周 期长 周 期不完全周期1、周期的分类及各周期元素种类一:元素周期表的结构族主族:副族:Ⅷ族:0 族:ⅠA→ⅦAⅢB→ⅦB→ⅠB→ⅡB包括8、9、10三列由稀有气体元素组成一:元素周期表的结构2、18个纵行的相对位置ⅠAⅡAⅢBⅣBⅤBⅥBⅦBⅧⅧⅧⅠBⅡBⅢAⅣAⅤAⅥAⅦAO试一试 1、写出氮、铝、氖元素在周期表中的位置?
2、指出下列主族元素在周期表中的位置,并推测其主要化合价?N:第二周期,ⅤA族;Al:第三周期,ⅢA族;Ne:第二周期,0族;X:第四周期,ⅠA 族,正一价;
Y:第五周期,ⅦA族,负一价。二:位置、结构、性质的关系1、周期数:
电子层数==周期数(电子层数决定周期数)
2、族序数:
最外层电子数==主族序数==最高正价数三:主族元素性质的递变规律Na、 Mg、 Al、 Si、 P、 S、 Cl。金属性逐渐减弱,非金属逐渐增强为什么有这样的规律? 原子半径逐渐减小,原子失电子能力逐渐减弱,得电子能力逐渐增强。三:主族元素性质的递变规律为什么有这样的规律?金属性增强非金属性增强原子半径逐渐增大原子半径逐渐减小四:元素的性质与周期表的关系金属性逐渐减弱,非金属逐渐增强金属性逐渐增强,非金属逐渐减弱金属性增强
非金属性增强
问题1、最活泼的金属是什么?
2、最活泼的非金属是什么?
3、预测:砹的有关性质怎样?铯:Cs氟:F1、砹单质常温下为黑色固体;
2、砹与氢气不易化合,砹化氢不稳定;
3、砹化银难溶于水;
4、砹化氢水溶液呈强酸性。五:元素周期表的应用1、预测元素的性质;
(如:推测砹元素的性质)。
2、启发人们在一定区域内寻找新物质,寻找不同用途的元素。
(如:农药元素,半导体材料,催化剂,耐高温、耐腐蚀的合金材料)。练习1: 据国外有关资料报道,在独居石(一种共生矿,化学成分为Ce、La、Nb,…的磷酸盐)中,查明有尚未命名的116、125、126号元素。试判断,其中第116号元素应位于周期表的( )
A、第6周期ⅣA族; B、第7周期ⅥA族
C、第7周期ⅧA族; D、第8周期ⅥA族B练习2: 可能存在的第119号未知元素,有人称为“类钫”,根据周期表结构及元素性质变化趋势,有关“类钫”的预测,说法正确的是( )
A:“类钫”在化合物中是+1价;
B:“类钫”具有放射性
C:“类钫”单质的密度小于1g/cm-3
D:“类钫”单质有较高的熔点AB
