必修2化学键复习课[下学期]
文档属性
| 名称 | 必修2化学键复习课[下学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 195.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-05-26 00:00:00 | ||
图片预览





文档简介
课件19张PPT。
化
学 键
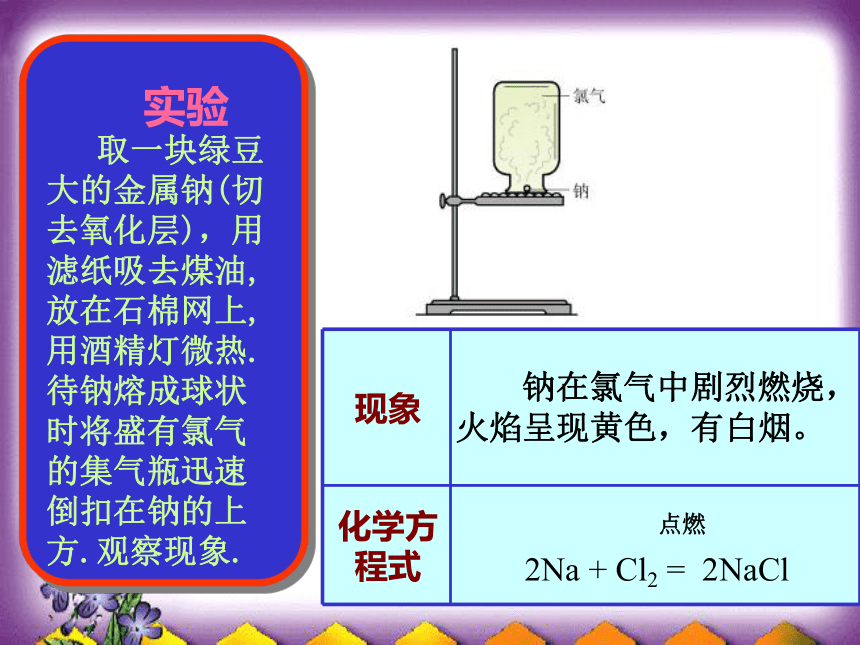
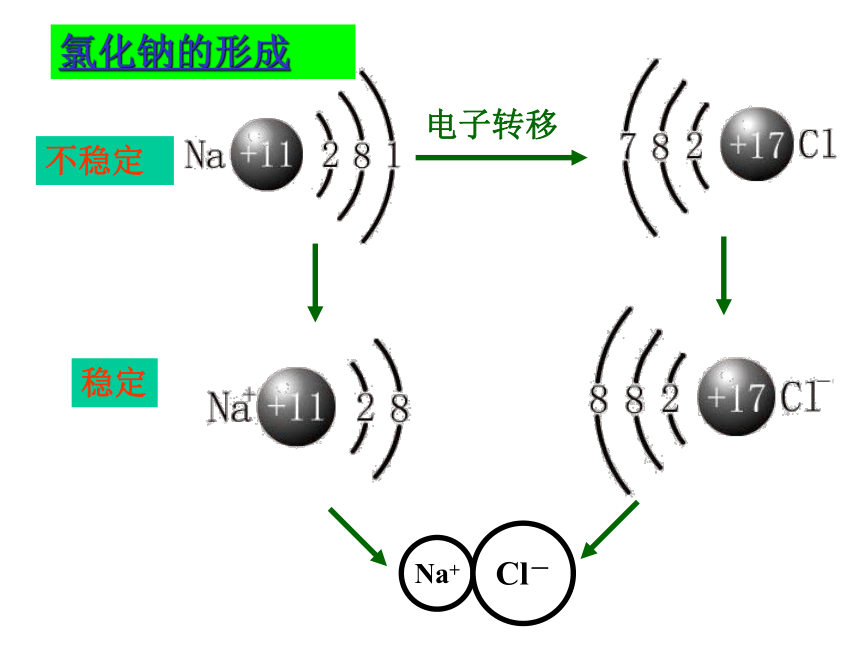
执 教 李 颖电子转移不稳定稳定氯化钠的形成思考1、在氯化钠的形成过程中,各粒子间存在哪些力呢? Na+离子和Cl-离子间的静电相互吸引作用2、阴阳离子结合在一起,彼此电荷是否会中和呢? 两离子间的电子与电子以及两原子核间的相互排斥作用不可能!因阴、阳离子接近到某一定距离时,吸引和排斥作用达到平衡。——带相反电荷离子之间的相互作用。 相互作用:静电作用(静电引力和斥力)成键粒子:阴、阳离子成键过程:阴、阳离子接近到某一定距离时,吸引
和排斥达到平衡,就形成了离子键。含有离子键的化合物就是离子化合物。
离子键
哪些物质含有离子键呢?1、活泼的金属元素(IA,IIA)和活泼的非金属元素
(VIA,VIIA)之间形成的化合物;
归纳2、活泼金属的离子和酸根离子形成的盐;
4、铵根离子和酸根离子(或活泼非金属离子)结合成的盐。
3、活泼金属的离子与OH-离子形成的强碱;如:如:如:如:Li、Na、K、Mg、Ca和O、S、F、Cl、Br、I等之间形成的化合物。Na+、K+、Mg2+、Ca2+和SO42-、NO3-、Cl-形成的盐。KOH、Ba(OH)2、Ca(OH)2、NaOHNH4NO3、NH4Cl等
强化练习1、下列化合物中不能形成离子键的是------( )
A.H2O B.CaI2 C.KOH D.NaNO3A2、下列性质中,能证明某化合物内一定存在离子键
的是----------------------------( )
A.可溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态能导电D1、原子的电子式: 如:
在元素符号周围用“ · ”或“×”来表示
原子最外层电子。 ①阳离子的电子式: 2、离子的电子式:Mg2+、Na+②阴离子的电子式:即用阳离子的符号来示。 用标有方括号的符号来表示,括号内应达到
稳定结构,括号外注明所带电荷数。
3、化学式的电子式(以离子化合物为例)如NaCl的电子式
如MgO电子式
离子化合物的电子式:由阴、阳离子的电子式组成,但对相同离子不能合并。AB型AB2型A2B型
用电子式表示NaCl的离子键的形成过程。+Na+画箭号
Na×
注意:
左边写原子的电子式,右边写化合物的电子式,
中间用“→”连接。
巩固练习 ①H、Na、 N、O、 S、F、Cl 、Ne、Mg、Ca
②Na+、Mg2+、Ca2+
③O2-、S2-、F-、Cl-、Br-、I-
④CaO、MgCl2 、 Na2S3、写电子式: 4、下列化合物电子式书写正确的是---------( )
A.Ca2+[∶Cl∶]-2 B. Na+[∶S∶]-2Na+
C.[Mg 2+][∶O∶]2- D. K+[∶F∶]-................D Cl2和HCl分子的形成共价键:原子之间通过共用电子对所形成的相互作用。1.成键元素: 相同或不同非金属元素之间。 2.成键粒子 :原子。(也就是说在共价键形成过程中,
不会出现离子) 3.成键原因: ①通过共用电子对各原子最外层电子数目
一般能达到饱和,由不稳定变稳定;
②两原子核都吸引共用电子对,使之处于
平衡状态;以共用电子对形成分子的化合物叫共价化合物。非极性键 :同种元素的原子形成的共价键。 (A—A 型) 极性键 :不同种元素的原子形成的共价键 (A—B 型) 举 例:见教材P21页,特别注意N2和CO2的电子式。
巩固练习5. 关于化学键的下列叙述中,正确的是-----------------( )
A.离子化合物可能含共价键
B.共价化合物可能含离子键
C.离子化合物中只含离子键
D.共价化合物中不含离子键
6、下列物质中,含有共价键的离子化合物是----------( )
A.碘化氢 B.氢氧化钠 C.液溴 D.食盐
7、指出下列分子中哪些含极性键--------------------------( )
A、CO2 B、Cl2 C、CH4 D、N2
8、下列过程中共价键被破坏的是----------------------------( )
A.碘升华 B.溴蒸气被木炭吸附
C.蔗糖溶于水 D.氯化氢气体溶于水BADDAC
离子键与共价键的区别:成键原因 键的类型成键粒子 成键元素 电子式 离子键 得失电子 阴、阳离子 金属与非金属 标电荷符号,阴
离子要加括号 共价键 形成共用电子对 原子 非金属与非金属 只需标出电子 注意:离子化合物可能含共价键(如:NaOH)
但共价化合物中不可能含离子键。
咸潮是一种“冲淡水”,是河口的咸水—陆地淡水和海洋盐水混合的咸水。当江水中含盐度超过0.25g/L,会对人体造成危害,并会影响到动、植物的生长,还会对工业生产造成威胁,如锅炉容易积垢,设备容易氧化、生绣。咸水与一般的淡水相比较,味觉成苦。苦味主要来自MgCl2,下列有关氯化镁的说法正确的是-------------------------------------( )
A、MgCl2是共价化合物
B、MgCl2是离子化合物
C、MgCl2中含有非极性键
D、MgCl2的电子式是:Mg2+[∶Cl∶]-2
综合运用:....B2、常见原子、离子、单质以及化合物电子式的书写。3、离子化合物、气体单质以及共价化合物的形成过程。
1、化学键 离子键 共价键 极性共价键 非极性共价键 4、离子化合物与共价化合物的区别。 5、化学反应的实质: ①从物质的变化来看:有新物质生成; ②从分子和原子的角度出发:分子发生破裂,破裂
为原子,然后原子重新结合成新的分子;③ 从化学键的角度出发:反应物分子中化学键发生
断裂,生成物分子中化学键的形成。课堂小结:
化
学 键
执 教 李 颖电子转移不稳定稳定氯化钠的形成思考1、在氯化钠的形成过程中,各粒子间存在哪些力呢? Na+离子和Cl-离子间的静电相互吸引作用2、阴阳离子结合在一起,彼此电荷是否会中和呢? 两离子间的电子与电子以及两原子核间的相互排斥作用不可能!因阴、阳离子接近到某一定距离时,吸引和排斥作用达到平衡。——带相反电荷离子之间的相互作用。 相互作用:静电作用(静电引力和斥力)成键粒子:阴、阳离子成键过程:阴、阳离子接近到某一定距离时,吸引
和排斥达到平衡,就形成了离子键。含有离子键的化合物就是离子化合物。
离子键
哪些物质含有离子键呢?1、活泼的金属元素(IA,IIA)和活泼的非金属元素
(VIA,VIIA)之间形成的化合物;
归纳2、活泼金属的离子和酸根离子形成的盐;
4、铵根离子和酸根离子(或活泼非金属离子)结合成的盐。
3、活泼金属的离子与OH-离子形成的强碱;如:如:如:如:Li、Na、K、Mg、Ca和O、S、F、Cl、Br、I等之间形成的化合物。Na+、K+、Mg2+、Ca2+和SO42-、NO3-、Cl-形成的盐。KOH、Ba(OH)2、Ca(OH)2、NaOHNH4NO3、NH4Cl等
强化练习1、下列化合物中不能形成离子键的是------( )
A.H2O B.CaI2 C.KOH D.NaNO3A2、下列性质中,能证明某化合物内一定存在离子键
的是----------------------------( )
A.可溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态能导电D1、原子的电子式: 如:
在元素符号周围用“ · ”或“×”来表示
原子最外层电子。 ①阳离子的电子式: 2、离子的电子式:Mg2+、Na+②阴离子的电子式:即用阳离子的符号来示。 用标有方括号的符号来表示,括号内应达到
稳定结构,括号外注明所带电荷数。
3、化学式的电子式(以离子化合物为例)如NaCl的电子式
如MgO电子式
离子化合物的电子式:由阴、阳离子的电子式组成,但对相同离子不能合并。AB型AB2型A2B型
用电子式表示NaCl的离子键的形成过程。+Na+画箭号
Na×
注意:
左边写原子的电子式,右边写化合物的电子式,
中间用“→”连接。
巩固练习 ①H、Na、 N、O、 S、F、Cl 、Ne、Mg、Ca
②Na+、Mg2+、Ca2+
③O2-、S2-、F-、Cl-、Br-、I-
④CaO、MgCl2 、 Na2S3、写电子式: 4、下列化合物电子式书写正确的是---------( )
A.Ca2+[∶Cl∶]-2 B. Na+[∶S∶]-2Na+
C.[Mg 2+][∶O∶]2- D. K+[∶F∶]-................D Cl2和HCl分子的形成共价键:原子之间通过共用电子对所形成的相互作用。1.成键元素: 相同或不同非金属元素之间。 2.成键粒子 :原子。(也就是说在共价键形成过程中,
不会出现离子) 3.成键原因: ①通过共用电子对各原子最外层电子数目
一般能达到饱和,由不稳定变稳定;
②两原子核都吸引共用电子对,使之处于
平衡状态;以共用电子对形成分子的化合物叫共价化合物。非极性键 :同种元素的原子形成的共价键。 (A—A 型) 极性键 :不同种元素的原子形成的共价键 (A—B 型) 举 例:见教材P21页,特别注意N2和CO2的电子式。
巩固练习5. 关于化学键的下列叙述中,正确的是-----------------( )
A.离子化合物可能含共价键
B.共价化合物可能含离子键
C.离子化合物中只含离子键
D.共价化合物中不含离子键
6、下列物质中,含有共价键的离子化合物是----------( )
A.碘化氢 B.氢氧化钠 C.液溴 D.食盐
7、指出下列分子中哪些含极性键--------------------------( )
A、CO2 B、Cl2 C、CH4 D、N2
8、下列过程中共价键被破坏的是----------------------------( )
A.碘升华 B.溴蒸气被木炭吸附
C.蔗糖溶于水 D.氯化氢气体溶于水BADDAC
离子键与共价键的区别:成键原因 键的类型成键粒子 成键元素 电子式 离子键 得失电子 阴、阳离子 金属与非金属 标电荷符号,阴
离子要加括号 共价键 形成共用电子对 原子 非金属与非金属 只需标出电子 注意:离子化合物可能含共价键(如:NaOH)
但共价化合物中不可能含离子键。
咸潮是一种“冲淡水”,是河口的咸水—陆地淡水和海洋盐水混合的咸水。当江水中含盐度超过0.25g/L,会对人体造成危害,并会影响到动、植物的生长,还会对工业生产造成威胁,如锅炉容易积垢,设备容易氧化、生绣。咸水与一般的淡水相比较,味觉成苦。苦味主要来自MgCl2,下列有关氯化镁的说法正确的是-------------------------------------( )
A、MgCl2是共价化合物
B、MgCl2是离子化合物
C、MgCl2中含有非极性键
D、MgCl2的电子式是:Mg2+[∶Cl∶]-2
综合运用:....B2、常见原子、离子、单质以及化合物电子式的书写。3、离子化合物、气体单质以及共价化合物的形成过程。
1、化学键 离子键 共价键 极性共价键 非极性共价键 4、离子化合物与共价化合物的区别。 5、化学反应的实质: ①从物质的变化来看:有新物质生成; ②从分子和原子的角度出发:分子发生破裂,破裂
为原子,然后原子重新结合成新的分子;③ 从化学键的角度出发:反应物分子中化学键发生
断裂,生成物分子中化学键的形成。课堂小结:
