人教版高中化学必修一第四章第三节 硫和氮的氧化物 课件(1、2、3课时)(43张)
文档属性
| 名称 | 人教版高中化学必修一第四章第三节 硫和氮的氧化物 课件(1、2、3课时)(43张) |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-09 22:08:58 | ||
图片预览











文档简介
课件43张PPT。第三节 硫和氮的氧化物【学习目标】【重点难点】(1)了解二氧化硫的物理性质及用途,掌握二氧化硫的化学性质。
(2)了解二氧化硫对空气的污染,提高环境保护意识。 1、掌握SO2的化学性质。 2、可逆反应的特点。 自然界
中的硫
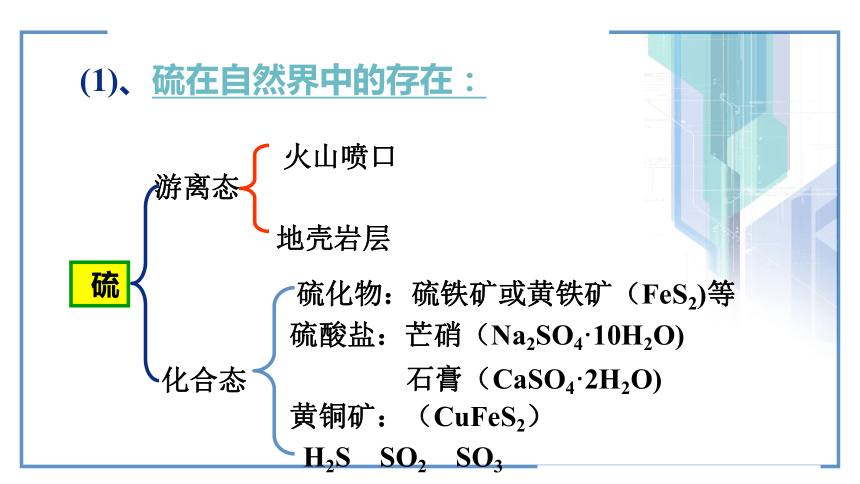
元素。硫广泛存在于自然界 硫的存在硫广泛存在于自然界 (1)、硫在自然界中的存在:硫游离态化合态火山喷口地壳岩层硫化物:硫铁矿或黄铁矿(FeS2)等硫酸盐:芒硝(Na2SO4·10H2O) 石膏(CaSO4·2H2O)黄铜矿:(CuFeS2)H2S SO2 SO3(2)硫的性质:物理性质:黄色晶体,俗称硫黄,质脆,易研成粉末。不溶于水,微溶于酒精,易溶于CS2.试管内壁附着硫怎样洗掉?化学性质:
S+Fe=FeS 2Cu+S=Cu2S
S+O2=SO2 △△点燃既有氧化性又有还原性!二氧化硫1.来源:煤等含硫燃料的燃烧、工业 废气、火山喷发等.一、硫的氧化物SO2颜色状态气味密度毒性沸点水溶性无色气体刺激性气味密度比空气大有毒易液化2.物理性质【P90实验4-7:SO2与H2O反应】 (二)化学性质1、 盛有SO2 气体的试管水位有什么变化?说明了什么?试管内水位上升;说明SO2易溶水紫色石蕊试液变红色,溶液呈酸性2、溶液颜色有什么变化?说明什么问题?亚硫酸是一种弱酸,不稳定 。1、与H2O反应:
SO2+H2O H2SO3(亚硫酸) 可逆反应:
在同一条件下,既向正反应方向进行,
同时又向逆反应方向进行的反应特点:①相同条件
②同时向两个方向进行2、具有酸性氧化物的通性与碱反应
SO2+2NaOH=Na2SO3+H2O
与碱性氧化物反应:
SO2+Na2O=Na2SO3 (亚硫酸钠)
SO2 +CaO==CaSO3 (亚硫酸钙)
实验室制取SO2,可选择用碱液吸收尾气,防止空气污染。
3. SO2的漂白性 SO2溶于水产生的H2SO3能与某些有色物质结合成不稳定的无色物质而具有漂白性---暂时性.
选择性:不能使紫色石蕊试液褪色
(石蕊变红)——化合漂白用途:它可以用来漂白纸浆、毛、丝、草编制品等。请你思考为什么长时间放置的报纸和草帽会变黄?漂白原理的比较 SO2 + Cl2 + 2 H2O = H2SO4 + 2HCl 4、具有较强的还原性:
可被X2(卤素单质)、O2、KMnO4(H+)、HNO3、Fe3+、Na2O2等许多氧化剂氧化。
所以:
1、SO2能使氯水、溴水和酸性KMnO4溶液褪色。
2、SO2与Cl2体积比为1:1时,不具有漂白性
5、具有氧化性
SO2+ 2H2S = 3S↓+2H2O
资料卡片:(91页)
预防硫化氢中毒(三)SO2的用途A.制硫酸:S—SO2—SO3—H2SO4B.漂白纸浆、毛、丝、草帽。C.杀菌消毒三.三氧化硫 SO3的物理性质
SO3是无色易挥发的晶体,熔点为16.8℃,沸点为44.8℃。
SO3的化学性质
具有酸性氧化物的通性
SO3+H2O=H2SO4(放出大量热)
SO3+CaO=CaSO4
SO3+Ca(OH)2=CaSO4+H2O练习:1.通常情况下,SO2是一种____色、_____味、____毒的_____,它溶于水后生成______ 。在相同条件下,生成的物质又容易分解为_____和______,这样的反应叫做______ _ 。
2.潮湿的氯气有漂白作用,这是由于____________ ,SO2能使品红溶液褪色,这是由于_________________________ __________。无刺激性有气体H2SO3SO2H2O可逆反应生成HClOSO2具有漂白性3.下列物质中,既具有氧化性又具有还原性的是 [ ]
A.Cl2 B.Na C.H2SO4 D.SO2
4.下列关于SO2的说法中,不正确的是 [ ]
A.SO2是硫及某些含硫化合物在空气中燃烧的产物
B.SO2有漂白作用,也有杀菌作用
C.SO2溶于水后生成H2SO4
D.SO2是一种大气污染物A、DH2SO3C 第二课时 二氧化氮和一氧化氮在新疆与青海交界处有一山谷,人称魔鬼谷,经常电闪雷鸣,狂风暴雨,把人畜击毙。然而谷内却是牧草茂盛,四季常青。请解释原因。 N2 + O2 ==== 2NO放电或高温2NO + O2 = 2NO2 3NO2 + H2O = 2HNO3 + NO雷雨发庄稼3NO2 + H2O =
2HNO3 + NO 2NO + O2 = 2NO2 4、NO和NO2的性质无色,有毒气体
不溶于水,密度比空气小
红棕色,有刺激性气味的有毒气体,易溶于水,易液化,密度比空气大NO2与H2O的实验现给你一试管二氧化氮,其他药品和仪器自选。
1、请你设计实验,要求尽可能多地NO2被水吸收。4 NO2 + 2H2O + O2 = 4HNO3将充满NO2的试管倒立在水槽
红棕色逐渐消失,试管水位上升到2/3处
3NO2+H2O=
2HNO3+NO
往试管通入O2无色气体变成红棕色;水位继续上升,红棕色又消失2NO+O2=
2NO2继续通入氧气水逐渐充满试管
3NO2+H2O=
2HNO3+NO2、你的设计对工业上生产硝酸有什么启示?
------工业生产硝酸,将尾气(NO)吸收通入适量的氧气后再溶解于水,经过多次循环氧化、溶解,可充分利用原料,并减少NO的排放,保护环境。4 NO + 2H2O + 3O2 = 4HNO3 三、 SO2和NO2对大气的污染1、空气中 SO2和NO2的来源:(1)煤、石油等含硫燃料的燃烧;(2)火山爆发、工厂尾气;(3)汽车尾气。2、SO2的危害:形成酸雨3、NO、NO2危害:造成光化学烟雾,形成酸雨1.什么是酸雨? 2.正常雨水pH应在什么范围? 3.酸雨是怎样形成的? 4.酸雨有什么危害?so、问题来了!我们将PH<5.6的雨水称之为酸雨酸雨的形成由于溶解了二氧化碳的缘故,正常雨水的pH值在5.6左右,然而,当空气中大量N和S的氧化物随雨水降落下来就会使得雨水的pH值小于5.6而形成酸雨。 随着人们生活水平的日益提高,城市工业化步伐的大步前进,环境污染已经成为全世界最为关注的问题之一,某些工厂排出的废气不经过处理直接排放到空气中,严重造成了大气污染,使得某些地区雨水酸性严重超标,形成酸雨。 1872年美国化学家Smith首先提出酸雨一词,引起全世界关注。1985年,几场酸雨过后,我国四川奉节县9万多亩松树全部枯死,重庆南山2.7万亩马尾松死亡过半。酸雨在国外被称为“空中死神”
酸雨可对森林植物产生很大危害。根据国内对 105 种木本植物影响的模拟实验,当降水 pH 值小于 3.0 时,可对植物叶片造成直接的损害,使叶片失绿变黄并开始脱落。叶片与酸雨接触的时间越长,受到的损害越严重。野外调查表明,在降水 PH 值小于 4.5 的地区,马尾松林、华山松和冷杉林等出现大量黄叶并脱落,森林成片地衰亡。例如重庆奉节县的降水 pH 值小于 4.3 的地段,20 年生马尾松林的年平均高生长量降低 50%。乐山大佛遭受酸雨腐蚀左侧图片摄于1908年右侧图片摄于1968年这种烟雾使人眼睛发红,咽喉疼痛,呼吸憋闷、头昏、头痛。1943年以后,烟雾更加肆虐,以致远离城市100千米以外的海拔2000米高山上的大片松林也因此枯死,柑橘减产。1970年,约有75%以上的市民患上了红眼病。这就是最早出现的新型大气污染事件--光化学烟雾污染事件。美国洛杉矶光化学烟雾污染事件。
原因:汽车尾气中的烯烃类碳氢化合物和二氧化氮(NO2)被排放到大气中后,在强烈的阳光紫外线照射下,会吸收太阳光所具有的能量发生光化学反应。其产物为含剧毒的光化学烟雾。
SO2 + Ca(OH)2 = CaSO3 + H2O 作业用化学方程式表示酸雨的形成过程?并谈一谈有什么危害?应当怎样防治?
(2)了解二氧化硫对空气的污染,提高环境保护意识。 1、掌握SO2的化学性质。 2、可逆反应的特点。 自然界
中的硫
元素。硫广泛存在于自然界 硫的存在硫广泛存在于自然界 (1)、硫在自然界中的存在:硫游离态化合态火山喷口地壳岩层硫化物:硫铁矿或黄铁矿(FeS2)等硫酸盐:芒硝(Na2SO4·10H2O) 石膏(CaSO4·2H2O)黄铜矿:(CuFeS2)H2S SO2 SO3(2)硫的性质:物理性质:黄色晶体,俗称硫黄,质脆,易研成粉末。不溶于水,微溶于酒精,易溶于CS2.试管内壁附着硫怎样洗掉?化学性质:
S+Fe=FeS 2Cu+S=Cu2S
S+O2=SO2 △△点燃既有氧化性又有还原性!二氧化硫1.来源:煤等含硫燃料的燃烧、工业 废气、火山喷发等.一、硫的氧化物SO2颜色状态气味密度毒性沸点水溶性无色气体刺激性气味密度比空气大有毒易液化2.物理性质【P90实验4-7:SO2与H2O反应】 (二)化学性质1、 盛有SO2 气体的试管水位有什么变化?说明了什么?试管内水位上升;说明SO2易溶水紫色石蕊试液变红色,溶液呈酸性2、溶液颜色有什么变化?说明什么问题?亚硫酸是一种弱酸,不稳定 。1、与H2O反应:
SO2+H2O H2SO3(亚硫酸) 可逆反应:
在同一条件下,既向正反应方向进行,
同时又向逆反应方向进行的反应特点:①相同条件
②同时向两个方向进行2、具有酸性氧化物的通性与碱反应
SO2+2NaOH=Na2SO3+H2O
与碱性氧化物反应:
SO2+Na2O=Na2SO3 (亚硫酸钠)
SO2 +CaO==CaSO3 (亚硫酸钙)
实验室制取SO2,可选择用碱液吸收尾气,防止空气污染。
3. SO2的漂白性 SO2溶于水产生的H2SO3能与某些有色物质结合成不稳定的无色物质而具有漂白性---暂时性.
选择性:不能使紫色石蕊试液褪色
(石蕊变红)——化合漂白用途:它可以用来漂白纸浆、毛、丝、草编制品等。请你思考为什么长时间放置的报纸和草帽会变黄?漂白原理的比较 SO2 + Cl2 + 2 H2O = H2SO4 + 2HCl 4、具有较强的还原性:
可被X2(卤素单质)、O2、KMnO4(H+)、HNO3、Fe3+、Na2O2等许多氧化剂氧化。
所以:
1、SO2能使氯水、溴水和酸性KMnO4溶液褪色。
2、SO2与Cl2体积比为1:1时,不具有漂白性
5、具有氧化性
SO2+ 2H2S = 3S↓+2H2O
资料卡片:(91页)
预防硫化氢中毒(三)SO2的用途A.制硫酸:S—SO2—SO3—H2SO4B.漂白纸浆、毛、丝、草帽。C.杀菌消毒三.三氧化硫 SO3的物理性质
SO3是无色易挥发的晶体,熔点为16.8℃,沸点为44.8℃。
SO3的化学性质
具有酸性氧化物的通性
SO3+H2O=H2SO4(放出大量热)
SO3+CaO=CaSO4
SO3+Ca(OH)2=CaSO4+H2O练习:1.通常情况下,SO2是一种____色、_____味、____毒的_____,它溶于水后生成______ 。在相同条件下,生成的物质又容易分解为_____和______,这样的反应叫做______ _ 。
2.潮湿的氯气有漂白作用,这是由于____________ ,SO2能使品红溶液褪色,这是由于_________________________ __________。无刺激性有气体H2SO3SO2H2O可逆反应生成HClOSO2具有漂白性3.下列物质中,既具有氧化性又具有还原性的是 [ ]
A.Cl2 B.Na C.H2SO4 D.SO2
4.下列关于SO2的说法中,不正确的是 [ ]
A.SO2是硫及某些含硫化合物在空气中燃烧的产物
B.SO2有漂白作用,也有杀菌作用
C.SO2溶于水后生成H2SO4
D.SO2是一种大气污染物A、DH2SO3C 第二课时 二氧化氮和一氧化氮在新疆与青海交界处有一山谷,人称魔鬼谷,经常电闪雷鸣,狂风暴雨,把人畜击毙。然而谷内却是牧草茂盛,四季常青。请解释原因。 N2 + O2 ==== 2NO放电或高温2NO + O2 = 2NO2 3NO2 + H2O = 2HNO3 + NO雷雨发庄稼3NO2 + H2O =
2HNO3 + NO 2NO + O2 = 2NO2 4、NO和NO2的性质无色,有毒气体
不溶于水,密度比空气小
红棕色,有刺激性气味的有毒气体,易溶于水,易液化,密度比空气大NO2与H2O的实验现给你一试管二氧化氮,其他药品和仪器自选。
1、请你设计实验,要求尽可能多地NO2被水吸收。4 NO2 + 2H2O + O2 = 4HNO3将充满NO2的试管倒立在水槽
红棕色逐渐消失,试管水位上升到2/3处
3NO2+H2O=
2HNO3+NO
往试管通入O2无色气体变成红棕色;水位继续上升,红棕色又消失2NO+O2=
2NO2继续通入氧气水逐渐充满试管
3NO2+H2O=
2HNO3+NO2、你的设计对工业上生产硝酸有什么启示?
------工业生产硝酸,将尾气(NO)吸收通入适量的氧气后再溶解于水,经过多次循环氧化、溶解,可充分利用原料,并减少NO的排放,保护环境。4 NO + 2H2O + 3O2 = 4HNO3 三、 SO2和NO2对大气的污染1、空气中 SO2和NO2的来源:(1)煤、石油等含硫燃料的燃烧;(2)火山爆发、工厂尾气;(3)汽车尾气。2、SO2的危害:形成酸雨3、NO、NO2危害:造成光化学烟雾,形成酸雨1.什么是酸雨? 2.正常雨水pH应在什么范围? 3.酸雨是怎样形成的? 4.酸雨有什么危害?so、问题来了!我们将PH<5.6的雨水称之为酸雨酸雨的形成由于溶解了二氧化碳的缘故,正常雨水的pH值在5.6左右,然而,当空气中大量N和S的氧化物随雨水降落下来就会使得雨水的pH值小于5.6而形成酸雨。 随着人们生活水平的日益提高,城市工业化步伐的大步前进,环境污染已经成为全世界最为关注的问题之一,某些工厂排出的废气不经过处理直接排放到空气中,严重造成了大气污染,使得某些地区雨水酸性严重超标,形成酸雨。 1872年美国化学家Smith首先提出酸雨一词,引起全世界关注。1985年,几场酸雨过后,我国四川奉节县9万多亩松树全部枯死,重庆南山2.7万亩马尾松死亡过半。酸雨在国外被称为“空中死神”
酸雨可对森林植物产生很大危害。根据国内对 105 种木本植物影响的模拟实验,当降水 pH 值小于 3.0 时,可对植物叶片造成直接的损害,使叶片失绿变黄并开始脱落。叶片与酸雨接触的时间越长,受到的损害越严重。野外调查表明,在降水 PH 值小于 4.5 的地区,马尾松林、华山松和冷杉林等出现大量黄叶并脱落,森林成片地衰亡。例如重庆奉节县的降水 pH 值小于 4.3 的地段,20 年生马尾松林的年平均高生长量降低 50%。乐山大佛遭受酸雨腐蚀左侧图片摄于1908年右侧图片摄于1968年这种烟雾使人眼睛发红,咽喉疼痛,呼吸憋闷、头昏、头痛。1943年以后,烟雾更加肆虐,以致远离城市100千米以外的海拔2000米高山上的大片松林也因此枯死,柑橘减产。1970年,约有75%以上的市民患上了红眼病。这就是最早出现的新型大气污染事件--光化学烟雾污染事件。美国洛杉矶光化学烟雾污染事件。
原因:汽车尾气中的烯烃类碳氢化合物和二氧化氮(NO2)被排放到大气中后,在强烈的阳光紫外线照射下,会吸收太阳光所具有的能量发生光化学反应。其产物为含剧毒的光化学烟雾。
SO2 + Ca(OH)2 = CaSO3 + H2O 作业用化学方程式表示酸雨的形成过程?并谈一谈有什么危害?应当怎样防治?
