人教版高中化学精品系列必修1.1 化学实验基本方法 教学课件(66张)
文档属性
| 名称 | 人教版高中化学精品系列必修1.1 化学实验基本方法 教学课件(66张) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-09 00:00:00 | ||
图片预览










文档简介
课件66张PPT。第一章 从实验学化学 第一节
化学实验基本方法
第一节
化学实验安全第一课时
化学实验安全第二课时
过滤和蒸发第二章化学物质及其变化 第三课时
蒸馏和萃取
第一课时
化学实验安全第一节 化学实验基本方法
通过初中化学的学习,同学们有什么感受?化学研究的对象是什么?请同学们联系生活举例说明。 课前探究化学实验基本方法化学研究的对象 化学是在原子、分子水平上研究物质的组成、结构、性质、变化、制备和应用的自然科学。结论 化学实验基本方法本节课要学习的内容我们为什么要学习化学
实验安全注意事项
熟悉并掌握一些常见危险化学品标识
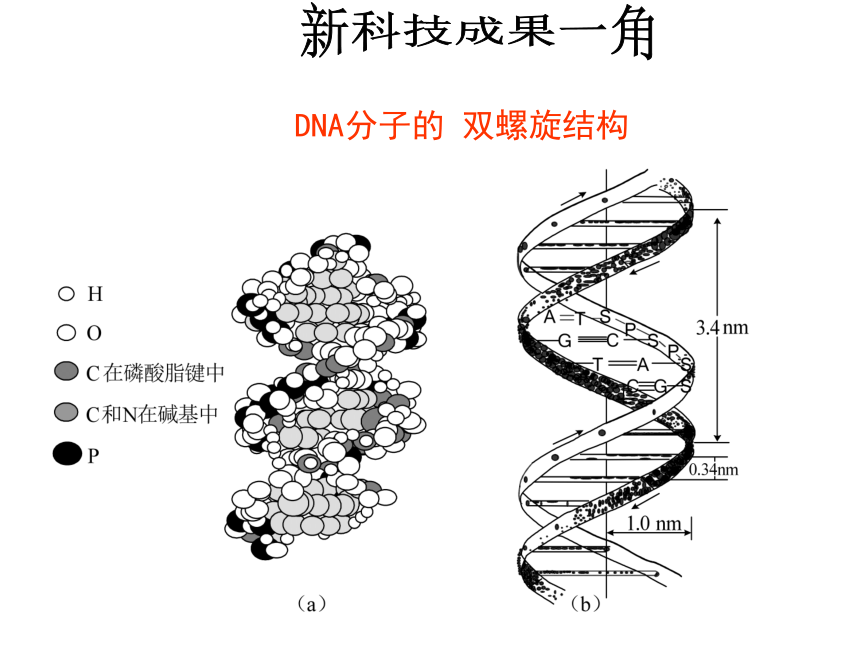
化学在材料、能源、生命科学、环境保护等方面都有突出贡献 化学与我们的衣、食、住、行等方面有哪些联系?比一比哪组同学提供的实例多而新?小组讨论新科技成果一角DNA分子的 双螺旋结构新科技成果一角 污 水 处 理 厂新科技成果一角 1.韩国培育出克隆狗能嗅出人类癌细胞2.印度造出“喝空气”的车,最高时速
109千米
3.新材料可加速海水结冰
4.新型环保炸药研制成功
新科技成果一角 【讨论】 以上这些材料对社会进步所起的作用是什么?化学实验基本方法 自从开始用火,人类就掌握了一些基本的化学工艺 近、现代化学飞速发展,涌现出了许多化学家,发生了很多化学事件。请同学们将化学家与化学事件连在一起考考你化学实验基本方法 化学事件 化学家 提出化学元素 门捷列夫(俄)
燃烧的氧化学说 波义耳(英)
原子学说 拉瓦锡(法)
元素周期律 道尔顿(英)化学实验基本方法世界化工巨头巴斯夫“小小化学家”活动
贝特罗(1827—1907)——生命力论的掘墓人
本生——发明光谱分析法的科学家
波义耳——近代化学的奠基人
布特列洛夫——化学结构理论的提出者
戴维——电解离子析出金属钾钠钙镁的人
道尔顿——科学原子论的提出者
法拉第——电磁学和电化学的奠基人 化学家及其成就 化学世界神奇美妙,化学天地广袤无垠,化学科学魅力无穷,在高中阶段你将学习哪些化学科学知识和方法呢?
一、重视化学实验的作用
二、学会科学探究实验的方法高中化学学习方法化学实验基本方法?探究与交流化学实验基本方法【演示实验】:“滴水生烟”这个实验中有什么需要注意安全的地方? 【小组实验一】:金属钠与水反应
已知信息:钠是银白色、有金属光泽的固体,质地很软,熔点低,密度比水小。钠与水反应放出大量的热,甚至发生爆炸,所以钠要保存在煤油里,通常情况下,钠的化合价为+1价探究与交流 推测金属钠与水反应的产物 请设计实验方案并找出实验中应注意的问题
参考步骤如下:
1、用烧杯取约其容积1/3的蒸馏水,滴加数滴酚酞溶液
2、将金属钠置于玻璃片上,用小刀切取绿豆大小的 金属钠(剩下的 钠放回试剂瓶),用滤纸吸干表面的煤油,用镊子把钠放入烧杯中,观察实验现象。实验目的化学实验基本方法实验现象五字小结: 浮,球,游,叫,红化学实验基本方法实验中需注意的安全问题有哪些?讨论与交流: 【小结】
化学中既有一般性规律,又有个别的实验现象,当两者发生冲突时,实验可以帮助我们找到最好的答案。
化学实验基本方法化学实验安全一.实验安全常识 1. 酒精及其它易燃有机物小面积失火,应迅速用湿布扑灭。
2. 钠磷等失火宜用沙土扑盖。
3. 火警电话119。
4 . 玻璃割伤等“机械类”创伤,应先除去伤口的杂物,再用双氧水擦洗消毒,尔后敷药包扎。
5. 烫伤宜找医生处理。
6. 浓酸撒在实验台上,先用NaHCO3中和,后用水冲洗干净;沾在皮肤上宜先用干抹布抹去,再用水冲净;溅在眼中应先用稀 NaHCO3淋洗,然后请医生处理。 7.浓碱撒在实验台上,先用稀醋酸中和,再用水冲擦干净;
沾在皮肤上宜先用大量水冲洗,再涂上硼酸溶液;溅在眼睛里,用水洗净后再用硼酸溶液淋洗。
8.不可品尝药品的味道。
9.有毒气体实验宜在通风橱或密闭系统中进行。
10.误食重金属盐应立即服生蛋白或生牛奶。
11.汞洒落后,应立即撒上硫粉,并打开墙下部的排气扇。
12. 氯气中毒可吸入少量氨气解毒。化学实验安全 二.常用危险化学品的分类练一练1偶发事件的处理 进行化学实验必须注意实验安全,下列说法正确的是( )
A.不慎将酸溅到眼中,应立即水洗,边洗边眨眼睛
B.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
C.不慎将酒精洒到桌面上着火时,可用水将其扑灭
D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 化学实验安全 下列实验操作中,主要不是从安全因素考虑的是( )
A.点燃氢气前一定要检验氢气的纯度
B.未使用完的白磷要随时收集起来,并与空气隔绝
C.酒精灯不用时,必须盖上灯帽
D.用氢气还原氧化铜时,要先通一会儿氢气,再加热氧化铜练一练2化学实验安全 【思考与交流】
根据你做化学实验和探究活动的体会,谈一谈你的经验教训。与同学讨论、分析引发事故的主要原因,你认为主要的教训是什么?化学实验安全 本节课我们明确了 1.高中化学的研究对象,学习任务。 2.了解了实验室安全注意事项等。 希望同学们在今后的学习中进一步体会和运用,尤其是多留心生活中的化学现象,你会感觉到你的生活中充满化学知识,你的化学会学的更好!美好祝愿作业
课本P10——2、3
课后练习卷
第二课时
混合物的分离与提纯
第一节 化学实验基本方法 [思考与交流] 沙里淘金的方法其原理是什么? 铁屑和沙的混合物分离的最佳方法是什么? 最佳方法是用磁铁将铁屑从沙里吸出而分离。 利用的是黄金和沙的密度不同。思考1.思考2.混合物的分离与提纯 [思考与交流] 如果有铁屑和铜的混合物,你能用哪些方法将铁屑分离除去?淘金者的方法用磁铁吸引铁加盐酸 什么是混合物的分离与提纯 有区 别吗?思考3.混合物的分离与提纯? 分离和提纯: 利用混合物中组分的性质(物理性质,如:溶解性不同等;化学性质,与物质反应的现象不同等)不同,将混合物中的各组分分离开,除去杂质达到提纯所需物质的目的。学与问 在分离和提纯物质时,要除掉杂质。化学上指的杂质都是有害或无价值的吗?请举例说明。混合物的分离与提纯 ①过滤:
②蒸发:1、过滤和蒸发 利用物质的溶解性不同分离难溶物与可溶物。 利用溶液中溶质与溶剂沸点不同加热使溶剂挥发,分离溶质与溶剂。
混合物的分离与提纯 实验名称:粗盐的提纯 实验目的: 除去粗盐中混有的杂质
实验药品与装置:实验步骤:溶解过滤蒸发(泥沙、CaCl2、MgCl2、硫酸盐)粗盐的提纯 粗盐的提纯 如何除去食盐中混有的泥沙?溶解过滤蒸发步骤目的现象注意事项使可溶性物质溶解除去粗盐水中的不溶性杂质从溶液中得到食盐晶体粗盐逐渐溶解得到浑浊的食盐水不溶物留在滤纸上,液体沿漏斗颈流入另一个烧杯中水分蒸发,逐渐析出晶体玻璃棒不断搅拌,以加速食盐溶解 粗盐的提纯 利用上述方法制得的食盐是不是就是纯净的NaCl?如果不是,可能含有什么杂质离子?用什么方法可以检验出它们呢?【思考】 还可能含有Ca2+、Mg2+、SO42-等杂质SO42-的检验: 酸化后,加BaCl2溶液,产生白色沉淀〖实验1-2〗粗盐的提纯 使SO42-、Mg2+、Ca2+反应生成难溶物质沉淀下来。
除SO42-:加稍过量的BaCl2溶液
除Mg2+ :加稍过量的NaOH溶液
除Ca2+ :加稍过量的Na2CO3溶液【解决方案】【提示】 设法将其中可溶性杂质通过化学反应使之转化为沉淀,再一次过滤即可。或转化为气体离开体系也可。 〖思考与交流〗课本第7页粗盐的提纯 【讨论】
除杂时加入的试剂为什么都要稍过量?加入你选择的试剂除掉杂质后,有没有引入其它离子?如有,可用什么方法再把它们除去? Ba2+ 可用 Na2CO3除去
OH- 可用HCl除去
CO32- 可用HCl除去
除杂时引入的离子:Ba2+、OH-、CO32-粗盐的提纯探究实验【练习】 2、为除去粗盐中的Ca2+、Mg2+、SO42-和泥沙,可将粗盐溶于水,再进行下列操作:①过滤②加过量的NaOH溶液③加适量的盐酸④加过量的Na2CO3溶液⑤加过量的BaCl2溶液。正确的排列顺序是___________ _ 1.在进行沉淀实验时,如何认定沉淀已经完全? 取少量上层清液置于小试管中,滴加沉淀剂,如果不再产生沉淀。说明沉淀已经完全。 ①⑤②④①③化学实验基本方法或①②⑤④①③ 【交流小结】 在设计除杂方案时,应考虑哪些方面内容,才能顺利完成实验设计? 1)选择所加试剂化学实验基本方法 2)试剂加入的先后顺序 3)试剂用量 4)试剂过量后如何处理 【除杂原则】 不增 不减 易分 不增加新的杂质不消耗被提纯的物质
如:不能减少NaCl成分 杂质转换为沉淀、气体等易分离
除去。如:将NaCl溶液中可能存
在的Na2SO4转换为沉淀BaSO4简约性化学实验基本方法本课小结 本节课我们学习了:
混合物分离的一些方法: 1.过滤和蒸发——粗盐的提纯 进一步理解了粗盐提纯的方法和步骤:
⑴所需仪器
⑵操作步骤
⑶注意事项
⑷使用玻璃棒的作用和目的
2.SO42-的检验方法 作业
作业:课本P10—3、4、5
第三课时
蒸馏和萃取
第一节 化学实验基本方法
〖课前预习〗 粗盐经过溶解、过滤和蒸发操作得到的氯化钠中仍含有可溶性杂质硫酸盐,可通过加
(填试剂)来检验,简述检验SO42-的操做步骤 ;
实际上,得到的盐中除硫酸盐外,还含有
、 等可溶性杂质。 上一节课,我们学习了粗盐的提纯,在提纯过程中,想想用到过哪几种提纯方法?这些分离方法分别是利用了什么原理?〖课前预习〗 对于液态混合物,我们怎样将其分
离呢?你能想出一些办法吗? 本节课要学习的内容 1.如何从互相溶解的液态混合物中得到其中的某种成分
2.如何把互不相溶的液态混合物分离开来
3.学习几种分离混合物的仪器的使用方法和注意事项
生活中的化学蒸馏和萃取 问题1.如何洗掉刚溅到衣服上的油汤?
——先用酒精或汽油擦洗,再用洗涤剂和水
问题2.如何洗去粘在手上的油漆?
——先用松节油擦洗,再用洗涤剂和水 问题3.纯净水就是蒸馏水吗?【回顾与反思】 阅读并填写课本P8表格—[实验1-3]的相
关内容蒸馏和萃取 自来水中含有较多的杂质,如何除去其中含有的Cl-?
怎样证明得到液体是没有了氯离子的水呢?如果不用加化学试剂的方法,如何除去其中的Cl-? 加入稀HNO3酸化了的AgNO3溶液看是否产生白色浑浊(或白色沉淀) 实验1-3表格 自来水中Cl-的检验
蒸馏——制蒸馏水 检验蒸馏水中是否含有Cl-离子
加AgNO3溶液后,有不溶于稀HNO3的白色沉淀产生
加热,烧瓶中水温升高至100℃
沸腾,在锥形瓶中收集到蒸馏水。
加稀HNO3和AgNO3溶液,蒸馏水中无沉淀。蒸馏和萃取蒸馏——利用混合物中各组分的沸点不同,将
液态混合物中各种成分分离和提纯的方法实验室制取蒸馏水的装置及操作蒸馏和萃取 讨论 酒精和水的混合物能否用蒸馏法分离?先蒸馏出来的是什么物质?蒸馏在生产、生活中的应用酒精的提纯
石油的分馏
海水的淡化蒸馏和萃取生活中的化学 问题1.如何把不小心混在一起的油和水分开?
问题2.碘单质(I2)不易溶于水,但易溶于有机溶剂。如何把碘水中的碘单质提取出来呢?蒸馏和萃取 【从碘水中提取单质碘】
分析实验原理:阅读课本P9[实验1-4]的有关内容 根据同一种溶质在不同溶剂里的溶
解度不同 方法: 操作: 主要仪器:萃取分液分液漏斗 用于分离互不相溶、密度不同的液体混合物蒸馏和萃取常用有机萃取剂 Vs 无机溶剂
汽油
植物油
苯密度比水大
沉于水下层 1.萃取: 四氯化碳 水 用一种溶剂把物质从另一种溶剂所组成的溶液里提取出来的方法。 萃取剂的选择条件:
1、萃取剂与原溶剂要互不相溶
2、溶质在萃取剂中有较大的溶解度
3、萃取剂与原溶剂要有较大的密度差异水蒸馏和萃取 ▲操作注意:
1、使用前必须检漏;
2、萃取过程中要充分振荡,并适当
放气,充分静止,然后分液;
3、分液时保持漏斗内压强与大气压
一致;
4、下层溶液下口出,上层溶液
上口出。 2.分液--分离互不相溶、密度不同的混合 物的方法 思考:酒精能否用来萃取碘水中的碘?蒸馏和萃取过滤蒸发蒸馏萃取1、不可溶性的固体和液体分离——
2、可溶性的固体和液体分离——
3、沸点不同的液体混合物分离——
4、溶解度不同的可溶性混合物分离—本节小结物质分离的几种方法蒸馏和萃取蒸馏和萃取蒸馏和萃取阅读下列材料,按要求回答问题:
酒精、苯、CCl4、煤油都是有机溶剂,有机溶
剂之间大都能互溶;碘(I2)难溶于水,易溶于有
机溶剂,其溶液呈紫色;溴(液溴)的性质与碘相
似,其溶液呈橙色。
1、下列能用分离漏斗分离的是( )
A、液溴和CCl4 B、酒精和煤油
C、CaCl2和Na2SO4溶液 D、苯和蒸馏水 D课堂练习蒸馏和萃取 1.在酒精、苯、CCl4、NaCl溶液、蒸馏水五种试剂中。(1)能把碘单质从碘水中萃取出来的是 ( )
进行分液之后是否已经得到纯净的碘单质?
苯,CCl4不能,还要进一步分离课堂练习蒸馏和萃取 (2)能把溴从溴水中萃取出来,并在分液时溴从分液漏斗上端倒出的是( );萃取时,上层液体呈( )色,
下层液体呈( )色.苯橙无或颜色变浅不能,酒精与CCl4互溶,液体不能分层 (3)CCl4能把碘酒中的碘萃取出来
么?课堂练习蒸馏和萃取 4.用于分离或提纯物质的已学方法有:
A.萃取 B.分液 C.过滤 D.加热分解 E.蒸发 F.蒸馏
下列各组混合物的分离或提纯应选用上述哪种方法最合
适?(把选用方法的标号填入括号内)
(1)除去澄清石灰水中悬浮的Ca(OH)2 颗粒( )
(2)把饱和食盐水中的食盐提取出来 ( )
(3)除去酒精中溶解的微量食盐 ( )
(4)把溴水中的溴提取出来 ( )
(5)用自来水制取医用蒸馏水 ( )
(6)除去氧化钙中的碳酸钙 ( )
(7)分离柴油和水的混合物 ( )BDACEFF课堂练习蒸馏和萃取 5.现有三组溶液:(1)汽油和氯化钠溶液(2)酒精和水的混合溶液;(3)氯化钠和单质溴的溶液。以上混合溶液分离的正确方法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液C课堂练习蒸馏和萃取 6.有A、B两种有机液体的混合物,如果A、B互溶后相互不发生化学反应。在常压下,A的沸点为35℃,B的沸点为200℃。回答下列问题: 用蒸馏方法分离和提纯该混合物,必不
可少的玻璃仪器和用品是
。 冷凝管、锥形瓶、牛角管酒精灯、蒸馏烧瓶、温度计、课堂练习蒸馏和萃取作业:课本P10—6、7
P20—1、2、3
化学实验基本方法
第一节
化学实验安全第一课时
化学实验安全第二课时
过滤和蒸发第二章化学物质及其变化 第三课时
蒸馏和萃取
第一课时
化学实验安全第一节 化学实验基本方法
通过初中化学的学习,同学们有什么感受?化学研究的对象是什么?请同学们联系生活举例说明。 课前探究化学实验基本方法化学研究的对象 化学是在原子、分子水平上研究物质的组成、结构、性质、变化、制备和应用的自然科学。结论 化学实验基本方法本节课要学习的内容我们为什么要学习化学
实验安全注意事项
熟悉并掌握一些常见危险化学品标识
化学在材料、能源、生命科学、环境保护等方面都有突出贡献 化学与我们的衣、食、住、行等方面有哪些联系?比一比哪组同学提供的实例多而新?小组讨论新科技成果一角DNA分子的 双螺旋结构新科技成果一角 污 水 处 理 厂新科技成果一角 1.韩国培育出克隆狗能嗅出人类癌细胞2.印度造出“喝空气”的车,最高时速
109千米
3.新材料可加速海水结冰
4.新型环保炸药研制成功
新科技成果一角 【讨论】 以上这些材料对社会进步所起的作用是什么?化学实验基本方法 自从开始用火,人类就掌握了一些基本的化学工艺 近、现代化学飞速发展,涌现出了许多化学家,发生了很多化学事件。请同学们将化学家与化学事件连在一起考考你化学实验基本方法 化学事件 化学家 提出化学元素 门捷列夫(俄)
燃烧的氧化学说 波义耳(英)
原子学说 拉瓦锡(法)
元素周期律 道尔顿(英)化学实验基本方法世界化工巨头巴斯夫“小小化学家”活动
贝特罗(1827—1907)——生命力论的掘墓人
本生——发明光谱分析法的科学家
波义耳——近代化学的奠基人
布特列洛夫——化学结构理论的提出者
戴维——电解离子析出金属钾钠钙镁的人
道尔顿——科学原子论的提出者
法拉第——电磁学和电化学的奠基人 化学家及其成就 化学世界神奇美妙,化学天地广袤无垠,化学科学魅力无穷,在高中阶段你将学习哪些化学科学知识和方法呢?
一、重视化学实验的作用
二、学会科学探究实验的方法高中化学学习方法化学实验基本方法?探究与交流化学实验基本方法【演示实验】:“滴水生烟”这个实验中有什么需要注意安全的地方? 【小组实验一】:金属钠与水反应
已知信息:钠是银白色、有金属光泽的固体,质地很软,熔点低,密度比水小。钠与水反应放出大量的热,甚至发生爆炸,所以钠要保存在煤油里,通常情况下,钠的化合价为+1价探究与交流 推测金属钠与水反应的产物 请设计实验方案并找出实验中应注意的问题
参考步骤如下:
1、用烧杯取约其容积1/3的蒸馏水,滴加数滴酚酞溶液
2、将金属钠置于玻璃片上,用小刀切取绿豆大小的 金属钠(剩下的 钠放回试剂瓶),用滤纸吸干表面的煤油,用镊子把钠放入烧杯中,观察实验现象。实验目的化学实验基本方法实验现象五字小结: 浮,球,游,叫,红化学实验基本方法实验中需注意的安全问题有哪些?讨论与交流: 【小结】
化学中既有一般性规律,又有个别的实验现象,当两者发生冲突时,实验可以帮助我们找到最好的答案。
化学实验基本方法化学实验安全一.实验安全常识 1. 酒精及其它易燃有机物小面积失火,应迅速用湿布扑灭。
2. 钠磷等失火宜用沙土扑盖。
3. 火警电话119。
4 . 玻璃割伤等“机械类”创伤,应先除去伤口的杂物,再用双氧水擦洗消毒,尔后敷药包扎。
5. 烫伤宜找医生处理。
6. 浓酸撒在实验台上,先用NaHCO3中和,后用水冲洗干净;沾在皮肤上宜先用干抹布抹去,再用水冲净;溅在眼中应先用稀 NaHCO3淋洗,然后请医生处理。 7.浓碱撒在实验台上,先用稀醋酸中和,再用水冲擦干净;
沾在皮肤上宜先用大量水冲洗,再涂上硼酸溶液;溅在眼睛里,用水洗净后再用硼酸溶液淋洗。
8.不可品尝药品的味道。
9.有毒气体实验宜在通风橱或密闭系统中进行。
10.误食重金属盐应立即服生蛋白或生牛奶。
11.汞洒落后,应立即撒上硫粉,并打开墙下部的排气扇。
12. 氯气中毒可吸入少量氨气解毒。化学实验安全 二.常用危险化学品的分类练一练1偶发事件的处理 进行化学实验必须注意实验安全,下列说法正确的是( )
A.不慎将酸溅到眼中,应立即水洗,边洗边眨眼睛
B.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
C.不慎将酒精洒到桌面上着火时,可用水将其扑灭
D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 化学实验安全 下列实验操作中,主要不是从安全因素考虑的是( )
A.点燃氢气前一定要检验氢气的纯度
B.未使用完的白磷要随时收集起来,并与空气隔绝
C.酒精灯不用时,必须盖上灯帽
D.用氢气还原氧化铜时,要先通一会儿氢气,再加热氧化铜练一练2化学实验安全 【思考与交流】
根据你做化学实验和探究活动的体会,谈一谈你的经验教训。与同学讨论、分析引发事故的主要原因,你认为主要的教训是什么?化学实验安全 本节课我们明确了 1.高中化学的研究对象,学习任务。 2.了解了实验室安全注意事项等。 希望同学们在今后的学习中进一步体会和运用,尤其是多留心生活中的化学现象,你会感觉到你的生活中充满化学知识,你的化学会学的更好!美好祝愿作业
课本P10——2、3
课后练习卷
第二课时
混合物的分离与提纯
第一节 化学实验基本方法 [思考与交流] 沙里淘金的方法其原理是什么? 铁屑和沙的混合物分离的最佳方法是什么? 最佳方法是用磁铁将铁屑从沙里吸出而分离。 利用的是黄金和沙的密度不同。思考1.思考2.混合物的分离与提纯 [思考与交流] 如果有铁屑和铜的混合物,你能用哪些方法将铁屑分离除去?淘金者的方法用磁铁吸引铁加盐酸 什么是混合物的分离与提纯 有区 别吗?思考3.混合物的分离与提纯? 分离和提纯: 利用混合物中组分的性质(物理性质,如:溶解性不同等;化学性质,与物质反应的现象不同等)不同,将混合物中的各组分分离开,除去杂质达到提纯所需物质的目的。学与问 在分离和提纯物质时,要除掉杂质。化学上指的杂质都是有害或无价值的吗?请举例说明。混合物的分离与提纯 ①过滤:
②蒸发:1、过滤和蒸发 利用物质的溶解性不同分离难溶物与可溶物。 利用溶液中溶质与溶剂沸点不同加热使溶剂挥发,分离溶质与溶剂。
混合物的分离与提纯 实验名称:粗盐的提纯 实验目的: 除去粗盐中混有的杂质
实验药品与装置:实验步骤:溶解过滤蒸发(泥沙、CaCl2、MgCl2、硫酸盐)粗盐的提纯 粗盐的提纯 如何除去食盐中混有的泥沙?溶解过滤蒸发步骤目的现象注意事项使可溶性物质溶解除去粗盐水中的不溶性杂质从溶液中得到食盐晶体粗盐逐渐溶解得到浑浊的食盐水不溶物留在滤纸上,液体沿漏斗颈流入另一个烧杯中水分蒸发,逐渐析出晶体玻璃棒不断搅拌,以加速食盐溶解 粗盐的提纯 利用上述方法制得的食盐是不是就是纯净的NaCl?如果不是,可能含有什么杂质离子?用什么方法可以检验出它们呢?【思考】 还可能含有Ca2+、Mg2+、SO42-等杂质SO42-的检验: 酸化后,加BaCl2溶液,产生白色沉淀〖实验1-2〗粗盐的提纯 使SO42-、Mg2+、Ca2+反应生成难溶物质沉淀下来。
除SO42-:加稍过量的BaCl2溶液
除Mg2+ :加稍过量的NaOH溶液
除Ca2+ :加稍过量的Na2CO3溶液【解决方案】【提示】 设法将其中可溶性杂质通过化学反应使之转化为沉淀,再一次过滤即可。或转化为气体离开体系也可。 〖思考与交流〗课本第7页粗盐的提纯 【讨论】
除杂时加入的试剂为什么都要稍过量?加入你选择的试剂除掉杂质后,有没有引入其它离子?如有,可用什么方法再把它们除去? Ba2+ 可用 Na2CO3除去
OH- 可用HCl除去
CO32- 可用HCl除去
除杂时引入的离子:Ba2+、OH-、CO32-粗盐的提纯探究实验【练习】 2、为除去粗盐中的Ca2+、Mg2+、SO42-和泥沙,可将粗盐溶于水,再进行下列操作:①过滤②加过量的NaOH溶液③加适量的盐酸④加过量的Na2CO3溶液⑤加过量的BaCl2溶液。正确的排列顺序是___________ _ 1.在进行沉淀实验时,如何认定沉淀已经完全? 取少量上层清液置于小试管中,滴加沉淀剂,如果不再产生沉淀。说明沉淀已经完全。 ①⑤②④①③化学实验基本方法或①②⑤④①③ 【交流小结】 在设计除杂方案时,应考虑哪些方面内容,才能顺利完成实验设计? 1)选择所加试剂化学实验基本方法 2)试剂加入的先后顺序 3)试剂用量 4)试剂过量后如何处理 【除杂原则】 不增 不减 易分 不增加新的杂质不消耗被提纯的物质
如:不能减少NaCl成分 杂质转换为沉淀、气体等易分离
除去。如:将NaCl溶液中可能存
在的Na2SO4转换为沉淀BaSO4简约性化学实验基本方法本课小结 本节课我们学习了:
混合物分离的一些方法: 1.过滤和蒸发——粗盐的提纯 进一步理解了粗盐提纯的方法和步骤:
⑴所需仪器
⑵操作步骤
⑶注意事项
⑷使用玻璃棒的作用和目的
2.SO42-的检验方法 作业
作业:课本P10—3、4、5
第三课时
蒸馏和萃取
第一节 化学实验基本方法
〖课前预习〗 粗盐经过溶解、过滤和蒸发操作得到的氯化钠中仍含有可溶性杂质硫酸盐,可通过加
(填试剂)来检验,简述检验SO42-的操做步骤 ;
实际上,得到的盐中除硫酸盐外,还含有
、 等可溶性杂质。 上一节课,我们学习了粗盐的提纯,在提纯过程中,想想用到过哪几种提纯方法?这些分离方法分别是利用了什么原理?〖课前预习〗 对于液态混合物,我们怎样将其分
离呢?你能想出一些办法吗? 本节课要学习的内容 1.如何从互相溶解的液态混合物中得到其中的某种成分
2.如何把互不相溶的液态混合物分离开来
3.学习几种分离混合物的仪器的使用方法和注意事项
生活中的化学蒸馏和萃取 问题1.如何洗掉刚溅到衣服上的油汤?
——先用酒精或汽油擦洗,再用洗涤剂和水
问题2.如何洗去粘在手上的油漆?
——先用松节油擦洗,再用洗涤剂和水 问题3.纯净水就是蒸馏水吗?【回顾与反思】 阅读并填写课本P8表格—[实验1-3]的相
关内容蒸馏和萃取 自来水中含有较多的杂质,如何除去其中含有的Cl-?
怎样证明得到液体是没有了氯离子的水呢?如果不用加化学试剂的方法,如何除去其中的Cl-? 加入稀HNO3酸化了的AgNO3溶液看是否产生白色浑浊(或白色沉淀) 实验1-3表格 自来水中Cl-的检验
蒸馏——制蒸馏水 检验蒸馏水中是否含有Cl-离子
加AgNO3溶液后,有不溶于稀HNO3的白色沉淀产生
加热,烧瓶中水温升高至100℃
沸腾,在锥形瓶中收集到蒸馏水。
加稀HNO3和AgNO3溶液,蒸馏水中无沉淀。蒸馏和萃取蒸馏——利用混合物中各组分的沸点不同,将
液态混合物中各种成分分离和提纯的方法实验室制取蒸馏水的装置及操作蒸馏和萃取 讨论 酒精和水的混合物能否用蒸馏法分离?先蒸馏出来的是什么物质?蒸馏在生产、生活中的应用酒精的提纯
石油的分馏
海水的淡化蒸馏和萃取生活中的化学 问题1.如何把不小心混在一起的油和水分开?
问题2.碘单质(I2)不易溶于水,但易溶于有机溶剂。如何把碘水中的碘单质提取出来呢?蒸馏和萃取 【从碘水中提取单质碘】
分析实验原理:阅读课本P9[实验1-4]的有关内容 根据同一种溶质在不同溶剂里的溶
解度不同 方法: 操作: 主要仪器:萃取分液分液漏斗 用于分离互不相溶、密度不同的液体混合物蒸馏和萃取常用有机萃取剂 Vs 无机溶剂
汽油
植物油
苯密度比水大
沉于水下层 1.萃取: 四氯化碳 水 用一种溶剂把物质从另一种溶剂所组成的溶液里提取出来的方法。 萃取剂的选择条件:
1、萃取剂与原溶剂要互不相溶
2、溶质在萃取剂中有较大的溶解度
3、萃取剂与原溶剂要有较大的密度差异水蒸馏和萃取 ▲操作注意:
1、使用前必须检漏;
2、萃取过程中要充分振荡,并适当
放气,充分静止,然后分液;
3、分液时保持漏斗内压强与大气压
一致;
4、下层溶液下口出,上层溶液
上口出。 2.分液--分离互不相溶、密度不同的混合 物的方法 思考:酒精能否用来萃取碘水中的碘?蒸馏和萃取过滤蒸发蒸馏萃取1、不可溶性的固体和液体分离——
2、可溶性的固体和液体分离——
3、沸点不同的液体混合物分离——
4、溶解度不同的可溶性混合物分离—本节小结物质分离的几种方法蒸馏和萃取蒸馏和萃取蒸馏和萃取阅读下列材料,按要求回答问题:
酒精、苯、CCl4、煤油都是有机溶剂,有机溶
剂之间大都能互溶;碘(I2)难溶于水,易溶于有
机溶剂,其溶液呈紫色;溴(液溴)的性质与碘相
似,其溶液呈橙色。
1、下列能用分离漏斗分离的是( )
A、液溴和CCl4 B、酒精和煤油
C、CaCl2和Na2SO4溶液 D、苯和蒸馏水 D课堂练习蒸馏和萃取 1.在酒精、苯、CCl4、NaCl溶液、蒸馏水五种试剂中。(1)能把碘单质从碘水中萃取出来的是 ( )
进行分液之后是否已经得到纯净的碘单质?
苯,CCl4不能,还要进一步分离课堂练习蒸馏和萃取 (2)能把溴从溴水中萃取出来,并在分液时溴从分液漏斗上端倒出的是( );萃取时,上层液体呈( )色,
下层液体呈( )色.苯橙无或颜色变浅不能,酒精与CCl4互溶,液体不能分层 (3)CCl4能把碘酒中的碘萃取出来
么?课堂练习蒸馏和萃取 4.用于分离或提纯物质的已学方法有:
A.萃取 B.分液 C.过滤 D.加热分解 E.蒸发 F.蒸馏
下列各组混合物的分离或提纯应选用上述哪种方法最合
适?(把选用方法的标号填入括号内)
(1)除去澄清石灰水中悬浮的Ca(OH)2 颗粒( )
(2)把饱和食盐水中的食盐提取出来 ( )
(3)除去酒精中溶解的微量食盐 ( )
(4)把溴水中的溴提取出来 ( )
(5)用自来水制取医用蒸馏水 ( )
(6)除去氧化钙中的碳酸钙 ( )
(7)分离柴油和水的混合物 ( )BDACEFF课堂练习蒸馏和萃取 5.现有三组溶液:(1)汽油和氯化钠溶液(2)酒精和水的混合溶液;(3)氯化钠和单质溴的溶液。以上混合溶液分离的正确方法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液C课堂练习蒸馏和萃取 6.有A、B两种有机液体的混合物,如果A、B互溶后相互不发生化学反应。在常压下,A的沸点为35℃,B的沸点为200℃。回答下列问题: 用蒸馏方法分离和提纯该混合物,必不
可少的玻璃仪器和用品是
。 冷凝管、锥形瓶、牛角管酒精灯、蒸馏烧瓶、温度计、课堂练习蒸馏和萃取作业:课本P10—6、7
P20—1、2、3
