人教版高中化学必修一:4.1.1无机非金属材料的主角-硅教学课件(47张)
文档属性
| 名称 | 人教版高中化学必修一:4.1.1无机非金属材料的主角-硅教学课件(47张) |  | |
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-11 09:57:19 | ||
图片预览






文档简介
课件47张PPT。 第一节 无机非金属材料 的主角—硅化学①必修 234567自然界中的岩石、沙子、土壤是由什么构成?
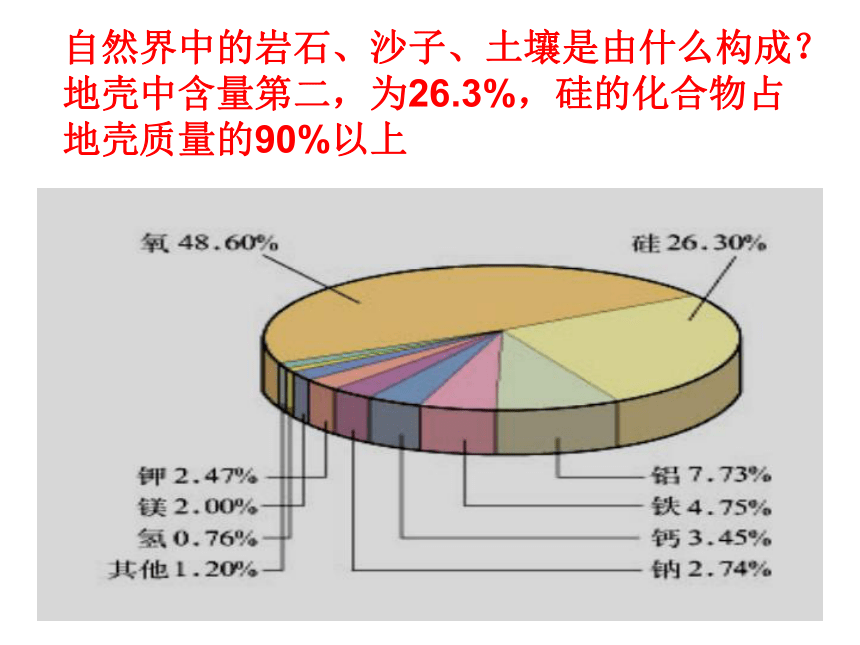
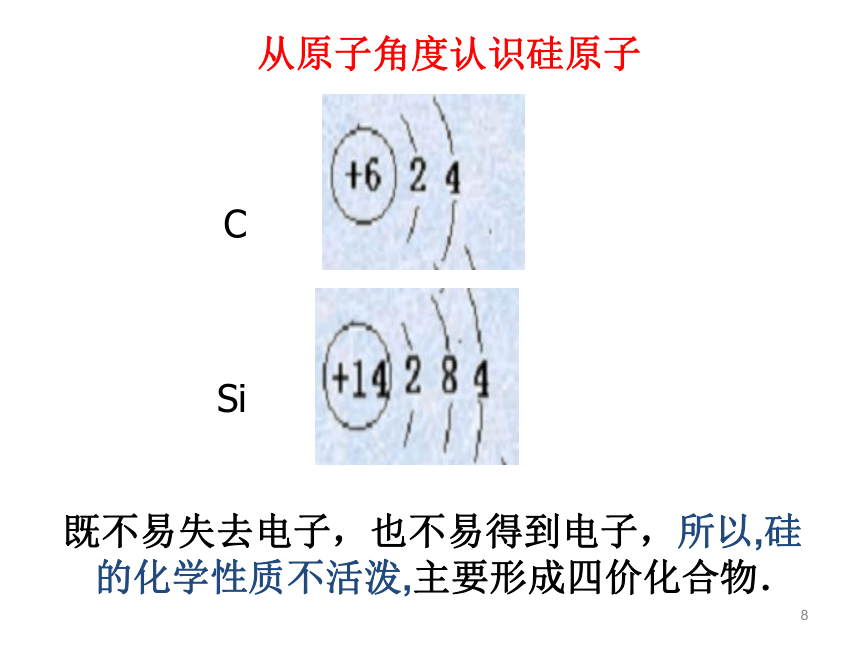
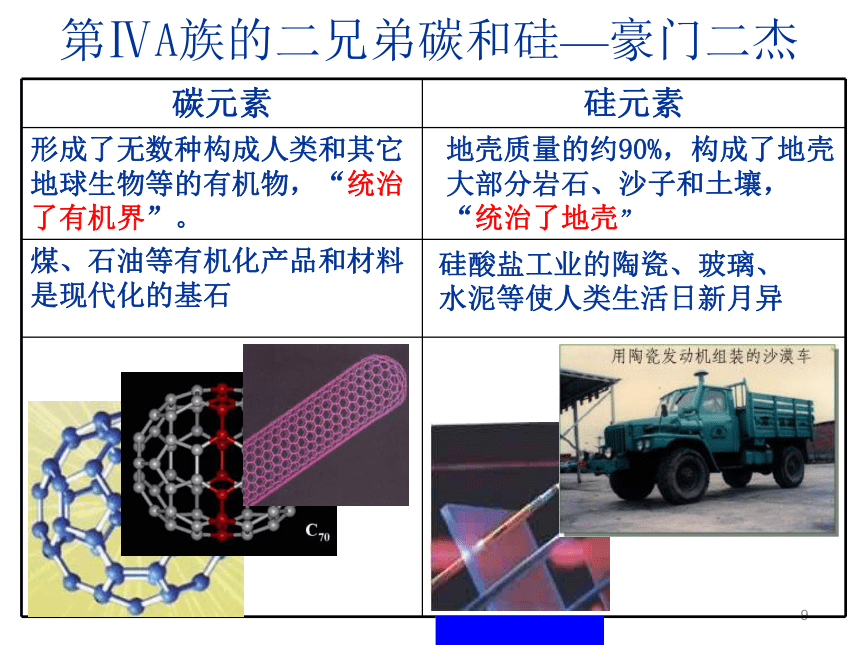
地壳中含量第二,为26.3%,硅的化合物占地壳质量的90%以上8从原子角度认识硅原子CSi既不易失去电子,也不易得到电子,所以,硅的化学性质不活泼,主要形成四价化合物.9第ⅣA族的二兄弟碳和硅—豪门二杰地壳质量的约90%,构成了地壳大部分岩石、沙子和土壤, “统治了地壳”硅酸盐工业的陶瓷、玻璃、水泥等使人类生活日新月异10一、二氧化硅和硅酸 硅是一种亲氧元素,在自然界它总是与氧相互化合。
所以在氧化气氛包围的地球上,硅主要以熔点很高的
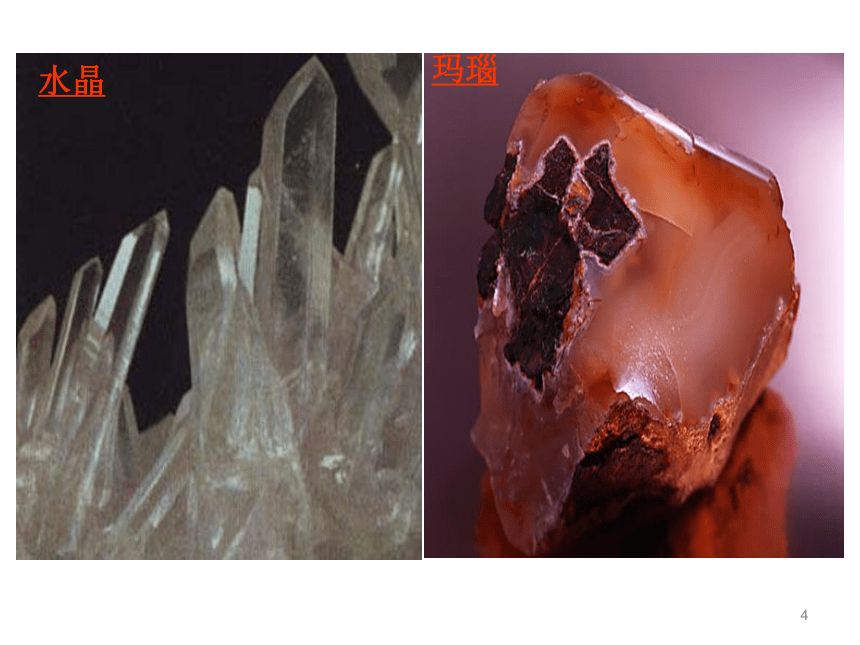
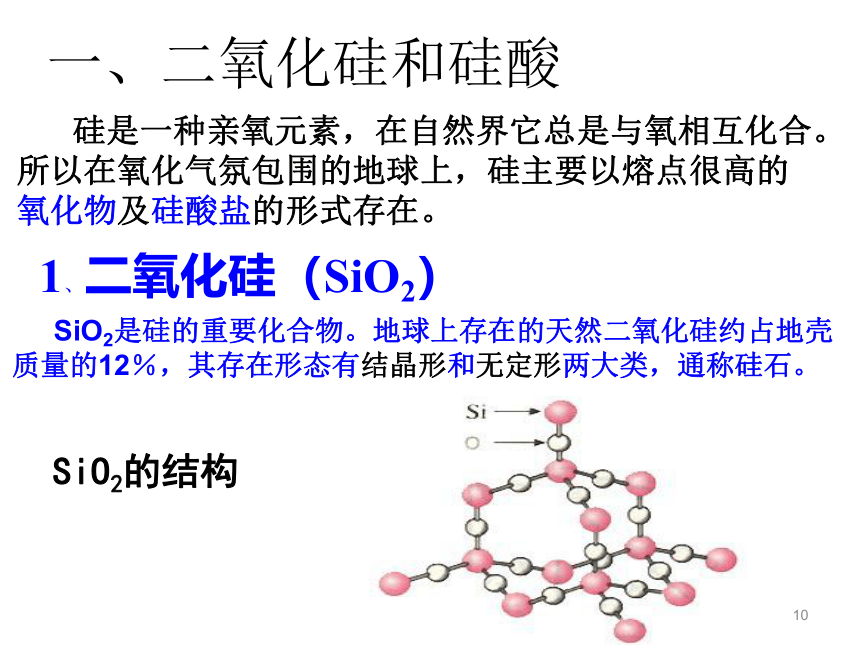
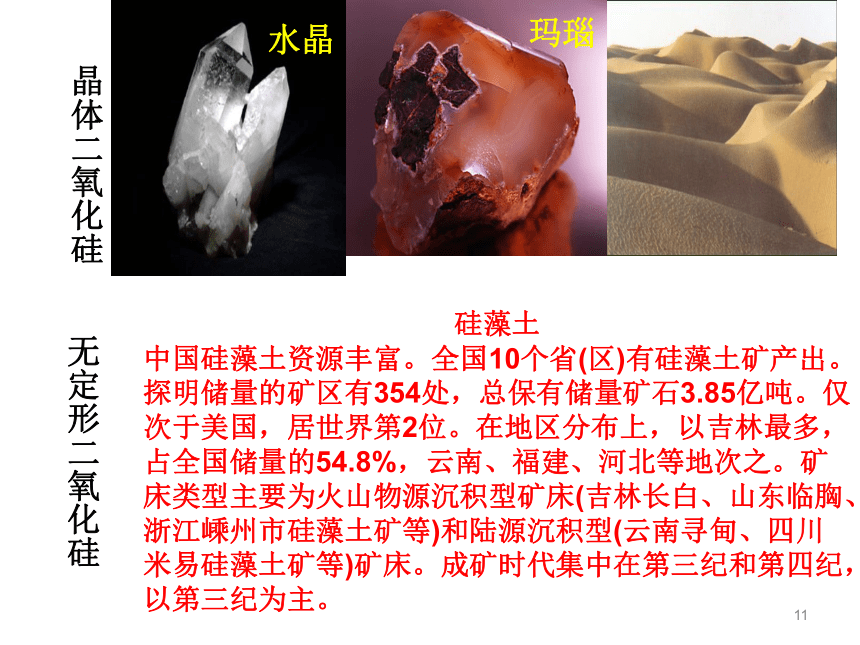
氧化物及硅酸盐的形式存在。1、二氧化硅(SiO2) SiO2是硅的重要化合物。地球上存在的天然二氧化硅约占地壳质量的12%,其存在形态有结晶形和无定形两大类,通称硅石。SiO2的结构11玛瑙水晶晶体二氧化硅硅藻土
中国硅藻土资源丰富。全国10个省(区)有硅藻土矿产出。探明储量的矿区有354处,总保有储量矿石3.85亿吨。仅次于美国,居世界第2位。在地区分布上,以吉林最多,占全国储量的54.8%,云南、福建、河北等地次之。矿床类型主要为火山物源沉积型矿床(吉林长白、山东临胸、浙江嵊州市硅藻土矿等)和陆源沉积型(云南寻甸、四川米易硅藻土矿等)矿床。成矿时代集中在第三纪和第四纪,以第三纪为主。 无定形二氧化硅12光学纤维胃镜二氧化硅的用途13二氧化硅的用途14 坚硬难熔的固体,熔沸点比较高,不溶于水,硬度比较大。(1)物理性质:15(2)化学性质:(a)常温与氢氟酸(SiO2很不活泼,HF是唯一能跟其反应的酸)4HF+SiO2==SiF4↑+2H2O(所以,不能用磨口玻璃塞盛碱性溶液,如NaOH、KOH、Na2CO3、Na2SiO3等溶液。)(b)酸性氧化物的性质SiO2 + 2NaOH == Na2SiO3 + H2OSiO2 + CaO == CaSiO3高温二氧化硅和二氧化碳的比较CO2SiO2表示二氧化碳分子及其组成表示二氧化硅晶体中硅氧原子个数比气态固态很小很大可溶于水不溶于水很低很高172.硅酸(H2SiO3)思考:1.二氧化硅不溶于水,不跟水反应,如何从二氧化硅来制备H2SiO3是一种很弱的酸,比碳酸的酸性还弱Na2SiO3+2HCl=2NaCl+H2SiO3 所生成的硅酸逐渐聚合而形成胶体-硅酸溶胶,硅酸浓度较大时,则形成软而透明的、胶冻状的硅酸凝胶。硅酸凝胶经干燥脱水就形成硅酸干胶,称为“硅胶”。硅胶多孔,吸附水分能力强,常用做实验室和袋装食品、瓶装药品等的干燥剂,也可以用作催化剂的载体。Na2SiO3+H2O+CO2=Na2CO3+H2SiO319二、硅酸盐 硅酸盐是由硅、氧和金属组成的化合物的总称,在自然界分布极广。硅酸盐是一类结构复杂的化合物,一般都不溶于水,化学性质很稳定。
最简单又常用的硅酸盐是硅酸钠(Na2SiO3),其水溶液称为水玻璃,可以作肥皂填料、木材防火剂及黏胶剂等。 20(2)硅酸盐组成的表示用二氧化硅和金属氧化物的形式表示其组成。2122高岭石Al2(Si2O5)(OH)423
要领:两边原子个数守恒
格式:金属氧化物、二氧化硅、水
顺序:金属按活动顺序表拆分原则24K(Al3Si3O10)(OH)2几种硅酸盐产品——陶瓷、玻璃、水泥,最重要的无机非金属材料。玻璃玻璃玻璃原料:纯碱、石灰石、石英
设备:玻璃窑
条件:高温熔融
主要反应:
主要成份:硅酸钠、硅酸钙、二氧化硅
玻璃有色玻璃钢化玻璃加入了不同的金属氧化物普通玻璃加热接近熔化再急速冷却水泥水泥原料:黏土、石灰石、石膏
设备:水泥回转窑
条件:煅烧
主要成份:硅酸三钙、硅酸二钙、铝酸三钙等陶瓷原料:黏土
条件:高温烧结陶器34硅酸盐用途36三、新型无机非金属材料的特性1.能承受高温、强度高。
例如:氮化硅陶瓷在1200℃左右的高温下,
仍具有很高的强度,可用来制造汽轮机叶
片、轴承、永久性模具等。
372.具有电学特性,一些新型无机非金属材料可以作为半导体、导体、超导体等,一些绝缘性材料常被用于集成电路的基板。383.具有光学特性。有些新型无机非金属材料能发出各色的光,有的能透过可见光,有的能使红外线、雷达射线穿过。处于高温下的光导纤维39F-117是一种单座战斗轰炸机。设计目的是凭隐身性能,突破对手火力网,压制对手防空系统,摧毁严密防守的指挥所、战略要地、重要工业目标,还可执行侦察任务,具有一定空战能力。404. 具有生物特性。有些新型无机非金属材料强度高、无毒、不溶于水,对人体组织有较好的适应性,可直接植入人体内,用这类材料制成的人造牙齿、人造骨骼,已被应用在医疗上。
人造关节4142三、硅(Si)硅有晶体硅和无定形硅两种同素异形体物性:化性:1、灰黑色,有金属光泽,硬而
脆的固体
2、熔、沸点高、硬度大
3、晶体硅是良好的半导体常温下,硅的化学性质不活泼,除氢氟酸、氟气、强碱外不跟其他物质如:氧气、氯气、硫酸等起反应,但在加热情况下,硅也能跟一些非金属反应。431、与氟气反应:2、与氢氟酸反应:3、与强碱溶液反应:4、与氯气反应:5、与氧气反应Si+2F2==SiF4Si+4HF==SiF4+2H244存在在自然界中,没游离态的硅,以化合态存在,例如:
硅酸盐等,在地壳中含量居第二位。用途集成电路、晶体管、硅整流器等半导体材料,还可以制成太阳能电池、硅的合金可用来制造变压器铁芯等。集成电路 晶体管45制备工业上:46相应练习1已知硅与强碱氢氧化钠溶液反应的化学方程式为:现把11.5g钠和4.2g硅同时投入100g水中,在标况下
可收集到H2多少L?(提示:与Si反应的NaOH是过
量的)解:Na—1/2H2
23 1/2×22.4
11.5 XSi—2H2
28 2×22.4
4.2 YY=(4.2 ×2 ×22.4)/28=6.72(L)VH2=5.6+6.72=12.32(L)47硅元素单质硅Si + F2
Si + HF
Si + NaOH 加热能与某
些非金属单
质反应(O2、Cl2)
归纳总结
地壳中含量第二,为26.3%,硅的化合物占地壳质量的90%以上8从原子角度认识硅原子CSi既不易失去电子,也不易得到电子,所以,硅的化学性质不活泼,主要形成四价化合物.9第ⅣA族的二兄弟碳和硅—豪门二杰地壳质量的约90%,构成了地壳大部分岩石、沙子和土壤, “统治了地壳”硅酸盐工业的陶瓷、玻璃、水泥等使人类生活日新月异10一、二氧化硅和硅酸 硅是一种亲氧元素,在自然界它总是与氧相互化合。
所以在氧化气氛包围的地球上,硅主要以熔点很高的
氧化物及硅酸盐的形式存在。1、二氧化硅(SiO2) SiO2是硅的重要化合物。地球上存在的天然二氧化硅约占地壳质量的12%,其存在形态有结晶形和无定形两大类,通称硅石。SiO2的结构11玛瑙水晶晶体二氧化硅硅藻土
中国硅藻土资源丰富。全国10个省(区)有硅藻土矿产出。探明储量的矿区有354处,总保有储量矿石3.85亿吨。仅次于美国,居世界第2位。在地区分布上,以吉林最多,占全国储量的54.8%,云南、福建、河北等地次之。矿床类型主要为火山物源沉积型矿床(吉林长白、山东临胸、浙江嵊州市硅藻土矿等)和陆源沉积型(云南寻甸、四川米易硅藻土矿等)矿床。成矿时代集中在第三纪和第四纪,以第三纪为主。 无定形二氧化硅12光学纤维胃镜二氧化硅的用途13二氧化硅的用途14 坚硬难熔的固体,熔沸点比较高,不溶于水,硬度比较大。(1)物理性质:15(2)化学性质:(a)常温与氢氟酸(SiO2很不活泼,HF是唯一能跟其反应的酸)4HF+SiO2==SiF4↑+2H2O(所以,不能用磨口玻璃塞盛碱性溶液,如NaOH、KOH、Na2CO3、Na2SiO3等溶液。)(b)酸性氧化物的性质SiO2 + 2NaOH == Na2SiO3 + H2OSiO2 + CaO == CaSiO3高温二氧化硅和二氧化碳的比较CO2SiO2表示二氧化碳分子及其组成表示二氧化硅晶体中硅氧原子个数比气态固态很小很大可溶于水不溶于水很低很高172.硅酸(H2SiO3)思考:1.二氧化硅不溶于水,不跟水反应,如何从二氧化硅来制备H2SiO3是一种很弱的酸,比碳酸的酸性还弱Na2SiO3+2HCl=2NaCl+H2SiO3 所生成的硅酸逐渐聚合而形成胶体-硅酸溶胶,硅酸浓度较大时,则形成软而透明的、胶冻状的硅酸凝胶。硅酸凝胶经干燥脱水就形成硅酸干胶,称为“硅胶”。硅胶多孔,吸附水分能力强,常用做实验室和袋装食品、瓶装药品等的干燥剂,也可以用作催化剂的载体。Na2SiO3+H2O+CO2=Na2CO3+H2SiO319二、硅酸盐 硅酸盐是由硅、氧和金属组成的化合物的总称,在自然界分布极广。硅酸盐是一类结构复杂的化合物,一般都不溶于水,化学性质很稳定。
最简单又常用的硅酸盐是硅酸钠(Na2SiO3),其水溶液称为水玻璃,可以作肥皂填料、木材防火剂及黏胶剂等。 20(2)硅酸盐组成的表示用二氧化硅和金属氧化物的形式表示其组成。2122高岭石Al2(Si2O5)(OH)423
要领:两边原子个数守恒
格式:金属氧化物、二氧化硅、水
顺序:金属按活动顺序表拆分原则24K(Al3Si3O10)(OH)2几种硅酸盐产品——陶瓷、玻璃、水泥,最重要的无机非金属材料。玻璃玻璃玻璃原料:纯碱、石灰石、石英
设备:玻璃窑
条件:高温熔融
主要反应:
主要成份:硅酸钠、硅酸钙、二氧化硅
玻璃有色玻璃钢化玻璃加入了不同的金属氧化物普通玻璃加热接近熔化再急速冷却水泥水泥原料:黏土、石灰石、石膏
设备:水泥回转窑
条件:煅烧
主要成份:硅酸三钙、硅酸二钙、铝酸三钙等陶瓷原料:黏土
条件:高温烧结陶器34硅酸盐用途36三、新型无机非金属材料的特性1.能承受高温、强度高。
例如:氮化硅陶瓷在1200℃左右的高温下,
仍具有很高的强度,可用来制造汽轮机叶
片、轴承、永久性模具等。
372.具有电学特性,一些新型无机非金属材料可以作为半导体、导体、超导体等,一些绝缘性材料常被用于集成电路的基板。383.具有光学特性。有些新型无机非金属材料能发出各色的光,有的能透过可见光,有的能使红外线、雷达射线穿过。处于高温下的光导纤维39F-117是一种单座战斗轰炸机。设计目的是凭隐身性能,突破对手火力网,压制对手防空系统,摧毁严密防守的指挥所、战略要地、重要工业目标,还可执行侦察任务,具有一定空战能力。404. 具有生物特性。有些新型无机非金属材料强度高、无毒、不溶于水,对人体组织有较好的适应性,可直接植入人体内,用这类材料制成的人造牙齿、人造骨骼,已被应用在医疗上。
人造关节4142三、硅(Si)硅有晶体硅和无定形硅两种同素异形体物性:化性:1、灰黑色,有金属光泽,硬而
脆的固体
2、熔、沸点高、硬度大
3、晶体硅是良好的半导体常温下,硅的化学性质不活泼,除氢氟酸、氟气、强碱外不跟其他物质如:氧气、氯气、硫酸等起反应,但在加热情况下,硅也能跟一些非金属反应。431、与氟气反应:2、与氢氟酸反应:3、与强碱溶液反应:4、与氯气反应:5、与氧气反应Si+2F2==SiF4Si+4HF==SiF4+2H244存在在自然界中,没游离态的硅,以化合态存在,例如:
硅酸盐等,在地壳中含量居第二位。用途集成电路、晶体管、硅整流器等半导体材料,还可以制成太阳能电池、硅的合金可用来制造变压器铁芯等。集成电路 晶体管45制备工业上:46相应练习1已知硅与强碱氢氧化钠溶液反应的化学方程式为:现把11.5g钠和4.2g硅同时投入100g水中,在标况下
可收集到H2多少L?(提示:与Si反应的NaOH是过
量的)解:Na—1/2H2
23 1/2×22.4
11.5 XSi—2H2
28 2×22.4
4.2 YY=(4.2 ×2 ×22.4)/28=6.72(L)VH2=5.6+6.72=12.32(L)47硅元素单质硅Si + F2
Si + HF
Si + NaOH 加热能与某
些非金属单
质反应(O2、Cl2)
归纳总结
