人教版高中化学必修一3.2 铁的重要的金属化合物 课件
文档属性
| 名称 | 人教版高中化学必修一3.2 铁的重要的金属化合物 课件 |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-10 21:04:52 | ||
图片预览







文档简介
课件20张PPT。§3.2.3 铁的重要的金属化合物【学习目标】【重点难点】1.了解铁的重要化合物的主要性质及应用。
2.掌握Fe3+、Fe2+的检验方法,明确Fe3+与Fe2+
的相互转化关系。1. Fe(OH)3、Fe(OH)2的制备及性质。2.检验Fe3+、Fe2+的方法及其相互转化。青藏铁路神舟10号航空母舰杭州湾跨海大桥铁的使用1.存在 铁在地壳中的含量仅次于氧、硅和铝,居第___位,在金属中居第__位.主要以__和__价的化合物存在.三、铁的重要化合物 4 2+2 +32.铁的氧化物铁 红磁性氧化铁黑色粉末红棕色粉末黑色晶体Fe2O3FeOFe3O4+2+3+2,+3 不溶不溶 不溶是是Fe2O3 + 6H+ = 2Fe3+ + 3H2OFeO + 2H+ = Fe2+ + H2OFe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O2.铁的氧化物三、铁的重要化合物 常用做红色油
漆和涂料,
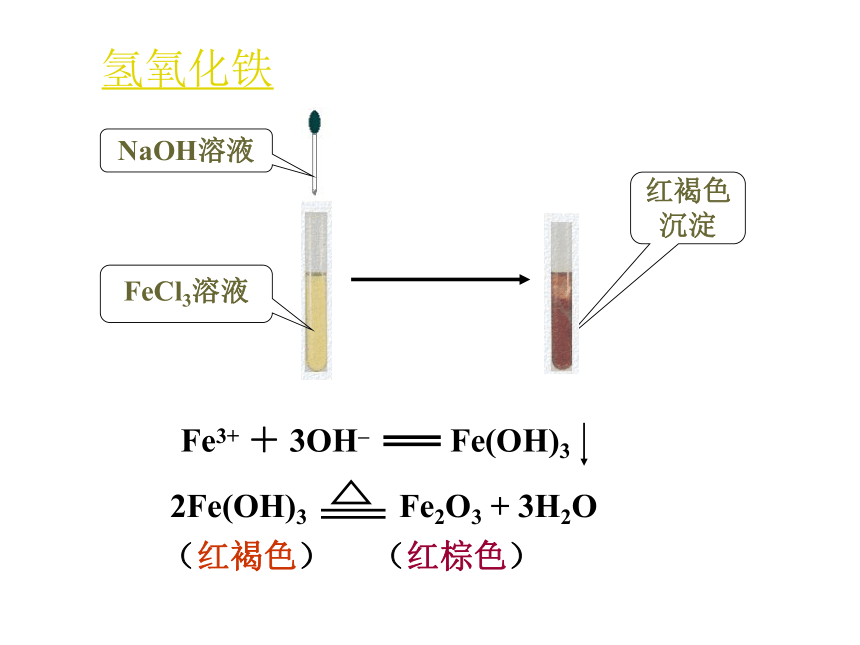
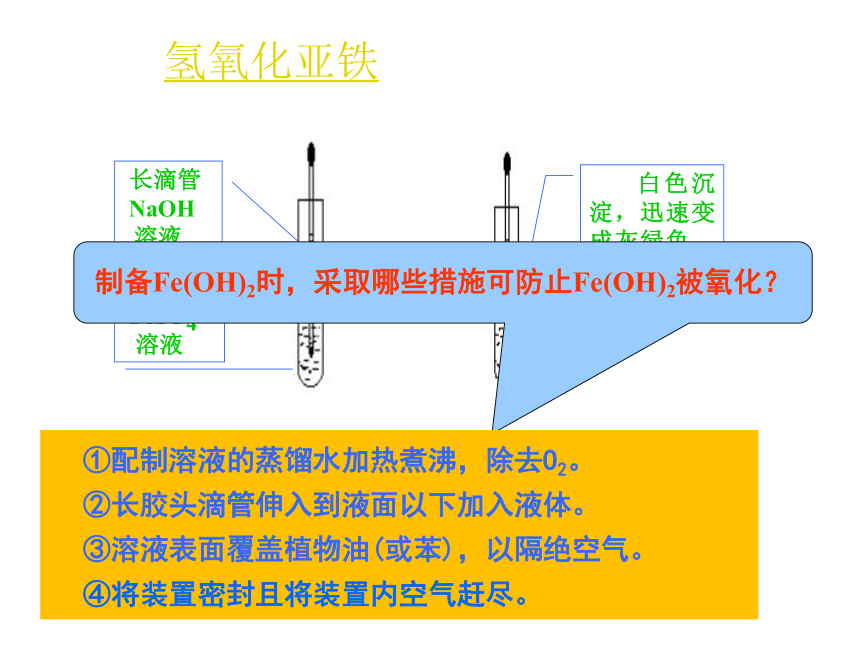
炼铁的原料。炼铁的原料3.铁的氢氧化物——Fe(OH)2、Fe(OH)3 三、铁的重要化合物 实验·探究 在两只试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后逐滴滴入NaOH溶液。观察并描述实验现象。氢氧化铁(红褐色) (红棕色)氢氧化亚铁制备Fe(OH)2时,采取哪些措施可防止Fe(OH)2被氧化?①配制溶液的蒸馏水加热煮沸,除去O2。
②长胶头滴管伸入到液面以下加入液体。
③溶液表面覆盖植物油(或苯),以隔绝空气。
④将装置密封且将装置内空气赶尽。【例】下列各图示中能较长时间看到Fe(OH)2白色沉淀的是
__________。①② ④③ ④产生红褐色的沉淀先有白色的沉淀,迅速变成灰绿色,最后变成红褐色。Fe3+ + 3OH- = Fe(OH)3↓Fe2+ + 2OH- = Fe(OH)2↓4Fe(OH)2+O2+2H2O =4Fe(OH)33.铁的氢氧化物——Fe(OH)2、Fe(OH)3 白色固体红褐色固体Fe(OH)2+2H+ = Fe2++2H2OFe(OH)3+3H+ = Fe3++3H2OFe2++ 2OH- = Fe(OH)2↓Fe3++3OH- = Fe(OH)3 ↓4Fe(OH)2+O2+2H2O = 4Fe(OH)3Fe(OH)2、Fe(OH)3 的比较不溶不溶Fe(OH)2==FeO+H2O△隔绝空气不稳定,在空气中易被氧化。
4Fe(OH)2+O2+2H2O=4Fe(OH)3不稳定(较Fe(OH)2稳定)
受热分解4.铁盐和亚铁盐三、铁的重要化合物 (1)Fe2+和Fe3+的检验Fe2+和Fe3+的检验有哪些方法?直接观色加KSCN溶液加NaOH溶液 浅绿色 棕黄色白色沉淀迅速变灰绿色最后呈红褐色 立即产生
红褐色沉淀溶液呈血红色 无现象实验·探究3.铁盐和亚铁盐三、铁的重要化合物 (1)Fe2+和Fe3+的检验(2)Fe2+和Fe3+的相互转化在盛有氯化铁溶液的试管中,加入过量铁粉,振荡,充分反应后,滴加几滴KSCN溶液,有什么现象?再加几滴氯水又发生什么变化?溶液由黄色变为淡绿色,加KSCN溶液没有明显变化,加氯水后溶液变为红色。2FeCl3+Fe = 3FeCl2
2FeCl2+Cl2 = 2FeCl3 Fe2+ Fe3+Cl2、H2O2、KMnO4Fe、Cu实验·探究思考·交流配制及保存FeSO4溶液时,需注意什么?在溶液中加入少量铁粉,防止Fe2+被氧化成Fe3+。小 结小 结Fe2+Fe3+Fe强氧化剂弱氧化剂强氧化剂弱还原剂强氧化剂:
弱氧化剂:强还原剂:
弱还原剂:强还原剂强还原剂Cl2、O2、Br2、HNO3、H2O2、KMnO4(H+)等H+ 、Cu2+ 、S 、 Fe3+等Al、Zn、H2、C、CO等Fe、Cu、S2-、SO32-、I-等 在科学上没有平坦的大道,只有不畏劳苦沿着陡峭山路攀登的人,才有希望达到光辉的顶点。
──马克思
2.掌握Fe3+、Fe2+的检验方法,明确Fe3+与Fe2+
的相互转化关系。1. Fe(OH)3、Fe(OH)2的制备及性质。2.检验Fe3+、Fe2+的方法及其相互转化。青藏铁路神舟10号航空母舰杭州湾跨海大桥铁的使用1.存在 铁在地壳中的含量仅次于氧、硅和铝,居第___位,在金属中居第__位.主要以__和__价的化合物存在.三、铁的重要化合物 4 2+2 +32.铁的氧化物铁 红磁性氧化铁黑色粉末红棕色粉末黑色晶体Fe2O3FeOFe3O4+2+3+2,+3 不溶不溶 不溶是是Fe2O3 + 6H+ = 2Fe3+ + 3H2OFeO + 2H+ = Fe2+ + H2OFe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O2.铁的氧化物三、铁的重要化合物 常用做红色油
漆和涂料,
炼铁的原料。炼铁的原料3.铁的氢氧化物——Fe(OH)2、Fe(OH)3 三、铁的重要化合物 实验·探究 在两只试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后逐滴滴入NaOH溶液。观察并描述实验现象。氢氧化铁(红褐色) (红棕色)氢氧化亚铁制备Fe(OH)2时,采取哪些措施可防止Fe(OH)2被氧化?①配制溶液的蒸馏水加热煮沸,除去O2。
②长胶头滴管伸入到液面以下加入液体。
③溶液表面覆盖植物油(或苯),以隔绝空气。
④将装置密封且将装置内空气赶尽。【例】下列各图示中能较长时间看到Fe(OH)2白色沉淀的是
__________。①② ④③ ④产生红褐色的沉淀先有白色的沉淀,迅速变成灰绿色,最后变成红褐色。Fe3+ + 3OH- = Fe(OH)3↓Fe2+ + 2OH- = Fe(OH)2↓4Fe(OH)2+O2+2H2O =4Fe(OH)33.铁的氢氧化物——Fe(OH)2、Fe(OH)3 白色固体红褐色固体Fe(OH)2+2H+ = Fe2++2H2OFe(OH)3+3H+ = Fe3++3H2OFe2++ 2OH- = Fe(OH)2↓Fe3++3OH- = Fe(OH)3 ↓4Fe(OH)2+O2+2H2O = 4Fe(OH)3Fe(OH)2、Fe(OH)3 的比较不溶不溶Fe(OH)2==FeO+H2O△隔绝空气不稳定,在空气中易被氧化。
4Fe(OH)2+O2+2H2O=4Fe(OH)3不稳定(较Fe(OH)2稳定)
受热分解4.铁盐和亚铁盐三、铁的重要化合物 (1)Fe2+和Fe3+的检验Fe2+和Fe3+的检验有哪些方法?直接观色加KSCN溶液加NaOH溶液 浅绿色 棕黄色白色沉淀迅速变灰绿色最后呈红褐色 立即产生
红褐色沉淀溶液呈血红色 无现象实验·探究3.铁盐和亚铁盐三、铁的重要化合物 (1)Fe2+和Fe3+的检验(2)Fe2+和Fe3+的相互转化在盛有氯化铁溶液的试管中,加入过量铁粉,振荡,充分反应后,滴加几滴KSCN溶液,有什么现象?再加几滴氯水又发生什么变化?溶液由黄色变为淡绿色,加KSCN溶液没有明显变化,加氯水后溶液变为红色。2FeCl3+Fe = 3FeCl2
2FeCl2+Cl2 = 2FeCl3 Fe2+ Fe3+Cl2、H2O2、KMnO4Fe、Cu实验·探究思考·交流配制及保存FeSO4溶液时,需注意什么?在溶液中加入少量铁粉,防止Fe2+被氧化成Fe3+。小 结小 结Fe2+Fe3+Fe强氧化剂弱氧化剂强氧化剂弱还原剂强氧化剂:
弱氧化剂:强还原剂:
弱还原剂:强还原剂强还原剂Cl2、O2、Br2、HNO3、H2O2、KMnO4(H+)等H+ 、Cu2+ 、S 、 Fe3+等Al、Zn、H2、C、CO等Fe、Cu、S2-、SO32-、I-等 在科学上没有平坦的大道,只有不畏劳苦沿着陡峭山路攀登的人,才有希望达到光辉的顶点。
──马克思
