人教版高中化学必修一第四章第四节氨 硝酸硫酸 课件 ( 1-3课时)(55张)
文档属性
| 名称 | 人教版高中化学必修一第四章第四节氨 硝酸硫酸 课件 ( 1-3课时)(55张) |  | |
| 格式 | zip | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-11 10:18:33 | ||
图片预览










文档简介
课件55张PPT。第四节 氨 硝酸 硫酸 第一课时 氨 铵盐一、氨(NH3) 哈伯合成氨与
诺贝尔化学奖握手。氮的固定与工业合成氨一、氨气的物理性质:△无色有刺激性气味的气体△密度比空气小,
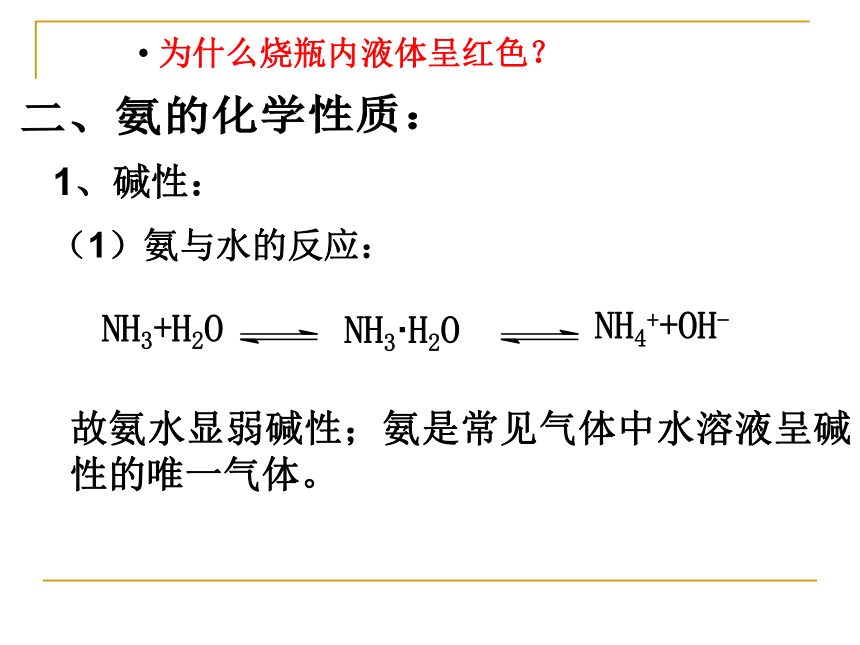
ρ(NH3)∶ ρ(空气)=17∶29△极易溶于水,体积比1∶700△标况下,沸点-33.5℃,加压易液化实验(4-8)—— 喷泉实验 如图4-27,在干燥的圆底烧瓶里充满氨,用带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶口。倒置烧瓶,使玻璃管插入盛有水的烧瓶(预先在水里滴入少量的酚酞溶液)。轻轻挤压滴管使少量的水进入烧瓶。观察并描述现象。实验现象: 烧杯里的水由玻璃管进入烧瓶,形成喷泉;烧瓶内液体呈红色。思考:1、为什么形成会喷泉?
2、为什么烧瓶内液体呈
红色? 实验(4-8)—— 喷泉实验 由于氨极易溶于水,挤压滴管胶头,少量的水可溶大量的氨(1:700),使烧瓶内压强迅速减小,外界大气压将烧杯中的水压入。产生足够的压强差。为什么形成会喷泉?关键①溶解度很大的气体 ②气体与吸收剂几乎完全反应又不生成气体(或产生气体的量很少)。(如CO2和NaOH、Cl2与 NaOH 等)思考:什么气体在什么条件下可形成喷泉?(如HCl、NH3、SO2等)使烧瓶内气体进入溶液思考与练习 某学生用氨做喷泉实验,结果实验失败,请
你分析实验失败的可能原因? 氨气中含有大量的空气 收集氨气的烧瓶潮湿 装置漏气(1)氨与水的反应:二、氨的化学性质:1、碱性:故氨水显弱碱性;氨是常见气体中水溶液呈碱性的唯一气体。
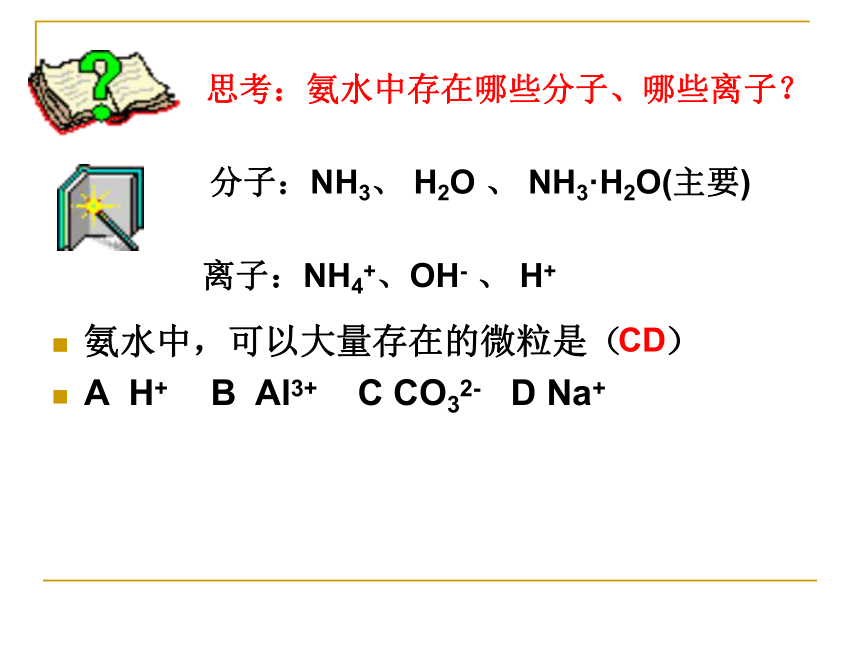
为什么烧瓶内液体呈红色?思考:氨水中存在哪些分子、哪些离子?分子:NH3、 H2O 、 NH3·H2O(主要)离子:NH4+、OH- 、 H+ 氨水中,可以大量存在的微粒是( )
A H+ B Al3+ C CO32- D Na+ CD(2)氨与酸的反应
生成铵盐:NH3 + HCl = NH4Cl
为什么蘸有浓氨水的玻璃棒和蘸有浓盐酸的玻璃棒不接触就能放出白烟?思考:练习:写出氨气分别与硫酸和硝酸反应的化学方程式。如何检验NH3?
根据:碱性!
(1)湿润的红色石蕊试纸:试纸变蓝
(2)靠近醮取浓盐酸的玻璃棒:有白烟
2、氨具有还原性NH3 中氮元素的价态分析(只有 ?性)
P98. “思考与交流”
1、工业制硝酸的每一步反应中氮元素被( )
2、
3、试写出其余反应的化学方程式:2NO + O2 = 2NO2 3NO2 + H2O = 2HNO3 + NO(工业制氨)工业制硝酸由铵根离子和酸根离子构成的化合物。1、物理性质:都是晶体,都易溶于水。铵盐2、铵盐化学性质:(1)受热易分解:NH3↑+HCl↑NH3 ↑+H2O↑ +CO2↑2NH3↑+H2O ↑+CO2 ↑规律:铵盐受热易分解生成NH3。(2)铵盐与碱反应①②规律:铵盐都与强碱在加热条件下反应放出
氨气。
如何检验NH4+
转化成NH3……
△铵盐与碱共热可以产生氨气这一原理,可用于检验铵根离子小结一、氨
1、物理性质:无色,有刺激性气味,易溶于水的气体,密度比空气小
2、化学性质:
(1)碱性 A与水反应 B 与酸反应
(2)还原性
二、铵盐:易溶于水的晶体
1、不稳定
2、与碱混合受热生成氨三、氨气的制取:(1)药品:氯化铵晶体、消石灰固体(2)原理:2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑(3)装置:固+固,加热型(与氧气的制取装置相同)(4)收集:向下排空气法(5)验满:②蘸有浓HCl的玻璃棒接近
试管口产生白烟。①湿润的红色石蕊试纸变蓝
(常见气体中唯一的一种碱性气体);思考:?棉花的作用:防止对流,提高集气速度和纯度。?干燥氨气的常用试剂:①CaO、碱石灰等碱性干燥剂
②不能用无水CaCl2来干燥NH3(形成CaCl2· 8NH3)
NaOH和CaO的混合物四、氨的用途:氨的用途制氮肥
铵盐
制硝酸
纯碱
有机合成
工业原料致冷剂小结1、氨的实验室制法
2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑②蘸有浓HCl的玻璃棒接近试管口,产生白烟。2、验满:
①湿润的红色石蕊试纸变蓝
(常见气体中唯一的一种碱性气体);1、能形成喷泉实验且最终几乎充满烧瓶的是下面哪一组( ) 【课堂练习】BD2.只用一种试剂,就可区别NH4Cl 、 (NH4)2SO4 、 KCl Na2SO4 、 AlCl3 五种无色溶液,这种试剂是( )
(A)NaOH溶液 (B)AgNO3溶液
(C)BaCl2溶液 (D)Ba(OH)2溶液课堂检测DB3.下列物质可以用加热的方法分离的是( ) A. I2、 NH4ClB. NaCl、 NH4ClC. Ca(OH)2、 NH4ClD. Cu、 CuO硫酸(第3课时)想一想纯净硫酸的物理性质1、无色、透明、粘稠、油状液体2、高沸点、难挥发性强酸3、易溶于水,溶解时放出大量的热交流与思考4、浓硫酸的质量分数为98.3%,
浓度为18.4mol/L稀硫酸有怎样的化学性质呢?指示剂反应(石蕊变红)与碱反应(生成对应的盐)与碱性氧化物反应(生成对应的盐)与金属反应(生成对应的盐)与盐反应(生成对应的盐) 硫酸容易电离,在水溶液中可电离出H+,具有酸的通性。Zn+ H2SO4= ZnSO4+H2↑CuO + H2SO4= CuSO4+H2O2NaOH + H2SO4= Na2SO4+2H2ONa2CO3 + H2SO4= Na2SO4+H2O+CO2 ↑自身特性浓硫酸具有酸性的同时也有自身的特性浓硫酸与稀硫酸化学性质是否相同呢?分别用玻璃棒在纸上点上稀硫酸、浓硫酸,
观察现象,并进行对比。无明显现象白纸变黑浓硫酸能脱去纸中的水,使之变黑按水的组成比例脱去纸、棉布、木条等
有机物中的氢、氧元素,使之“炭化”如:使白纸(主要成分纤维(C6H10O5)n)变黑,
使棉花变黑与铜单质的反应不反应实验4-9品红溶液褪色,反应后生
成物的水溶液显蓝色。浓H2SO4在加热条件下与铜单质反应浓硫酸做______剂体现浓硫酸的________________性氧化氧化性和酸性 浓硫酸能与一些不活泼金属在加热条件下
反应如:Cu、Ag等,但Au、Pt不与浓硫酸反应。0+6+6+4+2 在常温下,浓H2SO4能使铁、铝等金属表面
生成一层致密的氧化物保护膜,阻止内部金
属继续跟硫酸起反应。此现象称 “钝化”。钝化体现浓H2SO4的强氧化性加热下,氧化物能被热的浓硫酸氧化。“黑面包” 在烧杯中放入少量蔗糖,用少量水调成糊状,注入浓硫酸,用玻棒搅拌。现象:蔗糖变黑,体积膨胀,放出大量热,放出有刺激性气味的气体。原理:体现浓H2SO4的__________________性脱水性和强氧化怎样证明碳与浓硫酸反应生成CO2、SO2?SO2
CO2褪色变浅不褪色变浑浊检验
SO2吸收
SO2检验
SO2
已被
吸收
完检验
CO2蓝色晶体变为白色 浓硫酸直接与水分子结合,一般结合溶液或
气体中的水分子、晶体中的结晶水。常做干燥剂。浓硫酸与结晶水结合,使变为无水硫酸铜浓硫酸能干燥_________________________的气体酸性且没有还原性的气体不能干燥NH3、H2S、HBr、HIH2S + H2SO4 (浓) = S ↓ + SO2 ↑ + 2H2O特性:
浓H2SO4虽然具有强氧化性,
SO2具有强的还原性,但是它们
不反应,因为同种元素的相邻价
态间,不发生化学反应。浓硫酸是否能干燥SO2气体呢?课堂检测1、下列现象和用途体现浓硫酸脱水性的是( )
A、实验室制取氯气、用浓硫酸做干燥剂
B、浓硫酸加到蔗糖中,蔗糖变黑
C、浓硫酸加到胆矾上,蓝色晶体变为白色
D、浓硫酸敞口放置,质量增加B吸水性吸水性吸水性浓硫酸的吸水性和脱水性有什么区别?吸水性是指与水结合吸收现成的水或结晶水脱水性是指将有机物中的氢、氧元素脱出成水反应生成水2、指出下列事实和现象中,硫酸体现的性质
(1)浓硫酸露置在空气中,浓度减小( )
吸水性(2)浓硫酸使硫酸铜晶体由蓝变白( )
(3)浓硫酸使蔗糖炭化变黑 ( )
(4)工业上用铁槽车或铝槽车运输浓硫酸( )
(5)浓硫酸与木炭反应 ( )
(6)浓硫酸与铜反应制取硫酸铜( )
(7)实验室用锌粒反应制取氢气 ( )吸水性脱水性强氧化性强氧化性酸性和强氧化性酸性和氧化性(8)浓硫酸与Na2SO3反应制取SO2( )酸性(9)浓H2SO4和浓HCl混合可以快速制HCl气体 吸水性、溶解放热浓硫酸的特性:1、吸水性—2、脱水性—3、强氧化性干燥剂H、O两原子按水的组成比 2:1脱去。与某些金属(不活泼Cu)反应{与某些固态非金属单质(C)反应课堂总结以上使浓硫酸具有很强烈的腐蚀性2、加热时—— 与绝大多数金属反应1、浓硫酸被 __为 ____,不置换产 。—— 与活泼金属(如Zn)反应3、常温下发生钝化表面生成 .Al、Fe与 的 硫酸接触钝化条件:H2还原SO2致密的氧化物薄膜冷浓浓硫酸与金属反应的规律:用干布迅速抹去,并用大量水冲冼,
再涂3%~5%的NaHCO3溶液。生活小知识浓硫酸不小心滴在皮肤上,应如何处理?硝酸(第4课时)课前复习以下现象体现浓硫酸的怎样的化学性质?1 、浓硫酸与Na2SO3反应制取SO22 、浓硫酸使胆矾变白3 、蔗糖中滴入浓硫酸变黑,闻到刺激性气味4 、铁制品可以盛装冷的浓H2SO45、浓H2SO4和浓HCl混合可以快速制HCl气体酸性吸水性脱水性
氧化性强氧化性 吸水性、溶解放热交流与思考下列酸与金属是否反应,主要的产物是什么???反应 H2不反应反应 H2不反应反应 SO2加热反应 SO2不反应反应 H2 纯硝酸是无色、易挥发、有刺激性气味的液体,密度为1.5027g/cm3,沸点是83℃,常用浓硝酸质量分数为69%,98%以上的硝酸叫发烟硝酸。硝酸的物理性质“模仿秀”As we know,浓硫酸有强氧化性,浓硝酸、稀硝酸呢?
一、与铜反应
样板:浓硫酸+铜
模仿内容1:推测浓硝酸与铜、稀硝酸与铜的反应产物。
Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑+ 2H2O3Cu +8HNO3(稀) = 3Cu(NO3)2 + 2NO↑+ 4H2O0+2+4+50+2+2+5酸性和强氧化性酸性和强氧化性一般来说:浓硝酸的氧化性强于稀硝酸硝酸与金属反应规律硝酸能与除铂、金外的所有金属反应,一般不生成H2▲①与不活泼金属反应,生成高价金属的硝酸盐。
浓HNO3还原成NO2,稀HNO3还原成NO.②与活泼金属反应,硝酸的还原产物很复杂,
可能是以下的物质二、与铁反应:钝化模仿2:浓硝酸与铁反应样板:浓硫酸与铁反应:钝化:在常温下, Fe和Al遇浓HNO3、浓H2SO4
都会发生在金属表面形成致密的氧化膜,
阻止酸进一步腐蚀金属。请写出稀HNO3与少量Fe的反应方程式Fe + 4HNO3(稀) = Fe(NO3)3 + NO↑+ 2H2O铁粉少量模仿3:稀硝酸与铁呢?请写出稀HNO3与过量Fe的反应方程式Fe + 4HNO3(稀) = Fe(NO3)3 + NO↑+ 2H2O3Fe + 8HNO3(稀) = 3Fe(NO3)2 + 2NO↑+ 4H2O铁粉少量铁粉过量Fe + 2Fe(NO3)3 = 3Fe(NO3)2模仿3:稀硝酸与铁呢?推荐:
王水:若将浓HNO3和浓HCl按体积比1 : 3混合所得混合物,可溶解不活泼金属如金、铂等。三、与C反应样板:浓硫酸与C反应模仿4:浓硝酸与C反应:随堂练习1、为了除去铝制品表面的铜镀层,宜选用的试剂是
( )
A、浓硫酸 B、稀硫酸
C、稀硝酸 D、浓硝酸D2、Cu与稀HNO3反应时,如果有1mol Cu参加反应,
下列说法正确的是 ( )
A、有3/8的HNO3被还原
B、实际上产生NO为2/3mol
C、有1/4的HNO3体现酸性
D、有2mol电子发生转移BD硝酸有强氧化性外,还具有以下的化学性质1)酸的通性2)不稳定性思考:常用的浓硝酸为什么会呈黄色?浓硝酸易分解生成红棕色NO2溶于硝酸3) 强氧化性:与非金属(C、S、P等)反应C + 4HNO3 = CO2↑+ 4NO2↑+ 2H2O课堂总结1)酸的通性2)不稳定性C + 4HNO3 = CO2↑+ 4NO2↑+ 2H2O ②与金属(Cu、Fe)反应 Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑+ 2H2O3Cu +8HNO3(稀) = 3Cu(NO3)2 + 2NO↑+ 4H2O3) 强氧化性:①与非金属(C、S、P等)反应
诺贝尔化学奖握手。氮的固定与工业合成氨一、氨气的物理性质:△无色有刺激性气味的气体△密度比空气小,
ρ(NH3)∶ ρ(空气)=17∶29△极易溶于水,体积比1∶700△标况下,沸点-33.5℃,加压易液化实验(4-8)—— 喷泉实验 如图4-27,在干燥的圆底烧瓶里充满氨,用带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶口。倒置烧瓶,使玻璃管插入盛有水的烧瓶(预先在水里滴入少量的酚酞溶液)。轻轻挤压滴管使少量的水进入烧瓶。观察并描述现象。实验现象: 烧杯里的水由玻璃管进入烧瓶,形成喷泉;烧瓶内液体呈红色。思考:1、为什么形成会喷泉?
2、为什么烧瓶内液体呈
红色? 实验(4-8)—— 喷泉实验 由于氨极易溶于水,挤压滴管胶头,少量的水可溶大量的氨(1:700),使烧瓶内压强迅速减小,外界大气压将烧杯中的水压入。产生足够的压强差。为什么形成会喷泉?关键①溶解度很大的气体 ②气体与吸收剂几乎完全反应又不生成气体(或产生气体的量很少)。(如CO2和NaOH、Cl2与 NaOH 等)思考:什么气体在什么条件下可形成喷泉?(如HCl、NH3、SO2等)使烧瓶内气体进入溶液思考与练习 某学生用氨做喷泉实验,结果实验失败,请
你分析实验失败的可能原因? 氨气中含有大量的空气 收集氨气的烧瓶潮湿 装置漏气(1)氨与水的反应:二、氨的化学性质:1、碱性:故氨水显弱碱性;氨是常见气体中水溶液呈碱性的唯一气体。
为什么烧瓶内液体呈红色?思考:氨水中存在哪些分子、哪些离子?分子:NH3、 H2O 、 NH3·H2O(主要)离子:NH4+、OH- 、 H+ 氨水中,可以大量存在的微粒是( )
A H+ B Al3+ C CO32- D Na+ CD(2)氨与酸的反应
生成铵盐:NH3 + HCl = NH4Cl
为什么蘸有浓氨水的玻璃棒和蘸有浓盐酸的玻璃棒不接触就能放出白烟?思考:练习:写出氨气分别与硫酸和硝酸反应的化学方程式。如何检验NH3?
根据:碱性!
(1)湿润的红色石蕊试纸:试纸变蓝
(2)靠近醮取浓盐酸的玻璃棒:有白烟
2、氨具有还原性NH3 中氮元素的价态分析(只有 ?性)
P98. “思考与交流”
1、工业制硝酸的每一步反应中氮元素被( )
2、
3、试写出其余反应的化学方程式:2NO + O2 = 2NO2 3NO2 + H2O = 2HNO3 + NO(工业制氨)工业制硝酸由铵根离子和酸根离子构成的化合物。1、物理性质:都是晶体,都易溶于水。铵盐2、铵盐化学性质:(1)受热易分解:NH3↑+HCl↑NH3 ↑+H2O↑ +CO2↑2NH3↑+H2O ↑+CO2 ↑规律:铵盐受热易分解生成NH3。(2)铵盐与碱反应①②规律:铵盐都与强碱在加热条件下反应放出
氨气。
如何检验NH4+
转化成NH3……
△铵盐与碱共热可以产生氨气这一原理,可用于检验铵根离子小结一、氨
1、物理性质:无色,有刺激性气味,易溶于水的气体,密度比空气小
2、化学性质:
(1)碱性 A与水反应 B 与酸反应
(2)还原性
二、铵盐:易溶于水的晶体
1、不稳定
2、与碱混合受热生成氨三、氨气的制取:(1)药品:氯化铵晶体、消石灰固体(2)原理:2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑(3)装置:固+固,加热型(与氧气的制取装置相同)(4)收集:向下排空气法(5)验满:②蘸有浓HCl的玻璃棒接近
试管口产生白烟。①湿润的红色石蕊试纸变蓝
(常见气体中唯一的一种碱性气体);思考:?棉花的作用:防止对流,提高集气速度和纯度。?干燥氨气的常用试剂:①CaO、碱石灰等碱性干燥剂
②不能用无水CaCl2来干燥NH3(形成CaCl2· 8NH3)
NaOH和CaO的混合物四、氨的用途:氨的用途制氮肥
铵盐
制硝酸
纯碱
有机合成
工业原料致冷剂小结1、氨的实验室制法
2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑②蘸有浓HCl的玻璃棒接近试管口,产生白烟。2、验满:
①湿润的红色石蕊试纸变蓝
(常见气体中唯一的一种碱性气体);1、能形成喷泉实验且最终几乎充满烧瓶的是下面哪一组( ) 【课堂练习】BD2.只用一种试剂,就可区别NH4Cl 、 (NH4)2SO4 、 KCl Na2SO4 、 AlCl3 五种无色溶液,这种试剂是( )
(A)NaOH溶液 (B)AgNO3溶液
(C)BaCl2溶液 (D)Ba(OH)2溶液课堂检测DB3.下列物质可以用加热的方法分离的是( ) A. I2、 NH4ClB. NaCl、 NH4ClC. Ca(OH)2、 NH4ClD. Cu、 CuO硫酸(第3课时)想一想纯净硫酸的物理性质1、无色、透明、粘稠、油状液体2、高沸点、难挥发性强酸3、易溶于水,溶解时放出大量的热交流与思考4、浓硫酸的质量分数为98.3%,
浓度为18.4mol/L稀硫酸有怎样的化学性质呢?指示剂反应(石蕊变红)与碱反应(生成对应的盐)与碱性氧化物反应(生成对应的盐)与金属反应(生成对应的盐)与盐反应(生成对应的盐) 硫酸容易电离,在水溶液中可电离出H+,具有酸的通性。Zn+ H2SO4= ZnSO4+H2↑CuO + H2SO4= CuSO4+H2O2NaOH + H2SO4= Na2SO4+2H2ONa2CO3 + H2SO4= Na2SO4+H2O+CO2 ↑自身特性浓硫酸具有酸性的同时也有自身的特性浓硫酸与稀硫酸化学性质是否相同呢?分别用玻璃棒在纸上点上稀硫酸、浓硫酸,
观察现象,并进行对比。无明显现象白纸变黑浓硫酸能脱去纸中的水,使之变黑按水的组成比例脱去纸、棉布、木条等
有机物中的氢、氧元素,使之“炭化”如:使白纸(主要成分纤维(C6H10O5)n)变黑,
使棉花变黑与铜单质的反应不反应实验4-9品红溶液褪色,反应后生
成物的水溶液显蓝色。浓H2SO4在加热条件下与铜单质反应浓硫酸做______剂体现浓硫酸的________________性氧化氧化性和酸性 浓硫酸能与一些不活泼金属在加热条件下
反应如:Cu、Ag等,但Au、Pt不与浓硫酸反应。0+6+6+4+2 在常温下,浓H2SO4能使铁、铝等金属表面
生成一层致密的氧化物保护膜,阻止内部金
属继续跟硫酸起反应。此现象称 “钝化”。钝化体现浓H2SO4的强氧化性加热下,氧化物能被热的浓硫酸氧化。“黑面包” 在烧杯中放入少量蔗糖,用少量水调成糊状,注入浓硫酸,用玻棒搅拌。现象:蔗糖变黑,体积膨胀,放出大量热,放出有刺激性气味的气体。原理:体现浓H2SO4的__________________性脱水性和强氧化怎样证明碳与浓硫酸反应生成CO2、SO2?SO2
CO2褪色变浅不褪色变浑浊检验
SO2吸收
SO2检验
SO2
已被
吸收
完检验
CO2蓝色晶体变为白色 浓硫酸直接与水分子结合,一般结合溶液或
气体中的水分子、晶体中的结晶水。常做干燥剂。浓硫酸与结晶水结合,使变为无水硫酸铜浓硫酸能干燥_________________________的气体酸性且没有还原性的气体不能干燥NH3、H2S、HBr、HIH2S + H2SO4 (浓) = S ↓ + SO2 ↑ + 2H2O特性:
浓H2SO4虽然具有强氧化性,
SO2具有强的还原性,但是它们
不反应,因为同种元素的相邻价
态间,不发生化学反应。浓硫酸是否能干燥SO2气体呢?课堂检测1、下列现象和用途体现浓硫酸脱水性的是( )
A、实验室制取氯气、用浓硫酸做干燥剂
B、浓硫酸加到蔗糖中,蔗糖变黑
C、浓硫酸加到胆矾上,蓝色晶体变为白色
D、浓硫酸敞口放置,质量增加B吸水性吸水性吸水性浓硫酸的吸水性和脱水性有什么区别?吸水性是指与水结合吸收现成的水或结晶水脱水性是指将有机物中的氢、氧元素脱出成水反应生成水2、指出下列事实和现象中,硫酸体现的性质
(1)浓硫酸露置在空气中,浓度减小( )
吸水性(2)浓硫酸使硫酸铜晶体由蓝变白( )
(3)浓硫酸使蔗糖炭化变黑 ( )
(4)工业上用铁槽车或铝槽车运输浓硫酸( )
(5)浓硫酸与木炭反应 ( )
(6)浓硫酸与铜反应制取硫酸铜( )
(7)实验室用锌粒反应制取氢气 ( )吸水性脱水性强氧化性强氧化性酸性和强氧化性酸性和氧化性(8)浓硫酸与Na2SO3反应制取SO2( )酸性(9)浓H2SO4和浓HCl混合可以快速制HCl气体 吸水性、溶解放热浓硫酸的特性:1、吸水性—2、脱水性—3、强氧化性干燥剂H、O两原子按水的组成比 2:1脱去。与某些金属(不活泼Cu)反应{与某些固态非金属单质(C)反应课堂总结以上使浓硫酸具有很强烈的腐蚀性2、加热时—— 与绝大多数金属反应1、浓硫酸被 __为 ____,不置换产 。—— 与活泼金属(如Zn)反应3、常温下发生钝化表面生成 .Al、Fe与 的 硫酸接触钝化条件:H2还原SO2致密的氧化物薄膜冷浓浓硫酸与金属反应的规律:用干布迅速抹去,并用大量水冲冼,
再涂3%~5%的NaHCO3溶液。生活小知识浓硫酸不小心滴在皮肤上,应如何处理?硝酸(第4课时)课前复习以下现象体现浓硫酸的怎样的化学性质?1 、浓硫酸与Na2SO3反应制取SO22 、浓硫酸使胆矾变白3 、蔗糖中滴入浓硫酸变黑,闻到刺激性气味4 、铁制品可以盛装冷的浓H2SO45、浓H2SO4和浓HCl混合可以快速制HCl气体酸性吸水性脱水性
氧化性强氧化性 吸水性、溶解放热交流与思考下列酸与金属是否反应,主要的产物是什么???反应 H2不反应反应 H2不反应反应 SO2加热反应 SO2不反应反应 H2 纯硝酸是无色、易挥发、有刺激性气味的液体,密度为1.5027g/cm3,沸点是83℃,常用浓硝酸质量分数为69%,98%以上的硝酸叫发烟硝酸。硝酸的物理性质“模仿秀”As we know,浓硫酸有强氧化性,浓硝酸、稀硝酸呢?
一、与铜反应
样板:浓硫酸+铜
模仿内容1:推测浓硝酸与铜、稀硝酸与铜的反应产物。
Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑+ 2H2O3Cu +8HNO3(稀) = 3Cu(NO3)2 + 2NO↑+ 4H2O0+2+4+50+2+2+5酸性和强氧化性酸性和强氧化性一般来说:浓硝酸的氧化性强于稀硝酸硝酸与金属反应规律硝酸能与除铂、金外的所有金属反应,一般不生成H2▲①与不活泼金属反应,生成高价金属的硝酸盐。
浓HNO3还原成NO2,稀HNO3还原成NO.②与活泼金属反应,硝酸的还原产物很复杂,
可能是以下的物质二、与铁反应:钝化模仿2:浓硝酸与铁反应样板:浓硫酸与铁反应:钝化:在常温下, Fe和Al遇浓HNO3、浓H2SO4
都会发生在金属表面形成致密的氧化膜,
阻止酸进一步腐蚀金属。请写出稀HNO3与少量Fe的反应方程式Fe + 4HNO3(稀) = Fe(NO3)3 + NO↑+ 2H2O铁粉少量模仿3:稀硝酸与铁呢?请写出稀HNO3与过量Fe的反应方程式Fe + 4HNO3(稀) = Fe(NO3)3 + NO↑+ 2H2O3Fe + 8HNO3(稀) = 3Fe(NO3)2 + 2NO↑+ 4H2O铁粉少量铁粉过量Fe + 2Fe(NO3)3 = 3Fe(NO3)2模仿3:稀硝酸与铁呢?推荐:
王水:若将浓HNO3和浓HCl按体积比1 : 3混合所得混合物,可溶解不活泼金属如金、铂等。三、与C反应样板:浓硫酸与C反应模仿4:浓硝酸与C反应:随堂练习1、为了除去铝制品表面的铜镀层,宜选用的试剂是
( )
A、浓硫酸 B、稀硫酸
C、稀硝酸 D、浓硝酸D2、Cu与稀HNO3反应时,如果有1mol Cu参加反应,
下列说法正确的是 ( )
A、有3/8的HNO3被还原
B、实际上产生NO为2/3mol
C、有1/4的HNO3体现酸性
D、有2mol电子发生转移BD硝酸有强氧化性外,还具有以下的化学性质1)酸的通性2)不稳定性思考:常用的浓硝酸为什么会呈黄色?浓硝酸易分解生成红棕色NO2溶于硝酸3) 强氧化性:与非金属(C、S、P等)反应C + 4HNO3 = CO2↑+ 4NO2↑+ 2H2O课堂总结1)酸的通性2)不稳定性C + 4HNO3 = CO2↑+ 4NO2↑+ 2H2O ②与金属(Cu、Fe)反应 Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑+ 2H2O3Cu +8HNO3(稀) = 3Cu(NO3)2 + 2NO↑+ 4H2O3) 强氧化性:①与非金属(C、S、P等)反应
