人教版高中化学必修一 几种重要的金属化合物——钠的氧化物 课件
文档属性
| 名称 | 人教版高中化学必修一 几种重要的金属化合物——钠的氧化物 课件 |  | |
| 格式 | zip | ||
| 文件大小 | 986.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-10 21:13:57 | ||
图片预览






文档简介
课件20张PPT。 人教版《化学》必修1 钠的氧化物1、了解过氧化物的物理性质及用途;
2、掌握过氧化钠的化学性质;
3、通过实验操作,掌握分析物质性质的一般方法。 通过初中化学学习我们知道,氧化物可以分为酸性氧化物(多为非金属氧化物)和碱性氧化物(多为金属氧化物)
碱性氧化物的通性:
(1)碱性氧化物+水=氢氧化物
(位于Na前面的金属氧化物)如:CaO+H2O=Ca(OH)2
(2)碱性氧化物+酸性氧化物=对应的盐
(位于Na前面的金属氧化物)如:CaO+CO2=CaCO3
(3)碱性氧化物+酸=盐和水
如:CaO+2HCl=CaCl2+H2O自学内容:P55页 第一段到思考与交流完
自学方法:
1、快速阅读相关内容,了解钠的氧化物的物理性质。
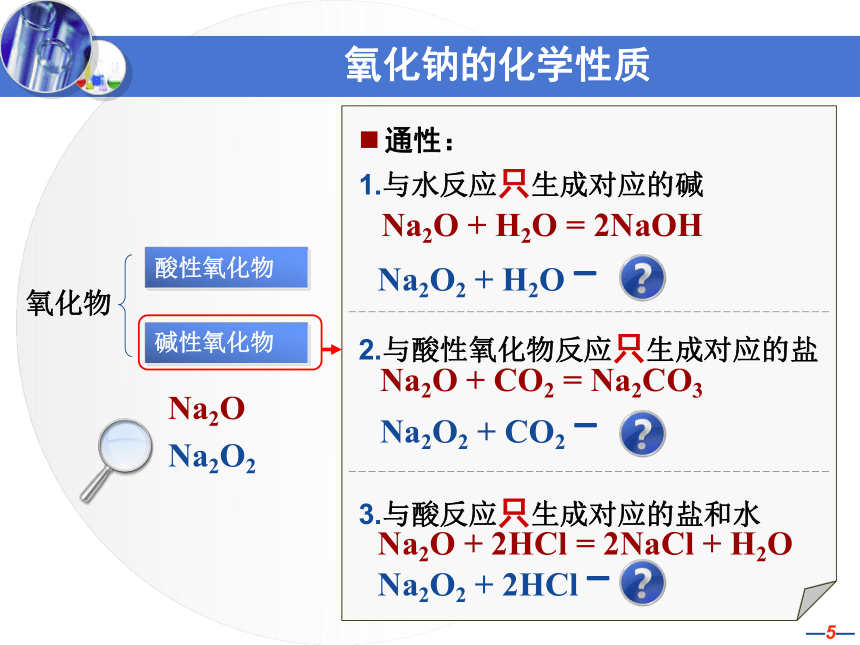
2、氧化钠(Na2O)的性质和CaO相似。请写出Na2O分别与H2O、CO2、HCl发生反应的化学方程式。氧化钠的化学性质通性:
1.与水反应只生成对应的碱
2.与酸性氧化物反应只生成对应的盐
3.与酸反应只生成对应的盐和水
氧化物碱性氧化物酸性氧化物Na2ONa2O + H2O = 2NaOHNa2O + CO2 = Na2CO3Na2O + 2HCl = 2NaCl + H2ONa2O2 + H2O - Na2O2 + CO2 -Na2O2 + 2HCl - Na2O2大胆预测 对真理的追求比对真理
的占有更可贵。
—爱因斯坦化学探究 假如过氧化钠能与水发生化学反应。
请小组合作完成:
1、预测过氧化钠与水反应的产物。说一说你们的理论依据。
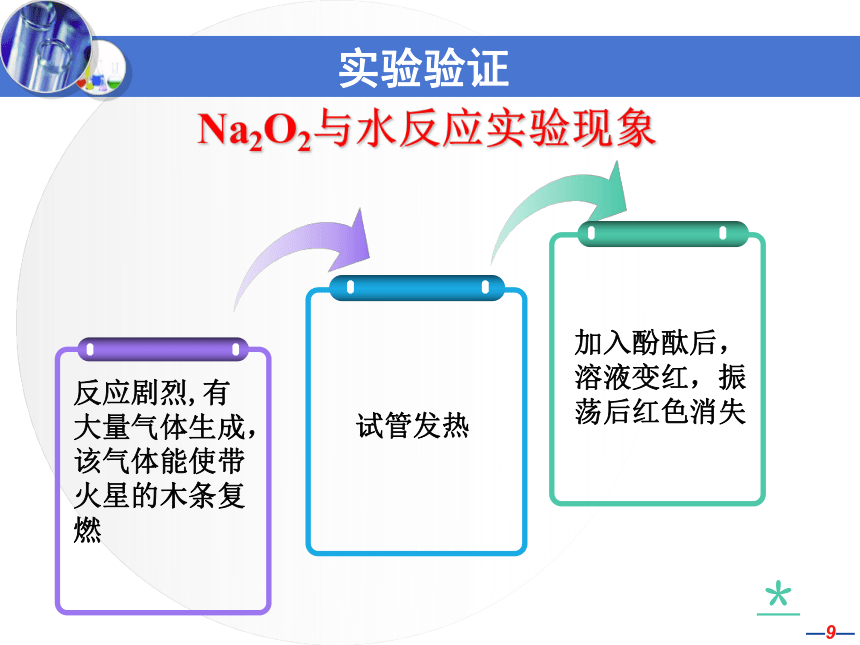
2、如何验证你们的猜想?将验证方法写在互帮显示板上。过氧化钠与水反应的实验步骤:
1、取大约小半药匙Na2O2(过氧化钠)放入小试管,并准备好带火星的卫生香。
2、向放有过氧化钠的小试管中加1mL左右的水;观察。将带火星的卫生香伸入试管中,有什么现象?
3、滴加1~2酚酞试液,观察现象;振荡后再观察。
4、触摸试管的外壁。 实 验 验 证注意事项:
1、注意过氧化钠的用量及向试管中加入固体物质的方法。
2、注意滴管的使用方法。
3、操板手认真记录实验现象。
4、小组成员相互交流,尝试解释实验现象。Na2O2与水反应实验现象实验验证*1、猜测老师表演的魔术可能发生的反应。
2、小组合作尝试写出过氧化钠(Na2O2)和CO2发生反应的化学方程式。
3、根据这个反应猜测过氧化钠有什么用途?
知者加速:
写出过氧化钠(Na2O2)与盐酸反应的化学方程式。分析过氧化钠是否属于碱性氧化物?
氧化物碱性氧化物酸性氧化物 Na2O + H2O = 2NaOHNa2O + CO2 = Na2CO3Na2O + 2HCl = 2NaCl + H2O过氧化物
2Na2O2 + 2H2O=4NaOH + O2 ↑2Na2O2 + 2CO2=2Na2CO3 + O22Na2O2+4HCl=4NaCl+2H2O+O2↑Na2ONa2O21.对Na2O和 Na2O2的叙述正确的是
A.两者均可与盐酸反应,故二者均为碱性氧化物
B.两者都能与水反应,产生使带火星木条复燃的气体
C. Na2O与H2O反应为化合反应,而Na2O2与H2O反应为氧化还原反应,其中Na2O2是氧化剂,H2O是还原剂
D.在呼吸面具中,常用Na2O2作供氧剂,而Na2O不能
知者加速
如何测定氧化钠固体中混有的过氧化钠?D学 法 小 结顺着线索学带着问题学学法注重探究重视实验分门别类运用对比1、通过本节课的学习你有哪些收获? 2、请表现最优秀的小组组长发表获奖感言。说一说你们小组本节课优于其他组的表现有哪些?
3、整理笔记,完成下表。(附后)过氧化钠与氧化钠的性质比较☆将P46—55页所学的方程式各抄写3遍。 ☆ ☆写出相应离子方程式,如果是氧化还原反应,标出电子转移方向和数目,指出氧化剂、还原剂。谢谢各位专家、同行的指正!
Thank to your trust!Na2O+CO2=
Na2CO3 2Na2O2+2CO2=
2Na2CO3+O2淡黄色固体白色固体 常温下缓慢氧化点燃或加热2Na2O2+2H2O=
4NaOH+O2↑Na2O+H2O=
2NaOH 过氧化钠与氧化钠的性质比较否是CaO2分别与H2O 、co2呢?2CaO2 + 2H2O = 2Ca(OH)2 +o2 ↑
2CaO2 + 2co2 = 2CaCO3 +o2拓展迁移再 见!
碱性氧化物的通性:
(1)碱性氧化物+水=氢氧化物
(位于Na前面的金属氧化物)如:CaO+H2O=Ca(OH)2
(2)碱性氧化物+酸性氧化物=对应的盐
(位于Na前面的金属氧化物)如:CaO+CO2=CaCO3
(3)碱性氧化物+酸=盐和水
如:CaO+2HCl=CaCl2+H2O自学内容:P55页 第一段到思考与交流完
自学方法:
1、快速阅读相关内容,了解钠的氧化物的物理性质。
2、氧化钠(Na2O)的性质和CaO相似。请写出Na2O分别与H2O、CO2、HCl发生反应的化学方程式。氧化钠的化学性质通性:
1.与水反应只生成对应的碱
2.与酸性氧化物反应只生成对应的盐
3.与酸反应只生成对应的盐和水
氧化物碱性氧化物酸性氧化物Na2ONa2O + H2O = 2NaOHNa2O + CO2 = Na2CO3Na2O + 2HCl = 2NaCl + H2ONa2O2 + H2O - Na2O2 + CO2 -Na2O2 + 2HCl - Na2O2大胆预测 对真理的追求比对真理
的占有更可贵。
—爱因斯坦化学探究 假如过氧化钠能与水发生化学反应。
请小组合作完成:
1、预测过氧化钠与水反应的产物。说一说你们的理论依据。
2、如何验证你们的猜想?将验证方法写在互帮显示板上。过氧化钠与水反应的实验步骤:
1、取大约小半药匙Na2O2(过氧化钠)放入小试管,并准备好带火星的卫生香。
2、向放有过氧化钠的小试管中加1mL左右的水;观察。将带火星的卫生香伸入试管中,有什么现象?
3、滴加1~2酚酞试液,观察现象;振荡后再观察。
4、触摸试管的外壁。 实 验 验 证注意事项:
1、注意过氧化钠的用量及向试管中加入固体物质的方法。
2、注意滴管的使用方法。
3、操板手认真记录实验现象。
4、小组成员相互交流,尝试解释实验现象。Na2O2与水反应实验现象实验验证*1、猜测老师表演的魔术可能发生的反应。
2、小组合作尝试写出过氧化钠(Na2O2)和CO2发生反应的化学方程式。
3、根据这个反应猜测过氧化钠有什么用途?
知者加速:
写出过氧化钠(Na2O2)与盐酸反应的化学方程式。分析过氧化钠是否属于碱性氧化物?
氧化物碱性氧化物酸性氧化物 Na2O + H2O = 2NaOHNa2O + CO2 = Na2CO3Na2O + 2HCl = 2NaCl + H2O过氧化物
2Na2O2 + 2H2O=4NaOH + O2 ↑2Na2O2 + 2CO2=2Na2CO3 + O22Na2O2+4HCl=4NaCl+2H2O+O2↑Na2ONa2O21.对Na2O和 Na2O2的叙述正确的是
A.两者均可与盐酸反应,故二者均为碱性氧化物
B.两者都能与水反应,产生使带火星木条复燃的气体
C. Na2O与H2O反应为化合反应,而Na2O2与H2O反应为氧化还原反应,其中Na2O2是氧化剂,H2O是还原剂
D.在呼吸面具中,常用Na2O2作供氧剂,而Na2O不能
知者加速
如何测定氧化钠固体中混有的过氧化钠?D学 法 小 结顺着线索学带着问题学学法注重探究重视实验分门别类运用对比1、通过本节课的学习你有哪些收获? 2、请表现最优秀的小组组长发表获奖感言。说一说你们小组本节课优于其他组的表现有哪些?
3、整理笔记,完成下表。(附后)过氧化钠与氧化钠的性质比较☆将P46—55页所学的方程式各抄写3遍。 ☆ ☆写出相应离子方程式,如果是氧化还原反应,标出电子转移方向和数目,指出氧化剂、还原剂。谢谢各位专家、同行的指正!
Thank to your trust!Na2O+CO2=
Na2CO3 2Na2O2+2CO2=
2Na2CO3+O2淡黄色固体白色固体 常温下缓慢氧化点燃或加热2Na2O2+2H2O=
4NaOH+O2↑Na2O+H2O=
2NaOH 过氧化钠与氧化钠的性质比较否是CaO2分别与H2O 、co2呢?2CaO2 + 2H2O = 2Ca(OH)2 +o2 ↑
2CaO2 + 2co2 = 2CaCO3 +o2拓展迁移再 见!
