共价键[下学期]
图片预览










文档简介
课件40张PPT。化学键(第二课时)共价键 某ⅡA族元素 X 和ⅦA族元素 Y 可形成
离子化合物,请用电子式表示该离子化合物。 X2+ 钠与氧气在常温下反应生成氧化钠。请
用电子式表示氧化钠的形成过程。2Na·+→Na+Na+ 活泼的金属元素和活泼非金属元素化合
时形成离子键。请思考,非金属元素之间化
合时,能形成离子键吗?为什么? 不能,因非金属元素的原子均有获得电
子的倾向。 非金属元素的原子间可通过共用电子对
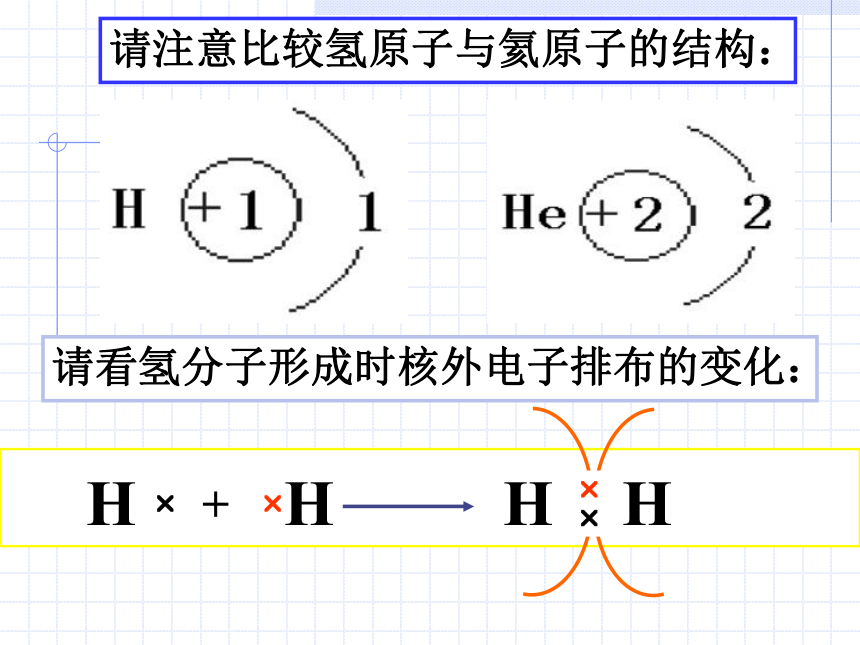
的方法使双方最外电子层均达到稳定结构。讨论 H?+HH?H请注意比较氢原子与氦原子的结构:请看氢分子形成时核外电子排布的变化:?? 两个氢原子结合成氢分子时电子云的变化 请同学们根据氯原子、氢原子的电子式和 原子在化合时力求达到稳定的事实,探讨氯化氢分子的形成过程,并用电子式表示之。共价键的形成:
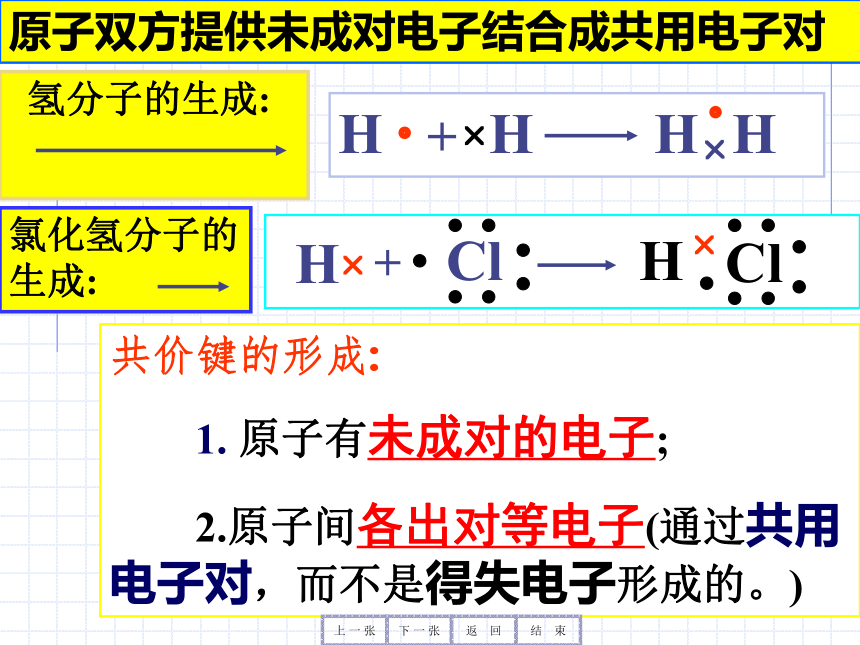
1. 原子有未成对的电子;
2.原子间各出对等电子(通过共用电子对,而不是得失电子形成的。)H?H??HH?+Cl??????H? ?Cl??????H??+上 一 张下 一 张返 回结 束氯化氢分子的生成:原子双方提供未成对电子结合成共用电子对 氢分子的生成:
一、共价键的形成及概念:
两个氢原子各提供一个电子,通过共用电子对使两原子产生了强烈的相互作用,这种: “ 原子间通过共用电子对所形成的化学键,叫做共价键。”完全由共价键构成的化合物叫共价化合物。如HCl,H2O等.定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。成键微粒:原子相互作用:共用电子对成键元素:同种或不同种非金属元素含有共价键的化合物不一定是共价化合物共价键 氢氧化钠晶体中,钠离子与氢氧根离子以
离子键结合;在氢氧根离子中,氢与氧以共价
键结合。请用电子式表示氢氧化钠。 [ ] +- 过氧化钠晶体中,过氧根离子 (O2 ) 2-与钠
离子以离子键结合;在过氧根离子中,两个氧
原子以共价键结合。请用电子式表示过氧化钠。[ ]++2-原子通常为非金属通常在非金属元素
的原子间,如NH3、
SO42-、NO3-、OH- 共价化合物
非金属单质全是共价键才行
如H2O、CH4、H2CO3等 以共价键形成的分子的电子式的
书写规律:1.每个原子均应达到稳定的结构
2.不加中括号[ ],不标正负电荷数
3.原子最外层电子数距8电子稳定结构差几个电子,就提供几个电子,并在此原子周围形成几对共用电子(即几个共价键) 共价化合物
非金属单质全是共价键才行
如H2O、CH4、H2CO3等 1.原子全稳定
2.不标电荷和[ ]
3.差几拿几成几
共价化合物
非金属单质全是共价键才行
如H2O、CH4、H2CO3等 1.原子全稳定
2.不标电荷和[ ]
3.差几拿几成几
共价键 离子键电子对的偏移程度
共价键通常表示形式:
1.用电子式表示:
2.用结构式表示:
如:
H??HH? ?Cl??????HHHClClClNN如:NN? ??????? ? ?又如: 在化学上常用一根短线
表示一对共用电子,例H-H
O=O、Cl-Cl、H-Cl,其余的
电子不标出。这样的式子叫
结构式。 讨论:用化学键的观点来分析化学反应的本质是什么?一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。 H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl
化学反应的过程
分子原子观点
分解 重新组合
物质 原子 新物质 旧键断裂 新键生成
化学键的观点
本节我们学习了以下内容: 1.共价键是怎样形成的
(形成条件;形成过程)
2.共价键的表示方法
(电子式;结构式)上 一 张下 一 张返 回结 束下列电子式中,书写错误的是
A、H O H B、N N
C、[ O H ]- D、[ S ]2-1、请你分别写出氮原子和氨气的电
子式;1、请你分别写出氮原子和氨气的电
子式;N H N H
H1、请你分别写出氮原子和氨气的电
子式;N H N H
H2、已知氯化铵为离子化合物,其电
子式如下,请分析其中所含有的化学
键: H
[H N H]+[ Cl ]-
H
判断下列化合物的类型
NaOH、H2S、MgCl2、H2SO4、KNO3、CO2
离子化合物
共价化合物
含共价键的离子化合物写出H2O、CO2、NaOH,MgCl2的电子式根据下列物质的结构式写出相应电子式:
H—O—Cl 、 H—O—O—H
H—C ≡C—H下列关于化学键的叙述中正确的是
A、离子化合物可以含有共价键
B、共价化合物可能含有离子键
C、离子化合物中只含有离子键
D、共价化合物中不含有离子键书写电子式注意:
1.分清键型(是离子键还是共价键)
2.形成离子键时,要标电荷;形成共价键时不标电荷
3.成键后的原子或离子,一般为8电子稳定结构
离子化合物,请用电子式表示该离子化合物。 X2+ 钠与氧气在常温下反应生成氧化钠。请
用电子式表示氧化钠的形成过程。2Na·+→Na+Na+ 活泼的金属元素和活泼非金属元素化合
时形成离子键。请思考,非金属元素之间化
合时,能形成离子键吗?为什么? 不能,因非金属元素的原子均有获得电
子的倾向。 非金属元素的原子间可通过共用电子对
的方法使双方最外电子层均达到稳定结构。讨论 H?+HH?H请注意比较氢原子与氦原子的结构:请看氢分子形成时核外电子排布的变化:?? 两个氢原子结合成氢分子时电子云的变化 请同学们根据氯原子、氢原子的电子式和 原子在化合时力求达到稳定的事实,探讨氯化氢分子的形成过程,并用电子式表示之。共价键的形成:
1. 原子有未成对的电子;
2.原子间各出对等电子(通过共用电子对,而不是得失电子形成的。)H?H??HH?+Cl??????H? ?Cl??????H??+上 一 张下 一 张返 回结 束氯化氢分子的生成:原子双方提供未成对电子结合成共用电子对 氢分子的生成:
一、共价键的形成及概念:
两个氢原子各提供一个电子,通过共用电子对使两原子产生了强烈的相互作用,这种: “ 原子间通过共用电子对所形成的化学键,叫做共价键。”完全由共价键构成的化合物叫共价化合物。如HCl,H2O等.定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。成键微粒:原子相互作用:共用电子对成键元素:同种或不同种非金属元素含有共价键的化合物不一定是共价化合物共价键 氢氧化钠晶体中,钠离子与氢氧根离子以
离子键结合;在氢氧根离子中,氢与氧以共价
键结合。请用电子式表示氢氧化钠。 [ ] +- 过氧化钠晶体中,过氧根离子 (O2 ) 2-与钠
离子以离子键结合;在过氧根离子中,两个氧
原子以共价键结合。请用电子式表示过氧化钠。[ ]++2-原子通常为非金属通常在非金属元素
的原子间,如NH3、
SO42-、NO3-、OH- 共价化合物
非金属单质全是共价键才行
如H2O、CH4、H2CO3等 以共价键形成的分子的电子式的
书写规律:1.每个原子均应达到稳定的结构
2.不加中括号[ ],不标正负电荷数
3.原子最外层电子数距8电子稳定结构差几个电子,就提供几个电子,并在此原子周围形成几对共用电子(即几个共价键) 共价化合物
非金属单质全是共价键才行
如H2O、CH4、H2CO3等 1.原子全稳定
2.不标电荷和[ ]
3.差几拿几成几
共价化合物
非金属单质全是共价键才行
如H2O、CH4、H2CO3等 1.原子全稳定
2.不标电荷和[ ]
3.差几拿几成几
共价键 离子键电子对的偏移程度
共价键通常表示形式:
1.用电子式表示:
2.用结构式表示:
如:
H??HH? ?Cl??????HHHClClClNN如:NN? ??????? ? ?又如: 在化学上常用一根短线
表示一对共用电子,例H-H
O=O、Cl-Cl、H-Cl,其余的
电子不标出。这样的式子叫
结构式。 讨论:用化学键的观点来分析化学反应的本质是什么?一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。 H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl
化学反应的过程
分子原子观点
分解 重新组合
物质 原子 新物质 旧键断裂 新键生成
化学键的观点
本节我们学习了以下内容: 1.共价键是怎样形成的
(形成条件;形成过程)
2.共价键的表示方法
(电子式;结构式)上 一 张下 一 张返 回结 束下列电子式中,书写错误的是
A、H O H B、N N
C、[ O H ]- D、[ S ]2-1、请你分别写出氮原子和氨气的电
子式;1、请你分别写出氮原子和氨气的电
子式;N H N H
H1、请你分别写出氮原子和氨气的电
子式;N H N H
H2、已知氯化铵为离子化合物,其电
子式如下,请分析其中所含有的化学
键: H
[H N H]+[ Cl ]-
H
判断下列化合物的类型
NaOH、H2S、MgCl2、H2SO4、KNO3、CO2
离子化合物
共价化合物
含共价键的离子化合物写出H2O、CO2、NaOH,MgCl2的电子式根据下列物质的结构式写出相应电子式:
H—O—Cl 、 H—O—O—H
H—C ≡C—H下列关于化学键的叙述中正确的是
A、离子化合物可以含有共价键
B、共价化合物可能含有离子键
C、离子化合物中只含有离子键
D、共价化合物中不含有离子键书写电子式注意:
1.分清键型(是离子键还是共价键)
2.形成离子键时,要标电荷;形成共价键时不标电荷
3.成键后的原子或离子,一般为8电子稳定结构
