二氧化硫[上学期]
图片预览






文档简介
课件16张PPT。第二节 二氧化硫酸雨与森林衰退酸雨中的马尾松峨眉山冷杉林成片死亡大熊猫在肌饿中温岭市场银耳二氧化硫多有超标 据介绍,今年1-2月份,温岭市流通领域商品检测中心例行检测市内部分农贸市场、超市中销售的银耳。抽检共52批次,不合格的有18批次,不合格率为34.7%;
银耳中的二氧化硫来自于“硫磺薰蒸”这种传统的银耳漂白加工工艺,生产厂家为迎合消费者心理,对银耳进行超量漂白,结果导致银耳中二氧化硫残留量超标。 无色有毒有刺激性气味的气体,易溶于水(1:40),密度比空气大。一、二氧化硫的物理性质S(含硫物质)
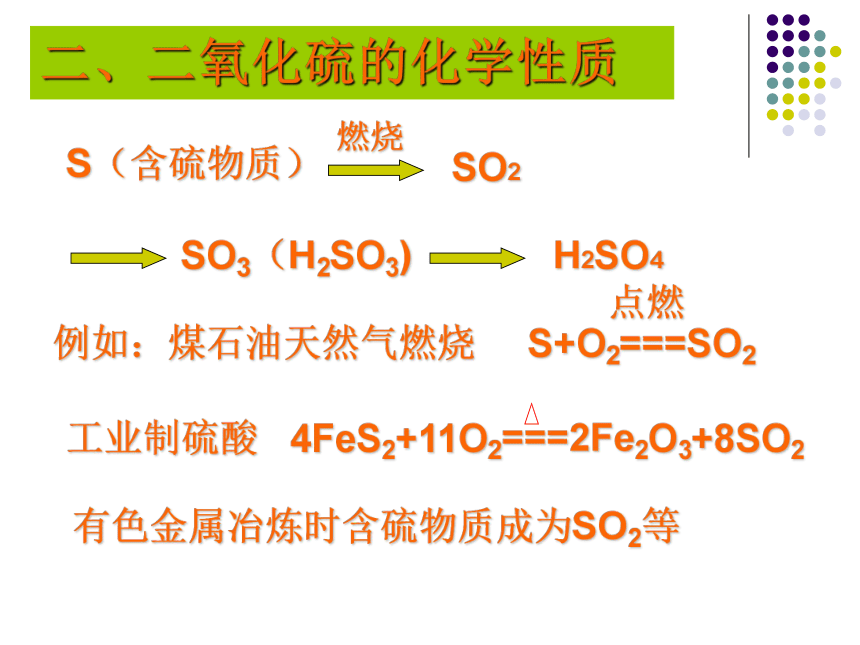
有色金属冶炼时含硫物质成为SO2等二、二氧化硫的化学性质讨论:1.从化合价分析,把SO2变成 SO3或SO42-,需要加入什么物质?典型的几个化学反应SO2+2FeCl3+2H2O==H2SO4+2FeCl2+2HClSO2+Cl2+2H2O==H2SO4+2HCl (Br2 、I2 )2.根据已有的化学知识,尽可能多的写出上述反应的方程式。 SO2的氧化性2H2S+SO2==3S+2H2O如果有1 mol 的SO2参加反应,则氧化产物和还原产物的质量比是多少?2:1谈谈:你能区别某密封包装的
一小袋白木耳是否用二氧化硫
漂白过思考1:两支试管中的品红溶液分别被Cl2和SO2漂 白,你能用较简便的方法加以区别吗?思考2:把SO2 和Cl2以物质的量比1:1缓慢通入
品红溶液中,漂白的效果是否更好?有什么现象?3.某学生课外活动小组利用图1-1所示装置
分别做如下试验:
(1)试管中注入某红色溶液,加热试管, 溶液逐渐变浅,冷却后恢复红色;则原
溶液可能是 溶液;加热时红色逐渐变浅的原因是 。
(2)在试管中注入某无色溶液,加热试管,
溶液为红色,冷却后恢复无色,则此溶液 可能是 溶液;加热
时溶液由无色变为红色的原因
是 。 稀氨水和酚酞NH3逸出溶有SO2的品红SO2气体逸出,品红恢复红色二、二氧化硫的化学性质2.还原性3.氧化性4.漂白性(2 )如何检验SO2中含有少量的CO2气体?
(3)如何除去CO2中少量的SO2气体?思考:(1 )如何检验CO2 中含有少量的SO2气体?三、SO2的用途和危害1、工业上常用二氧化硫漂白某些物质2、用作杀菌、消毒剂用 途危 害1.引起人体呼吸道疾病,严重甚至死亡2.破坏农作物、森林、草原3. 使湖泊酸化,造成鱼类等死亡4. 加速建筑物、桥梁、工业设备、
电信电缆等腐蚀如何减少酸雨的形成呢?途径一:减少SO2的产生①煤燃料脱硫②煤的综合利用途径二:把产生的SO2充分吸收③开发新能源四 、实验室SO2的制取原理:Na2SO3+H2SO4==Na2SO4+H2O+SO2 ↑药品:固体亚硫酸钠和70%的浓硫酸装置:收集:向上排空气法或排饱和亚硫酸氢钠溶液尾气:用NaOH溶液吸收 巩固练习:在BaCl2溶液中通入SO2气体,溶液仍澄清;若将BaCl2溶液分盛于两支试管中,一支加硝酸,另一支加烧碱溶液,然后再通入SO2气体,结果两支试管都有白色沉淀。那么下列结论合理的是( )
氯化钡有两性
两支试管的沉淀均是BaSO3
SO2有还原性和酸性氧化物性质
升高PH使SO2水溶液中SO32- 浓度增大CD2.酸雨主要是大量燃烧含硫燃料放出SO2所造成
的,试回答下列问题:
(1)现有雨水样品1份,每隔一段时间测定
该雨水样品的PH,所得数据如下:
分析数据,回答下列问题,①雨水样品的PH值变化的
原因是(用化学方程式表示) 。
②如果将刚取样的上述雨水和用氯气消毒的自来水相
混合,PH将变 ,原因是 。SO2+H2O==H2SO3
2H2SO3+O2==2H2SO4小H2SO3+HClO=H2SO4+2HCl
SO2+H2O+Cl2==H2SO4+2HCl
银耳中的二氧化硫来自于“硫磺薰蒸”这种传统的银耳漂白加工工艺,生产厂家为迎合消费者心理,对银耳进行超量漂白,结果导致银耳中二氧化硫残留量超标。 无色有毒有刺激性气味的气体,易溶于水(1:40),密度比空气大。一、二氧化硫的物理性质S(含硫物质)
有色金属冶炼时含硫物质成为SO2等二、二氧化硫的化学性质讨论:1.从化合价分析,把SO2变成 SO3或SO42-,需要加入什么物质?典型的几个化学反应SO2+2FeCl3+2H2O==H2SO4+2FeCl2+2HClSO2+Cl2+2H2O==H2SO4+2HCl (Br2 、I2 )2.根据已有的化学知识,尽可能多的写出上述反应的方程式。 SO2的氧化性2H2S+SO2==3S+2H2O如果有1 mol 的SO2参加反应,则氧化产物和还原产物的质量比是多少?2:1谈谈:你能区别某密封包装的
一小袋白木耳是否用二氧化硫
漂白过思考1:两支试管中的品红溶液分别被Cl2和SO2漂 白,你能用较简便的方法加以区别吗?思考2:把SO2 和Cl2以物质的量比1:1缓慢通入
品红溶液中,漂白的效果是否更好?有什么现象?3.某学生课外活动小组利用图1-1所示装置
分别做如下试验:
(1)试管中注入某红色溶液,加热试管, 溶液逐渐变浅,冷却后恢复红色;则原
溶液可能是 溶液;加热时红色逐渐变浅的原因是 。
(2)在试管中注入某无色溶液,加热试管,
溶液为红色,冷却后恢复无色,则此溶液 可能是 溶液;加热
时溶液由无色变为红色的原因
是 。 稀氨水和酚酞NH3逸出溶有SO2的品红SO2气体逸出,品红恢复红色二、二氧化硫的化学性质2.还原性3.氧化性4.漂白性(2 )如何检验SO2中含有少量的CO2气体?
(3)如何除去CO2中少量的SO2气体?思考:(1 )如何检验CO2 中含有少量的SO2气体?三、SO2的用途和危害1、工业上常用二氧化硫漂白某些物质2、用作杀菌、消毒剂用 途危 害1.引起人体呼吸道疾病,严重甚至死亡2.破坏农作物、森林、草原3. 使湖泊酸化,造成鱼类等死亡4. 加速建筑物、桥梁、工业设备、
电信电缆等腐蚀如何减少酸雨的形成呢?途径一:减少SO2的产生①煤燃料脱硫②煤的综合利用途径二:把产生的SO2充分吸收③开发新能源四 、实验室SO2的制取原理:Na2SO3+H2SO4==Na2SO4+H2O+SO2 ↑药品:固体亚硫酸钠和70%的浓硫酸装置:收集:向上排空气法或排饱和亚硫酸氢钠溶液尾气:用NaOH溶液吸收 巩固练习:在BaCl2溶液中通入SO2气体,溶液仍澄清;若将BaCl2溶液分盛于两支试管中,一支加硝酸,另一支加烧碱溶液,然后再通入SO2气体,结果两支试管都有白色沉淀。那么下列结论合理的是( )
氯化钡有两性
两支试管的沉淀均是BaSO3
SO2有还原性和酸性氧化物性质
升高PH使SO2水溶液中SO32- 浓度增大CD2.酸雨主要是大量燃烧含硫燃料放出SO2所造成
的,试回答下列问题:
(1)现有雨水样品1份,每隔一段时间测定
该雨水样品的PH,所得数据如下:
分析数据,回答下列问题,①雨水样品的PH值变化的
原因是(用化学方程式表示) 。
②如果将刚取样的上述雨水和用氯气消毒的自来水相
混合,PH将变 ,原因是 。SO2+H2O==H2SO3
2H2SO3+O2==2H2SO4小H2SO3+HClO=H2SO4+2HCl
SO2+H2O+Cl2==H2SO4+2HCl
