硫酸[下学期]
图片预览






文档简介
课件17张PPT。第三节 硫 酸 H2SO4= 2H++SO42- 想想看: 稀硫酸具有哪些化学性质?为什么具有这些性质?硫酸有哪些物理性质呢?请观察实物
并阅读课本P134页有关内容 一、硫酸的物理性质
颜色: 状态: 沸点:
密度(与水相比): 在水中的溶解性:
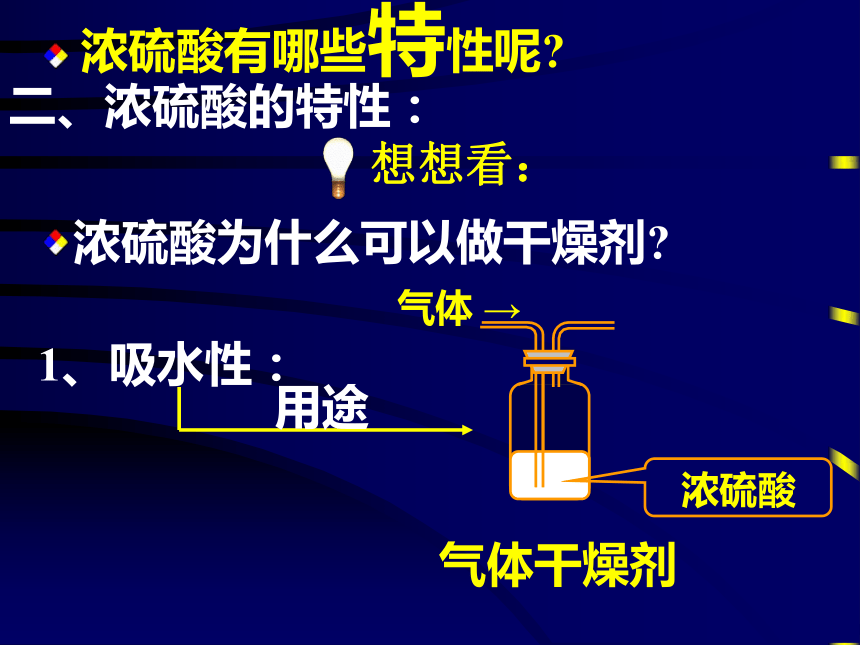
无色油状液体高,难挥发比水重以任意比与水互溶 想想看:如何稀释浓硫酸? 想想看:浓硫酸为什么可以做干燥剂?二、浓硫酸的特性:1、吸水性:浓硫酸有哪些特性呢?动 手 时 间 ! 想想看:火柴梗上的黑色物质是什么?胆矾为什么会变白?
其结晶水到哪里去了? 演 示 实 验——蔗糖中加入浓硫酸实验现象:蔗糖变黑;体积膨胀;放出大量热;产生有酸味、刺激性的气体。 想想看:反应中生成的黑色物质是什么? 产物为何变粗、变高、变膨胀?2、脱水性:将H、O按H2O组成比脱去 演 示 实 验——Cu与浓硫酸反应实验现象:
①试管A中Cu片的表面 产生,溶液由 色变为 色,说明Cu与浓硫酸反应时,Cu被 (氧化或还原)成了 ;
②试管B中的品红溶液由 色变为 色,说明Cu与浓硫酸反应时,H2SO4被
(氧化或还原),生成了 气体
③试管C中石蕊溶液由 色变为 色
气体无绿氧化Cu2+红无还原SO2紫红3、强氧化性(1)与金属反应0+6+4+2化合价升高化合价降低 想想看:在该反应中浓硫酸的作用是什么?失电子得电子浓硫酸与金属反应的规律:2、加热时—— 与绝大多数金属反应1、不产生 ,浓硫酸被 为 .—— 与活泼金属(如Zn)反应3、常温下发生钝化表面生成 .Al、Fe与 的 硫酸接触钝化条件:加热后:会剧烈反应H2还原SO2致密的氧化物薄膜冷浓浓硫酸的特性小结:1、吸水性2、脱水性3、强氧化性 规范使用,妥善保存正确处理浓硫酸和铜反应时的作用:1、体现强氧化性:2、体现酸性:CuO+H2SO4 = CuSO4+H2O 想想看: 稀硫酸是否具有氧化性?浓、稀硫酸的氧化性有什么不同?稀硫酸的氧化性
——是指H+的氧化性,是酸的通性之一。
浓硫酸的氧化性
——是由分子中的+6价S引起的。浓硫酸的氧化性比稀硫酸 强 ! 想想看: 工业上为何能用铝槽车盛放、运输浓硫酸?上述实验是否说明在常温下稀硫酸 的氧化性比浓硫酸强? 演 示 实 验——常温下,浓硫酸中加入Al片请阅读课本P135页浓硫酸稀硫酸 H2SO4量 变 引 起 质 变 ! 想想看:实验中浸碱棉花的作用是什么?请你预测一下,SO2气体通入紫色石蕊试液后,将会出现什么现象?
A、紫色石蕊试液变为红色
B、紫色石蕊试液变为无色
并阅读课本P134页有关内容 一、硫酸的物理性质
颜色: 状态: 沸点:
密度(与水相比): 在水中的溶解性:
无色油状液体高,难挥发比水重以任意比与水互溶 想想看:如何稀释浓硫酸? 想想看:浓硫酸为什么可以做干燥剂?二、浓硫酸的特性:1、吸水性:浓硫酸有哪些特性呢?动 手 时 间 ! 想想看:火柴梗上的黑色物质是什么?胆矾为什么会变白?
其结晶水到哪里去了? 演 示 实 验——蔗糖中加入浓硫酸实验现象:蔗糖变黑;体积膨胀;放出大量热;产生有酸味、刺激性的气体。 想想看:反应中生成的黑色物质是什么? 产物为何变粗、变高、变膨胀?2、脱水性:将H、O按H2O组成比脱去 演 示 实 验——Cu与浓硫酸反应实验现象:
①试管A中Cu片的表面 产生,溶液由 色变为 色,说明Cu与浓硫酸反应时,Cu被 (氧化或还原)成了 ;
②试管B中的品红溶液由 色变为 色,说明Cu与浓硫酸反应时,H2SO4被
(氧化或还原),生成了 气体
③试管C中石蕊溶液由 色变为 色
气体无绿氧化Cu2+红无还原SO2紫红3、强氧化性(1)与金属反应0+6+4+2化合价升高化合价降低 想想看:在该反应中浓硫酸的作用是什么?失电子得电子浓硫酸与金属反应的规律:2、加热时—— 与绝大多数金属反应1、不产生 ,浓硫酸被 为 .—— 与活泼金属(如Zn)反应3、常温下发生钝化表面生成 .Al、Fe与 的 硫酸接触钝化条件:加热后:会剧烈反应H2还原SO2致密的氧化物薄膜冷浓浓硫酸的特性小结:1、吸水性2、脱水性3、强氧化性 规范使用,妥善保存正确处理浓硫酸和铜反应时的作用:1、体现强氧化性:2、体现酸性:CuO+H2SO4 = CuSO4+H2O 想想看: 稀硫酸是否具有氧化性?浓、稀硫酸的氧化性有什么不同?稀硫酸的氧化性
——是指H+的氧化性,是酸的通性之一。
浓硫酸的氧化性
——是由分子中的+6价S引起的。浓硫酸的氧化性比稀硫酸 强 ! 想想看: 工业上为何能用铝槽车盛放、运输浓硫酸?上述实验是否说明在常温下稀硫酸 的氧化性比浓硫酸强? 演 示 实 验——常温下,浓硫酸中加入Al片请阅读课本P135页浓硫酸稀硫酸 H2SO4量 变 引 起 质 变 ! 想想看:实验中浸碱棉花的作用是什么?请你预测一下,SO2气体通入紫色石蕊试液后,将会出现什么现象?
A、紫色石蕊试液变为红色
B、紫色石蕊试液变为无色
