硫酸的制备和性质[上学期]
图片预览







文档简介
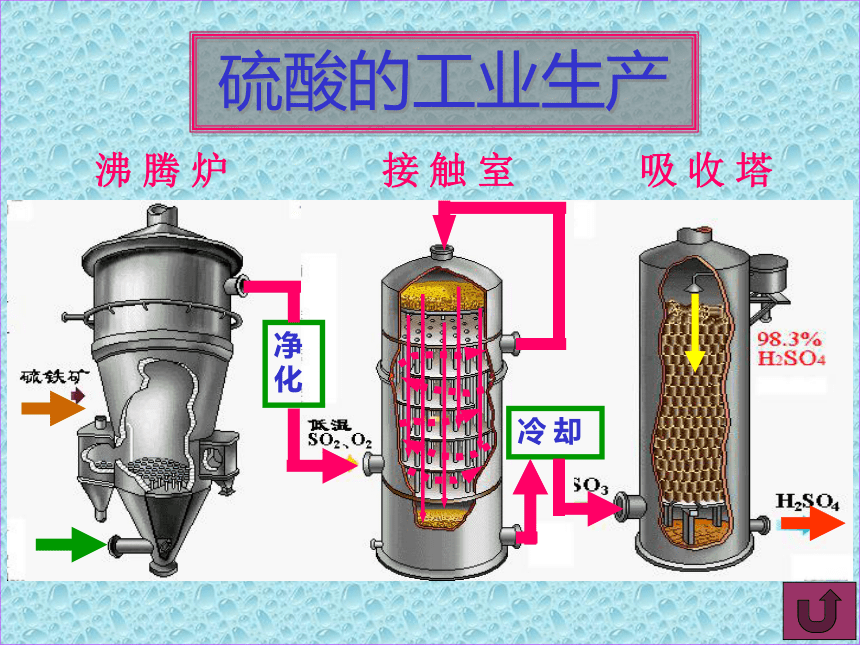
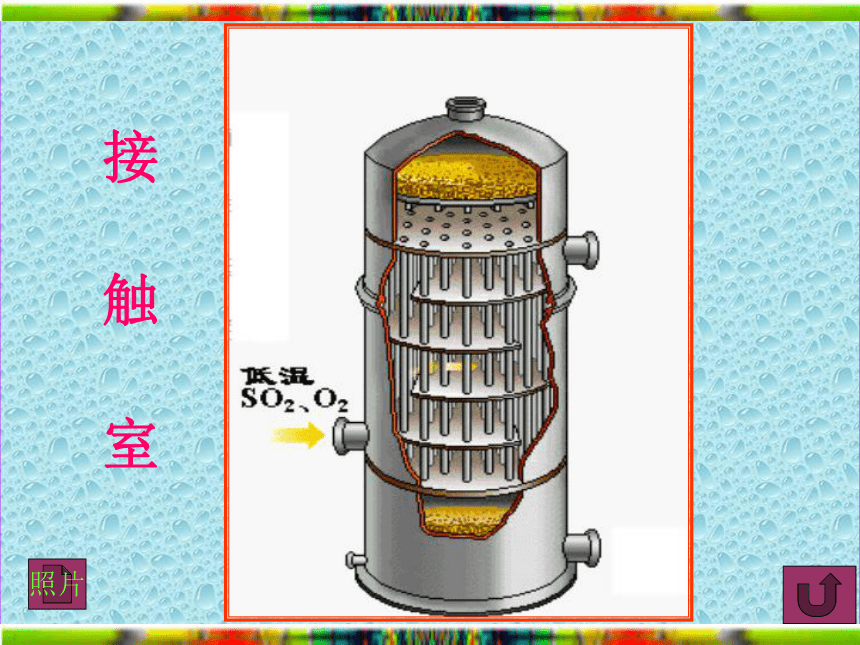
课件21张PPT。硫酸的制备和性质江苏省宿迁中学高一化学组硫酸生产反应式硫酸工业生产的原理第一步:第二步:第三步:沸腾炉接触室吸收塔全过程结束硫酸工业生产流程自制动画 硫酸的工业生产沸 腾 炉接 触 室吸 收 塔净化冷 却沸腾炉沸 腾 炉照片接触室接 触 室照片吸收塔吸 收 塔
工业沸腾炉照片沸 腾 炉工业接触室照片接 触 室硫酸的性质一、浓硫酸的特性 1、吸水性 C12H22O1111H2O+12C2、脱水性 硫 酸一、浓硫酸的特性 1、吸水性 3、强氧化性 2、脱水性 一、浓硫酸的特性 1、吸水性 硫 酸氧化剂+63、强氧化性 2、脱水性 一、浓硫酸的特性 1、吸水性 硫 酸氧化剂+63、强氧化性 2、脱水性 一、浓硫酸的特性 1、吸水性 硫 酸结论:(1)浓硫酸氧化性比稀硫酸强 (2)非金属:氧化性。 金属:氧化性和酸性 二、应用1、下列气体可以用浓硫酸干燥的是
A. NH3 B. HBr C. HI D. SO2[练习]:分析(1)酸性:不能干燥碱性气体(2)氧化性:不能干燥还原性气体答案:D2、下列关于浓硫酸的说法错误的是:
A.敞口放置的浓硫酸,质量增加,说明浓硫酸具有吸水性;
B.常温下,浓硫酸可以用铝罐或铁罐贮存;
C.浓硫酸可以使纸屑、棉花变黑,表现了浓硫酸的脱水性;
D.如不慎在皮肤上沾上浓硫酸时,应立即用水冲洗。[学生练习]:答案:D3、Wg纯铜粉与足量浓硫酸反应,被还原的硫酸为
A. B. C. D.
[学生练习]:答案:B、D分析:(1)Cu——2H2SO4——H2SO4(被还原)(2)用物质的量表示,也可用质量表示。121 *4、向50ml18mol/L的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量
A.等于0.45mol B. 等于0.90mol
C. 小于0.45mol D.在0.45mol与0.90mol之间
[学生练习]:分析(1)n(H2SO4)=18mol/L×50mL ×10-3=0.90mol(3)随着反应的进行,浓硫酸转化为稀硫酸,便不再与铜反应。(2)Cu——2H2SO4——H2SO4(被还原)若0.90mol浓硫酸全部参加反应,则被还原的为0.45mol.答案:C3、强氧化性 2、脱水性 一、浓硫酸的特性 1、吸水性 硫 酸总结:(1)浓硫酸氧化性比稀硫酸强 (2)非金属:氧化性。 金属:氧化性和酸性 二、应用
工业沸腾炉照片沸 腾 炉工业接触室照片接 触 室硫酸的性质一、浓硫酸的特性 1、吸水性 C12H22O1111H2O+12C2、脱水性 硫 酸一、浓硫酸的特性 1、吸水性 3、强氧化性 2、脱水性 一、浓硫酸的特性 1、吸水性 硫 酸氧化剂+63、强氧化性 2、脱水性 一、浓硫酸的特性 1、吸水性 硫 酸氧化剂+63、强氧化性 2、脱水性 一、浓硫酸的特性 1、吸水性 硫 酸结论:(1)浓硫酸氧化性比稀硫酸强 (2)非金属:氧化性。 金属:氧化性和酸性 二、应用1、下列气体可以用浓硫酸干燥的是
A. NH3 B. HBr C. HI D. SO2[练习]:分析(1)酸性:不能干燥碱性气体(2)氧化性:不能干燥还原性气体答案:D2、下列关于浓硫酸的说法错误的是:
A.敞口放置的浓硫酸,质量增加,说明浓硫酸具有吸水性;
B.常温下,浓硫酸可以用铝罐或铁罐贮存;
C.浓硫酸可以使纸屑、棉花变黑,表现了浓硫酸的脱水性;
D.如不慎在皮肤上沾上浓硫酸时,应立即用水冲洗。[学生练习]:答案:D3、Wg纯铜粉与足量浓硫酸反应,被还原的硫酸为
A. B. C. D.
[学生练习]:答案:B、D分析:(1)Cu——2H2SO4——H2SO4(被还原)(2)用物质的量表示,也可用质量表示。121 *4、向50ml18mol/L的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量
A.等于0.45mol B. 等于0.90mol
C. 小于0.45mol D.在0.45mol与0.90mol之间
[学生练习]:分析(1)n(H2SO4)=18mol/L×50mL ×10-3=0.90mol(3)随着反应的进行,浓硫酸转化为稀硫酸,便不再与铜反应。(2)Cu——2H2SO4——H2SO4(被还原)若0.90mol浓硫酸全部参加反应,则被还原的为0.45mol.答案:C3、强氧化性 2、脱水性 一、浓硫酸的特性 1、吸水性 硫 酸总结:(1)浓硫酸氧化性比稀硫酸强 (2)非金属:氧化性。 金属:氧化性和酸性 二、应用
