碳 硅和无机非金属材料[上学期]
文档属性
| 名称 | 碳 硅和无机非金属材料[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-10-17 00:00:00 | ||
图片预览







文档简介
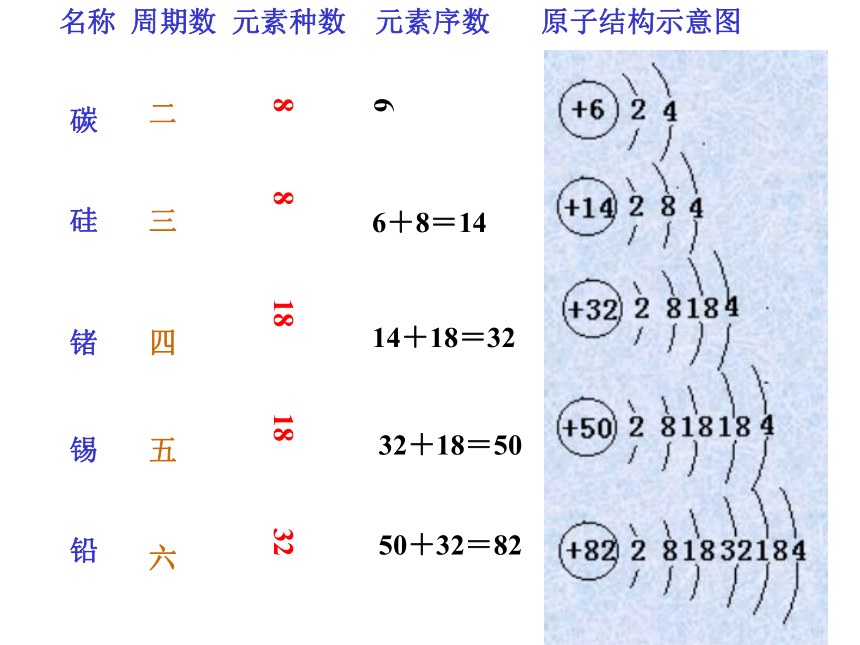
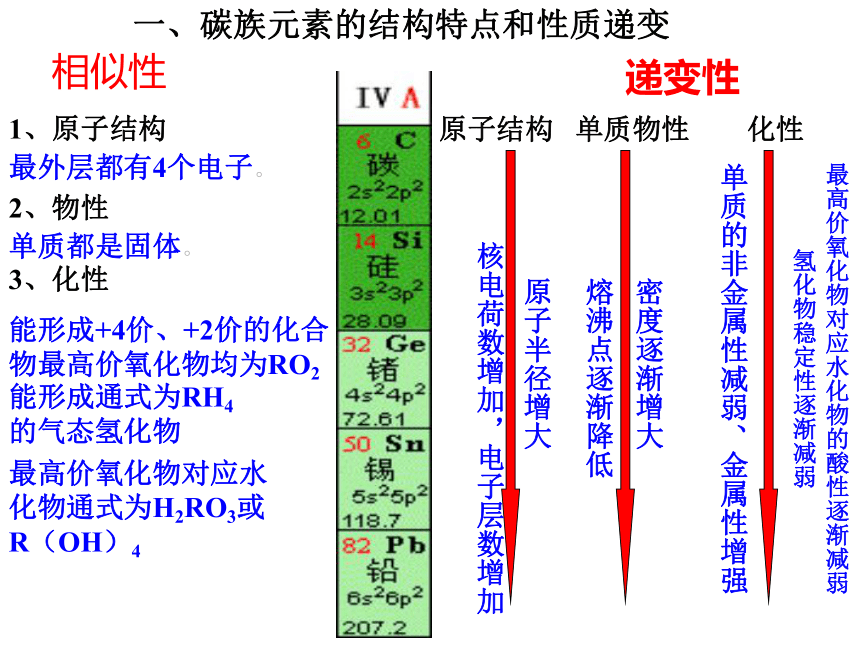
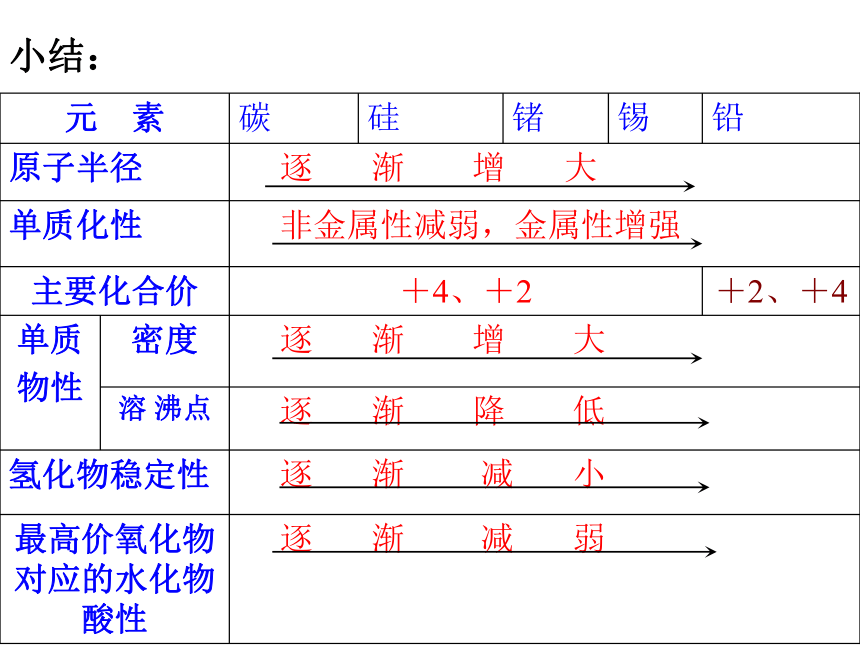
课件45张PPT。第七章 碳、硅和无机非金属材料 液晶氧化铝陶瓷氮化硅氧化锆陶瓷超导材料光导纤维 碳 硅 锗 锡 铅二 三 四 五 六8 8 18 18 32名称 周期数 元素种数 元素序数 原子结构示意图能形成+4价、+2价的化合物最高价氧化物均为RO2能形成通式为RH4
的气态氢化物最高价氧化物对应水化物通式为H2RO3或R(OH)4相似性递变性最外层都有4个电子。单质都是固体。核电荷数增加,电子层数增加原子半径增大熔沸点逐渐降低密度逐渐增大氢化物稳定性逐渐减弱最高价氧化物对应水化物的酸性逐渐减弱单质的非金属性减弱、金属性增强一、碳族元素的结构特点和性质递变1.下列关于碳族元素的叙述中,正确的是(??? )
(A)最外层上有2个电子??? (B)主要化合价均为+4
(C)稳定化合价均为+4? ??????(D)不易形成离子化合物
2.下列气态氢化物最不稳定的是(??? )
(A) PH3 ?(B)H2S? (C)HCl? (D)SiH4
3.某元素位于元素周期性表的ⅣA族,它是良好的半导体材料,其金属性比非金属性强,所以通常认为它是金属,此元素可能是(??? )
(A) Si?????????? (B) Ge????????????? (C) Sn????????????? ?(D) Pb
4.下列有关碳族元素的叙述中,不正确的是( ? )
(A)碳族元素易形成共价化合物
(B)碳族元素最高价氧化物均易溶于水
(C)碳族元素中硅和锗可作半导体材料
(D)碳族元素的非金属性向金属性递变的趋势没有氧族元素
明显课堂练习DDBB D5、锡、铅两种元素的主要化合价是+2价和+4价,其中+2价锡和+4价铅的化合物是不稳定的,+2价锡离子有强还原性,+4价铅化合物有强氧化性。如Sn2+比Fe2+还原性强,PbO2比Cl2氧化性强,写出下列反应的化学方程式:
①FeCl3溶液滴入SnCl2溶液;
②PbO2遇浓盐酸。
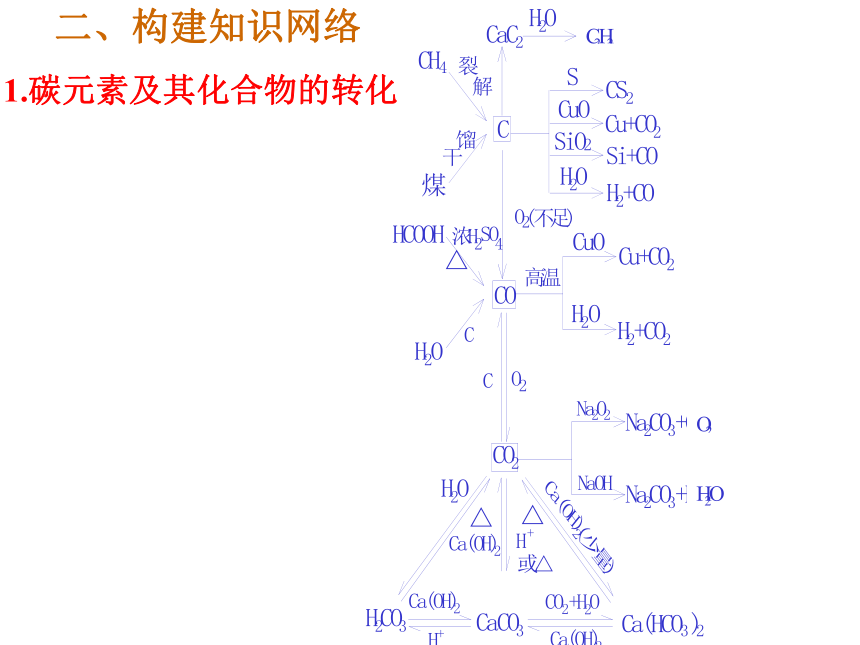
① 2 FeCl3+SnCl2=2 FeCl2+ SnCl4② PbO2+4HCl=PbCl2+2H2O+ Cl2↑ 答案:小结:碳的同素异形体金刚石石 墨C60碳族元素几种单质的晶体结构 晶体硅硅 1.碳元素及其化合物的转化
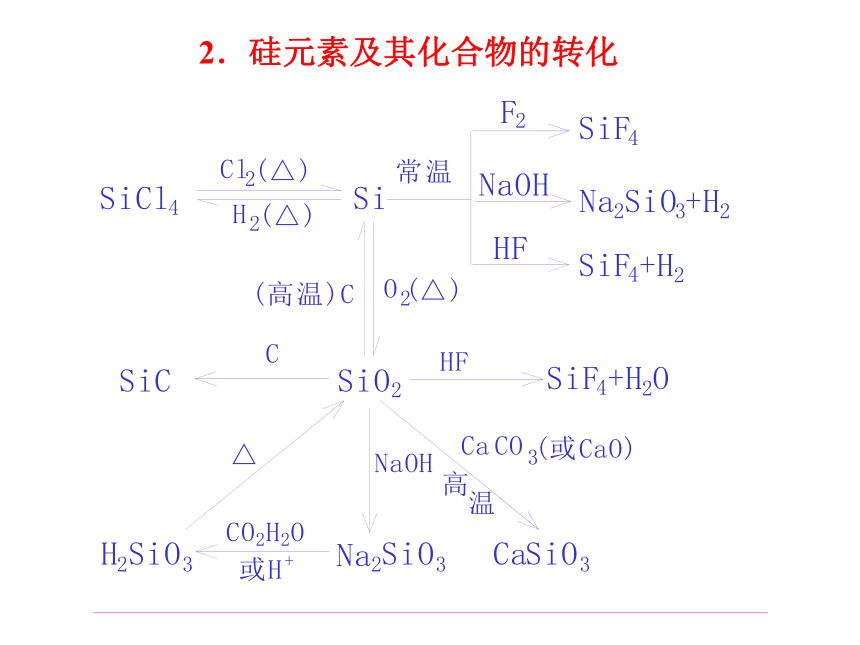
1.碳元素及其化合物的转化二、构建知识网络2.硅元素及其化合物的转化三、本族元素的单质及化合物的一些特征:1、在碳元素形成 的单质中:金刚石、石墨、及C60为同素异形体,其中金刚石的硬度最大,石墨的熔点最高。2、碳元素形成的化合物的种类最多(有机物)。3、在所有非金属元素形成的气态氢化物中,甲烷的含氢量最大4、612C为核素相对原子质量和物质的量的标准原子。5、硅在地壳中的含量仅次于氧是矿物和岩石的主要组成元素。6、重要的半导体材料:晶体硅和单质锗7、常见的原子晶体主要由本族元素组成四、典型物质的性质1.单质碳 (1)同素异形体的多样性
C原子间结合方式如: 金刚石,石墨分子中所含C原子数不同 如: C60(2)活性炭的重要性质和作用多孔疏松结构→吸附力强→吸附气体或溶液里的某些有色物质。
①去臭气——吸附水中有臭味物质(净化水)
②漂白——吸附某些食物和工业产品中的色素
③去毒——吸附有毒气体(如NO2、Cl2等)(用于防毒面具)
实例(3)碳的化学性质 常温:稳定 加热、高温或点燃:常表现还原性,作还原剂一般加热时,C → CO2
高温时,C → CO
C+2CuO 2Cu + CO2
C+4HNO3(浓) CO2↑+4NO2↑+2H2O
C+H2O CO+H2
2C+SiO2 2CO+Si
2.碳的氧化物1.已知反应C(石墨)===C(金刚石)为吸热反应,下列说法正确的是( )
A.石墨比金刚石稳定 B.金刚石比石墨稳定
C.石墨与金刚石一样稳定 D.以上说法都不对
2.将过量的CO2气体通入下列溶液中,最终溶液不变浑浊的是( )
A.CaCl2与NaOH的混合溶液 B.Ca(OH)2溶液
C.Na2CO3饱和溶液 D.Na2SiO3溶液
练习一AAB3.比较CO2和SiO23.下列离子方程式正确的是( )
A.少量Na2CO3溶液滴入到硝酸中:
H++CO32—===HCO3—
B 过量CO2通入到澄清的石灰水中 CO2+Ca2++2OH—===CaCO3↓+H2O
C 烧碱溶液与少量碳酸氢钙溶液混合 2OH—+Ca2++2HCO3—===CaCO3↓+CO32—+2H2O
D少量小苏打溶液与氢氧化钡溶液反应: HCO3—+Ba2++OH—===BaCO3↓+H2O
4.下列物质中不能用化合的方法制得的得( )
①SiO2 ②H2SiO3 ③Na2O2 ④FeCl2 ⑤FeCl3 ⑥CaSiO3
A.①③⑤ B.②④⑥ C.② D.②和④
练习二CDC4.Si的非寻常性
(1)硅不活泼、但自然界无游离态,通常以硅酸盐形式存在
(2)硅不与一般的强酸、强氧化性酸反应,但常温却下HF反应,且能置换出其中的H。
Si+4HF==SiF4+2H2↑
(3)碳不与碱液反应,但硅常温即可与碱液反应并放出H2,表现出与Al有相似性。
Si+2NaOH+2H2O==Na2SiO3+2H2↑
2Al+2NaOH+2H2O==2NaAlO2+3H2↑
⑷SiO2是硅酸的酸酐,但却不能溶于水生成硅酸。(怎么制备)⑸酸性氧化物一般不与酸反应而二氧化硅却能与HF反应 SiO2+4HF==SiF4 ↑ +2H2O⑹无机酸一般易溶于水,而硅酸和原硅酸却难溶于水。⑺非金属氧化物一般是分子晶体,而二氧化硅却是原子晶体。?⑻Na2SiO3的水溶液称水玻璃,但它却与玻璃的成分大不相同。硅酸钠的水溶液(即水玻璃)称泡花碱,但它却是盐的溶液,并不是碱溶液。
三、典型解析
例1.把26g含有SiO2和CaCO3固体在高温下加热至质量不再改变,冷却后称重为17.2g。
(1)写出有关的化学反应方程式
(2)求生成CO2的体积(标况)
(3)求原混合物中所含SiO2的质量。
解析:(1)SiO2+CaCO3 CaSiO3+CO2↑
CaCO3 CaO+CO2↑
从上述反应也可比较出两种盐的热稳定性:CaSiO3>CaCO3
在此高温条件下,CaCO3不会过剩,故前后固体质量减少值即为CO2质量。
m(CO2)==26g-17.2g=8.8g
n(CO2)=0.2mol,V(CO2)= 4.48L
CaCO3 ~ CO2
100g 1mol
20g 0.2mol
m(SiO2)=26g-20g=6g
5.根据硅在元素周期表中的位置推测,下列不可能具有的性质是( )
A.单质在通常状况下是固体
B.硅具有导电性 C.SiH4(硅烷)比CH4稳定
D.硅的常见化合价是+4
6.下列各组物质间,不能发生反应的是( )
A二氧化硅与氧化钙(高温) B二氧化硅与氢氧化钠(常温)
C.二氧化硅与碳(高温) D二氧化硅与浓HNO3(常温)
练习三CD7.石英砂和焦碳在高温电炉中,可以合成金刚砂,金刚砂硬度很大,工业上用来作磨料,以下说法不正确的是( )
A.金刚砂的化学成分是SiO2
B.反应方程式是SiO2+2C SiC+CO2
C.反应方程式是SiO2+3C SiC+CO
D.金刚砂的结构类似金刚石
ABGo思考下列问题:
如何除去下列物质中的杂质(括号内的物质为杂质) ① CO[CO2] ②CO2[CO]
③CO2[SO2. HCl] ④NaHCO3溶液[Na2CO3]
⑤Na2CO3[NaHCO3]
答案:①通过盛有澄清石灰水的洗气瓶②通过硬质玻璃管中灼热的CuO③通过盛有饱和NaHCO3溶液的洗气瓶④通入过量的二氧化碳⑤将其充分加热Gogo5.碳酸正盐和酸式盐
(1)溶解性:
①大多正盐难溶于水(除K+、Na+、NH4+) 而一般酸式碳酸盐均可溶于水
②同一种阳离子的盐 一般:酸式盐>正盐 如 Ca(HCO3)2>CaCO3 KHCO3>K2CO3
但 NaHCO3<Na2CO3
想一想:为什么在饱和Na2CO3溶液中通入足量的CO2有晶体析出?
提示:Na2CO3+CO2+H2O==2NaHCO3
106g 18g 168g
①溶剂水量减少
②生成NaHCO3质量比消耗的Na2CO3质量大
③同温下溶解性 NaHCO3<Na2CO3
(2)与酸反应的过程及速度(同条件)
H++CO32—==HCO3—
HCO3—+H+==H2O+CO2↑
放出气体速度:HCO3—>CO32—
(3)与碱液反应
Na2CO3+NaOH→不反应
NaHCO3+NaOH==Na2CO3+H2O
Na2CO3+Ca(OH)2==CaCO3↓+2NaOH
2NaHCO3+Ca(OH)2==CaCO3↓+Na2CO3+H2O
(4)热稳定性:
正盐>相应酸式盐
如: CaCO3 CaO+CO2↑
Ca(HCO3)2 CaCO3↓+H2O+CO2↑
Na2CO3 不分解
2NaHCO3 Na2CO3+CO2↑+H2O
(5)相互转化:
正盐(CO32—) 酸式盐(HCO3—)
(五)硅酸盐工业简介
陶瓷:
(1)主要原料:粘土
(2)生产过程:混合→成型→干燥→烧结→冷却→陶器
(3)陶与瓷的制取区别: ①原料粘土的纯度不同
②烧制温度不同。
(四)新型无机非金属材料
特性:(1)耐高温,高强度
(2)有电学、光学、生物学特性或功能
如:高温结构陶瓷(特点性能请看《第二教材》P131)
氧化铝陶瓷(人造刚玉)、氮化硅陶瓷
光导纤维:(能传导光信号的玻璃丝)制造材料是SiO2例2.矿泉水一般是由岩石风化后被地下水溶解其中可溶部分生成的,此处所措的风化作用是指矿物与水和CO2同时作用的过程。
例如钾长石(KAlSi3O8)风化生成高岭土[Al2Si2O5(OH)4],此后反应的离子方程式为:
2KalSi3O8+2H2CO3+9H2O==2K++2HCO3—+4H4SiO4+Al2Si2O5(OH)4.
(1)将上述复杂硅酸盐改写成氧化物形成
①KAlSi3O8______________ ②Al2Si2O5(OH)4
(2)上述反应能够发生的原因是______________
①KAlSi3O8 K2O·Al2O3·6SiO2
②Al2Si2O5(OH4) Al2O3·2SiO2·2H2O
(2)分析反应前后物质的种类,可知属于酸与盐发生的复分解反应,是由于酸H2CO3>H4SiO4.发生了较强的酸制较弱的酸反应。
解:(1)将复杂硅酸盐化学式改写成氧化物时,只需将除O以外所有的元素写出其常见氧化物,并用“·”将它们合起来,但需注意各种原子个数比符合原来的组成。在某种(或几种)氧化物前加合适系数。
8.下列材料的特征及用途说法不正确的是
( )
A.氧化铝陶瓷具有两性,可用来制造人造牙齿
B.氧化硅陶瓷耐高温且不易传热,可用来制造柴油机
C.光导纤维导光的能力很强,是非常好的通讯材料
D.人造刚玉硬度高,可用来制造刚玉球磨机
A练习四9.在标准状况下,将CO2和CO的混合气体,密为10/7g·L—1,充满一盛有足够Na2O2的密闭容器中(容积为22.4L),用间断的电火花引发至充分反应,反应完成后,对容器里存在的物质的叙述正确的是( )
A.存在0.5molCO
B.存在0.125molO2
C.存在0.25molNa2CO3
D.存在0.5molNa2CO3
Bback10.对于碳酸氢钠与碳酸钠的性质,下列叙述错误的是( )
A.质量相同时,跟足量的盐酸反应相同条件下碳酸钠的产生的CO2体积多
B.物质的量相同时,跟盐酸完全反应碳酸钠消耗的盐酸是碳酸氢钠的2倍(盐酸浓度相同)
C.物质的量相同时,跟足量盐酸反应,在相同状况下,得到等体积的CO2
D.将它们分别加入澄清石灰水中都会产生白色沉淀
A11.某无色混合气体可能含有CO2 、CO、H2O(气)、H2中的一种或几种,依次进行下列处理(假设每次处理的反应完全):①通过碱石灰、气体体积变小。②通过赤热的氧化铜时,固体全部变为红色。③通过白色硫酸铜粉末时,粉末变为蓝色。④通过澄清石灰水,溶液变浑浊。由此可以确定混合气体中( )
A.一定含有CO、H2O,可能含有H2、CO中的一种或两种
B.一定含有CO、H2O,可能含有CO2、H2中的一种或两种。
C.一定含有CO和H2,可能含有H2O、CO2中的一种或两种
D.一定含有CO,可能含有H2O、H2中的一种或两种
C12.工业上用生石灰与碳在2700℃高温作用下制电石和CO.现从理论上分析以Mg和石灰石为原料,按下图制取乙炔。请填写:
(1)C的分子式是_________
(2)G与E反应的化学方程式___________________
(3)B与D反应的化学方程式___________________
该反应中氧化剂与还原剂的质量比是____________。
高温MgOCaC2+2H2O=Ca(OH)2+C2H2 ↑CaO+3C===CaC2+CO ↑高温2∶1back?失电子能力Si>C,但上述反应中C作还原剂,SiO2中硅得到电子。原因是由于产物CO属于气体易逸出,促使反应向正方向进行。 back 金刚石是一种具有空间网状结构的原子晶体,在晶体中,每
个碳原子都被相邻的4个碳原子包围,处于4个碳原子的中心,以
共价键与4个碳原子结合。成为正四面体结构,这些正四面体向空
间发展,构成彼此联结的立体网状结构。金刚石的熔点(>3550℃)和沸点(4827℃)都很高,硬度很大。
109o28'金刚石Back120o共价键范德瓦尔斯力 石墨是层状结构,在每一层内,碳原子排成六边形,每个碳原子与其它
3个碳原子以共价键结合,形成平面的网状结构;在层与层之间,是以分子间
作用力结合的。由于同一层的碳原子以较强共价键结合,使石墨的熔点很高
(比金刚石的还要高) ,沸点与金刚石相同。但由于层与层之间的分子间作用
力很弱,容易滑动,使石墨的硬度很小。石墨Back3、碳的第三种同素异形体:足球烯Next C60图片晶体图片C60BackC60晶体结构应用<纳米碳管>nextSi109o28'晶体硅 晶体硅的晶体结构与金刚石相似,也是
由一个硅原子与4个硅原子结合形成
正四面体,许多这样的正四面体向
周围空间延伸形成空间网状
的结构。但由于硅原子半
径比碳原子半径大,所以,
其熔沸点要比金刚石低,
硬度要比金刚石小。返 回
的气态氢化物最高价氧化物对应水化物通式为H2RO3或R(OH)4相似性递变性最外层都有4个电子。单质都是固体。核电荷数增加,电子层数增加原子半径增大熔沸点逐渐降低密度逐渐增大氢化物稳定性逐渐减弱最高价氧化物对应水化物的酸性逐渐减弱单质的非金属性减弱、金属性增强一、碳族元素的结构特点和性质递变1.下列关于碳族元素的叙述中,正确的是(??? )
(A)最外层上有2个电子??? (B)主要化合价均为+4
(C)稳定化合价均为+4? ??????(D)不易形成离子化合物
2.下列气态氢化物最不稳定的是(??? )
(A) PH3 ?(B)H2S? (C)HCl? (D)SiH4
3.某元素位于元素周期性表的ⅣA族,它是良好的半导体材料,其金属性比非金属性强,所以通常认为它是金属,此元素可能是(??? )
(A) Si?????????? (B) Ge????????????? (C) Sn????????????? ?(D) Pb
4.下列有关碳族元素的叙述中,不正确的是( ? )
(A)碳族元素易形成共价化合物
(B)碳族元素最高价氧化物均易溶于水
(C)碳族元素中硅和锗可作半导体材料
(D)碳族元素的非金属性向金属性递变的趋势没有氧族元素
明显课堂练习DDBB D5、锡、铅两种元素的主要化合价是+2价和+4价,其中+2价锡和+4价铅的化合物是不稳定的,+2价锡离子有强还原性,+4价铅化合物有强氧化性。如Sn2+比Fe2+还原性强,PbO2比Cl2氧化性强,写出下列反应的化学方程式:
①FeCl3溶液滴入SnCl2溶液;
②PbO2遇浓盐酸。
① 2 FeCl3+SnCl2=2 FeCl2+ SnCl4② PbO2+4HCl=PbCl2+2H2O+ Cl2↑ 答案:小结:碳的同素异形体金刚石石 墨C60碳族元素几种单质的晶体结构 晶体硅硅 1.碳元素及其化合物的转化
1.碳元素及其化合物的转化二、构建知识网络2.硅元素及其化合物的转化三、本族元素的单质及化合物的一些特征:1、在碳元素形成 的单质中:金刚石、石墨、及C60为同素异形体,其中金刚石的硬度最大,石墨的熔点最高。2、碳元素形成的化合物的种类最多(有机物)。3、在所有非金属元素形成的气态氢化物中,甲烷的含氢量最大4、612C为核素相对原子质量和物质的量的标准原子。5、硅在地壳中的含量仅次于氧是矿物和岩石的主要组成元素。6、重要的半导体材料:晶体硅和单质锗7、常见的原子晶体主要由本族元素组成四、典型物质的性质1.单质碳 (1)同素异形体的多样性
C原子间结合方式如: 金刚石,石墨分子中所含C原子数不同 如: C60(2)活性炭的重要性质和作用多孔疏松结构→吸附力强→吸附气体或溶液里的某些有色物质。
①去臭气——吸附水中有臭味物质(净化水)
②漂白——吸附某些食物和工业产品中的色素
③去毒——吸附有毒气体(如NO2、Cl2等)(用于防毒面具)
实例(3)碳的化学性质 常温:稳定 加热、高温或点燃:常表现还原性,作还原剂一般加热时,C → CO2
高温时,C → CO
C+2CuO 2Cu + CO2
C+4HNO3(浓) CO2↑+4NO2↑+2H2O
C+H2O CO+H2
2C+SiO2 2CO+Si
2.碳的氧化物1.已知反应C(石墨)===C(金刚石)为吸热反应,下列说法正确的是( )
A.石墨比金刚石稳定 B.金刚石比石墨稳定
C.石墨与金刚石一样稳定 D.以上说法都不对
2.将过量的CO2气体通入下列溶液中,最终溶液不变浑浊的是( )
A.CaCl2与NaOH的混合溶液 B.Ca(OH)2溶液
C.Na2CO3饱和溶液 D.Na2SiO3溶液
练习一AAB3.比较CO2和SiO23.下列离子方程式正确的是( )
A.少量Na2CO3溶液滴入到硝酸中:
H++CO32—===HCO3—
B 过量CO2通入到澄清的石灰水中 CO2+Ca2++2OH—===CaCO3↓+H2O
C 烧碱溶液与少量碳酸氢钙溶液混合 2OH—+Ca2++2HCO3—===CaCO3↓+CO32—+2H2O
D少量小苏打溶液与氢氧化钡溶液反应: HCO3—+Ba2++OH—===BaCO3↓+H2O
4.下列物质中不能用化合的方法制得的得( )
①SiO2 ②H2SiO3 ③Na2O2 ④FeCl2 ⑤FeCl3 ⑥CaSiO3
A.①③⑤ B.②④⑥ C.② D.②和④
练习二CDC4.Si的非寻常性
(1)硅不活泼、但自然界无游离态,通常以硅酸盐形式存在
(2)硅不与一般的强酸、强氧化性酸反应,但常温却下HF反应,且能置换出其中的H。
Si+4HF==SiF4+2H2↑
(3)碳不与碱液反应,但硅常温即可与碱液反应并放出H2,表现出与Al有相似性。
Si+2NaOH+2H2O==Na2SiO3+2H2↑
2Al+2NaOH+2H2O==2NaAlO2+3H2↑
⑷SiO2是硅酸的酸酐,但却不能溶于水生成硅酸。(怎么制备)⑸酸性氧化物一般不与酸反应而二氧化硅却能与HF反应 SiO2+4HF==SiF4 ↑ +2H2O⑹无机酸一般易溶于水,而硅酸和原硅酸却难溶于水。⑺非金属氧化物一般是分子晶体,而二氧化硅却是原子晶体。?⑻Na2SiO3的水溶液称水玻璃,但它却与玻璃的成分大不相同。硅酸钠的水溶液(即水玻璃)称泡花碱,但它却是盐的溶液,并不是碱溶液。
三、典型解析
例1.把26g含有SiO2和CaCO3固体在高温下加热至质量不再改变,冷却后称重为17.2g。
(1)写出有关的化学反应方程式
(2)求生成CO2的体积(标况)
(3)求原混合物中所含SiO2的质量。
解析:(1)SiO2+CaCO3 CaSiO3+CO2↑
CaCO3 CaO+CO2↑
从上述反应也可比较出两种盐的热稳定性:CaSiO3>CaCO3
在此高温条件下,CaCO3不会过剩,故前后固体质量减少值即为CO2质量。
m(CO2)==26g-17.2g=8.8g
n(CO2)=0.2mol,V(CO2)= 4.48L
CaCO3 ~ CO2
100g 1mol
20g 0.2mol
m(SiO2)=26g-20g=6g
5.根据硅在元素周期表中的位置推测,下列不可能具有的性质是( )
A.单质在通常状况下是固体
B.硅具有导电性 C.SiH4(硅烷)比CH4稳定
D.硅的常见化合价是+4
6.下列各组物质间,不能发生反应的是( )
A二氧化硅与氧化钙(高温) B二氧化硅与氢氧化钠(常温)
C.二氧化硅与碳(高温) D二氧化硅与浓HNO3(常温)
练习三CD7.石英砂和焦碳在高温电炉中,可以合成金刚砂,金刚砂硬度很大,工业上用来作磨料,以下说法不正确的是( )
A.金刚砂的化学成分是SiO2
B.反应方程式是SiO2+2C SiC+CO2
C.反应方程式是SiO2+3C SiC+CO
D.金刚砂的结构类似金刚石
ABGo思考下列问题:
如何除去下列物质中的杂质(括号内的物质为杂质) ① CO[CO2] ②CO2[CO]
③CO2[SO2. HCl] ④NaHCO3溶液[Na2CO3]
⑤Na2CO3[NaHCO3]
答案:①通过盛有澄清石灰水的洗气瓶②通过硬质玻璃管中灼热的CuO③通过盛有饱和NaHCO3溶液的洗气瓶④通入过量的二氧化碳⑤将其充分加热Gogo5.碳酸正盐和酸式盐
(1)溶解性:
①大多正盐难溶于水(除K+、Na+、NH4+) 而一般酸式碳酸盐均可溶于水
②同一种阳离子的盐 一般:酸式盐>正盐 如 Ca(HCO3)2>CaCO3 KHCO3>K2CO3
但 NaHCO3<Na2CO3
想一想:为什么在饱和Na2CO3溶液中通入足量的CO2有晶体析出?
提示:Na2CO3+CO2+H2O==2NaHCO3
106g 18g 168g
①溶剂水量减少
②生成NaHCO3质量比消耗的Na2CO3质量大
③同温下溶解性 NaHCO3<Na2CO3
(2)与酸反应的过程及速度(同条件)
H++CO32—==HCO3—
HCO3—+H+==H2O+CO2↑
放出气体速度:HCO3—>CO32—
(3)与碱液反应
Na2CO3+NaOH→不反应
NaHCO3+NaOH==Na2CO3+H2O
Na2CO3+Ca(OH)2==CaCO3↓+2NaOH
2NaHCO3+Ca(OH)2==CaCO3↓+Na2CO3+H2O
(4)热稳定性:
正盐>相应酸式盐
如: CaCO3 CaO+CO2↑
Ca(HCO3)2 CaCO3↓+H2O+CO2↑
Na2CO3 不分解
2NaHCO3 Na2CO3+CO2↑+H2O
(5)相互转化:
正盐(CO32—) 酸式盐(HCO3—)
(五)硅酸盐工业简介
陶瓷:
(1)主要原料:粘土
(2)生产过程:混合→成型→干燥→烧结→冷却→陶器
(3)陶与瓷的制取区别: ①原料粘土的纯度不同
②烧制温度不同。
(四)新型无机非金属材料
特性:(1)耐高温,高强度
(2)有电学、光学、生物学特性或功能
如:高温结构陶瓷(特点性能请看《第二教材》P131)
氧化铝陶瓷(人造刚玉)、氮化硅陶瓷
光导纤维:(能传导光信号的玻璃丝)制造材料是SiO2例2.矿泉水一般是由岩石风化后被地下水溶解其中可溶部分生成的,此处所措的风化作用是指矿物与水和CO2同时作用的过程。
例如钾长石(KAlSi3O8)风化生成高岭土[Al2Si2O5(OH)4],此后反应的离子方程式为:
2KalSi3O8+2H2CO3+9H2O==2K++2HCO3—+4H4SiO4+Al2Si2O5(OH)4.
(1)将上述复杂硅酸盐改写成氧化物形成
①KAlSi3O8______________ ②Al2Si2O5(OH)4
(2)上述反应能够发生的原因是______________
①KAlSi3O8 K2O·Al2O3·6SiO2
②Al2Si2O5(OH4) Al2O3·2SiO2·2H2O
(2)分析反应前后物质的种类,可知属于酸与盐发生的复分解反应,是由于酸H2CO3>H4SiO4.发生了较强的酸制较弱的酸反应。
解:(1)将复杂硅酸盐化学式改写成氧化物时,只需将除O以外所有的元素写出其常见氧化物,并用“·”将它们合起来,但需注意各种原子个数比符合原来的组成。在某种(或几种)氧化物前加合适系数。
8.下列材料的特征及用途说法不正确的是
( )
A.氧化铝陶瓷具有两性,可用来制造人造牙齿
B.氧化硅陶瓷耐高温且不易传热,可用来制造柴油机
C.光导纤维导光的能力很强,是非常好的通讯材料
D.人造刚玉硬度高,可用来制造刚玉球磨机
A练习四9.在标准状况下,将CO2和CO的混合气体,密为10/7g·L—1,充满一盛有足够Na2O2的密闭容器中(容积为22.4L),用间断的电火花引发至充分反应,反应完成后,对容器里存在的物质的叙述正确的是( )
A.存在0.5molCO
B.存在0.125molO2
C.存在0.25molNa2CO3
D.存在0.5molNa2CO3
Bback10.对于碳酸氢钠与碳酸钠的性质,下列叙述错误的是( )
A.质量相同时,跟足量的盐酸反应相同条件下碳酸钠的产生的CO2体积多
B.物质的量相同时,跟盐酸完全反应碳酸钠消耗的盐酸是碳酸氢钠的2倍(盐酸浓度相同)
C.物质的量相同时,跟足量盐酸反应,在相同状况下,得到等体积的CO2
D.将它们分别加入澄清石灰水中都会产生白色沉淀
A11.某无色混合气体可能含有CO2 、CO、H2O(气)、H2中的一种或几种,依次进行下列处理(假设每次处理的反应完全):①通过碱石灰、气体体积变小。②通过赤热的氧化铜时,固体全部变为红色。③通过白色硫酸铜粉末时,粉末变为蓝色。④通过澄清石灰水,溶液变浑浊。由此可以确定混合气体中( )
A.一定含有CO、H2O,可能含有H2、CO中的一种或两种
B.一定含有CO、H2O,可能含有CO2、H2中的一种或两种。
C.一定含有CO和H2,可能含有H2O、CO2中的一种或两种
D.一定含有CO,可能含有H2O、H2中的一种或两种
C12.工业上用生石灰与碳在2700℃高温作用下制电石和CO.现从理论上分析以Mg和石灰石为原料,按下图制取乙炔。请填写:
(1)C的分子式是_________
(2)G与E反应的化学方程式___________________
(3)B与D反应的化学方程式___________________
该反应中氧化剂与还原剂的质量比是____________。
高温MgOCaC2+2H2O=Ca(OH)2+C2H2 ↑CaO+3C===CaC2+CO ↑高温2∶1back?失电子能力Si>C,但上述反应中C作还原剂,SiO2中硅得到电子。原因是由于产物CO属于气体易逸出,促使反应向正方向进行。 back 金刚石是一种具有空间网状结构的原子晶体,在晶体中,每
个碳原子都被相邻的4个碳原子包围,处于4个碳原子的中心,以
共价键与4个碳原子结合。成为正四面体结构,这些正四面体向空
间发展,构成彼此联结的立体网状结构。金刚石的熔点(>3550℃)和沸点(4827℃)都很高,硬度很大。
109o28'金刚石Back120o共价键范德瓦尔斯力 石墨是层状结构,在每一层内,碳原子排成六边形,每个碳原子与其它
3个碳原子以共价键结合,形成平面的网状结构;在层与层之间,是以分子间
作用力结合的。由于同一层的碳原子以较强共价键结合,使石墨的熔点很高
(比金刚石的还要高) ,沸点与金刚石相同。但由于层与层之间的分子间作用
力很弱,容易滑动,使石墨的硬度很小。石墨Back3、碳的第三种同素异形体:足球烯Next C60图片晶体图片C60BackC60晶体结构应用<纳米碳管>nextSi109o28'晶体硅 晶体硅的晶体结构与金刚石相似,也是
由一个硅原子与4个硅原子结合形成
正四面体,许多这样的正四面体向
周围空间延伸形成空间网状
的结构。但由于硅原子半
径比碳原子半径大,所以,
其熔沸点要比金刚石低,
硬度要比金刚石小。返 回
