无机非金属材料的主角---硅[上学期]
文档属性
| 名称 | 无机非金属材料的主角---硅[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-12-03 00:00:00 | ||
图片预览







文档简介
课件23张PPT。硅谷:思考:提及到“硅”这一个词,你能联想到哪些?美国新兴的高技术产业开发区,电子技术研究中心,计算机生产的重要基地,位于加利福尼亚州圣弗朗西斯科南端.半导体:单晶硅是半导体器材的核心材料,硅半导体是集成电路的主要材料,估计在21世纪,硅仍然会占半导体材料的95%以上.沙子、石英、水晶:主要成分是硅的氧化物光导纤维:从石英玻璃熔融体中,拉出直径为100微米的细丝.
再把千百根光导纤维组合并增强处理,就制成成光缆,其优点:质轻,体积小,输送距离长,保密性好,成本低.§1无机非金属材料的主角—硅Si在地壳中含量丰富,仅次于O,约占26.3%Si是一种亲氧元素
无游离态
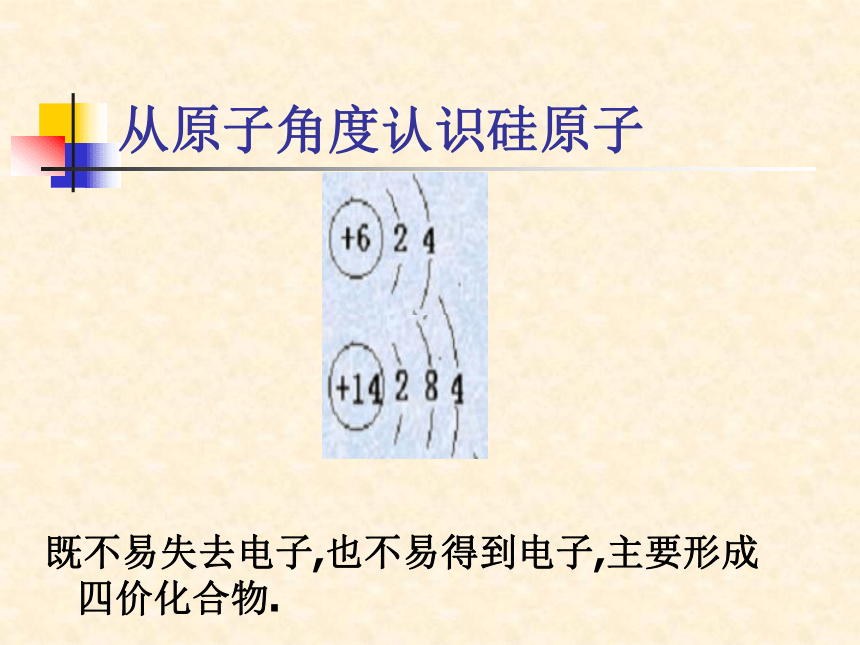
化合态:硅的氧化物和硅酸盐从原子角度认识硅原子既不易失去电子,也不易得到电子,主要形成四价化合物.一.二氧化硅(SiO2)天然的SiO2约占地壳质量的12%硅石结晶形无定形石英水晶玛瑙硅藻土水晶玛瑙结构:[SiO4]四面体
每1个Si原子周围结合4个O原子,Si在中心,O在四个顶角.
同时每1个O原子周围结合2个Si原子相结合。
二氧化硅中氧原子与硅原子个数比为2:1,通常用SiO2来表示二氧化硅的组成.结构与性质的关系:SiO2的网状结构物理性质:熔点高,硬度大的固体
不溶于水,纯净的SiO2晶体无色透明SiO2的化学性质(很不活泼)2.特性
与HF的反应
SiO2 + 4HF = SiF4↑+ 2H2O
*用途:雕刻玻璃1.酸性氧化物
与碱性氧化物反应生成盐
SiO2+ CaO == CaSiO3
与强碱反应生成盐和水
SiO2 + 2NaOH = Na2SiO3 +H2O
硅酸钠
高温3.弱氧化性
高温高温高温SiO2+2C == Si+2CO↑
4.与某些盐反应
SiO2 + Na2CO3 == Na2SiO3+CO2↑
SiO2 + CaCO3 == CaSiO3+CO2↑
想一想1. 为什么在实验室中盛放NaOH 溶液的试剂瓶用橡皮塞而不用玻璃塞? 玻璃中的SiO2 与NaOH 反应生成有粘胶性的硅酸钠2.实验室为什么不用玻璃瓶盛装氢氟酸?HF能腐蚀玻璃,因此,盛装氢氟酸不能用玻璃试剂瓶而要用塑料瓶。
3.某同学根据SiO2既可与碱反应,也能与氢氟酸反应,推断SiO2为两性氧化物.是否正确?P65 实验4-1观察现象并填写下表滴入酚酞溶液显红色,再滴入盐酸红色消失,并有透明胶状物质生成Na2SiO3溶液呈碱性,与酸反应生成了H2SiO3Na2SiO3 + 2HCl = H2SiO3 + 2NaCl二.硅酸 (H2SiO3)制备:
可溶性硅酸盐(如Na2SiO3)与酸反应
Na2SiO3 + 2HCl = H2SiO3 + 2NaClNa2SiO3 + CO2+H2O= H2SiO3 + 2Na2CO3性质:白色,胶状,不溶于水的物质
酸性比碳酸弱.
用途:可作干燥剂和催化剂的载体小结:1.SiO2
存在形态
物理性质
化学性质
2. H2SiO3
制备
用途
二氧化碳二氧化硅空气硅石、石英、水晶、玛瑙、沙子、硅藻土熔、沸点低, 微溶于水熔点高,硬度大,不溶于水CO2+H2O=H2CO3不反应CO2+2NaOH=Na2CO3+H2OSiO2+2NaOH=Na2SiO3+H2OCO2+CaO=CaCO3存 在物理性质不反应与氢氟酸反应SiO2+4HF=SiF4↑+2H2O化学性质与水反应与NaOH反应与CaO反应与酸反应课堂练习1:1.填表并比较.练习2:CO2通入下列各溶液中,不可能产生沉淀的是 ( )
A 石灰水 B 饱和碳酸钠溶液
C 硅酸钠溶液 D 氯化钙溶液
下列物质中主要成分不是SiO2 的是( )
A水晶 B玛瑙 C硅石 D硅胶
下列物质中,能够与NaOH溶液反应的是( )
A 碳酸钠 B硅酸钠 C二氧化硅 D氢氧化铝
再把千百根光导纤维组合并增强处理,就制成成光缆,其优点:质轻,体积小,输送距离长,保密性好,成本低.§1无机非金属材料的主角—硅Si在地壳中含量丰富,仅次于O,约占26.3%Si是一种亲氧元素
无游离态
化合态:硅的氧化物和硅酸盐从原子角度认识硅原子既不易失去电子,也不易得到电子,主要形成四价化合物.一.二氧化硅(SiO2)天然的SiO2约占地壳质量的12%硅石结晶形无定形石英水晶玛瑙硅藻土水晶玛瑙结构:[SiO4]四面体
每1个Si原子周围结合4个O原子,Si在中心,O在四个顶角.
同时每1个O原子周围结合2个Si原子相结合。
二氧化硅中氧原子与硅原子个数比为2:1,通常用SiO2来表示二氧化硅的组成.结构与性质的关系:SiO2的网状结构物理性质:熔点高,硬度大的固体
不溶于水,纯净的SiO2晶体无色透明SiO2的化学性质(很不活泼)2.特性
与HF的反应
SiO2 + 4HF = SiF4↑+ 2H2O
*用途:雕刻玻璃1.酸性氧化物
与碱性氧化物反应生成盐
SiO2+ CaO == CaSiO3
与强碱反应生成盐和水
SiO2 + 2NaOH = Na2SiO3 +H2O
硅酸钠
高温3.弱氧化性
高温高温高温SiO2+2C == Si+2CO↑
4.与某些盐反应
SiO2 + Na2CO3 == Na2SiO3+CO2↑
SiO2 + CaCO3 == CaSiO3+CO2↑
想一想1. 为什么在实验室中盛放NaOH 溶液的试剂瓶用橡皮塞而不用玻璃塞? 玻璃中的SiO2 与NaOH 反应生成有粘胶性的硅酸钠2.实验室为什么不用玻璃瓶盛装氢氟酸?HF能腐蚀玻璃,因此,盛装氢氟酸不能用玻璃试剂瓶而要用塑料瓶。
3.某同学根据SiO2既可与碱反应,也能与氢氟酸反应,推断SiO2为两性氧化物.是否正确?P65 实验4-1观察现象并填写下表滴入酚酞溶液显红色,再滴入盐酸红色消失,并有透明胶状物质生成Na2SiO3溶液呈碱性,与酸反应生成了H2SiO3Na2SiO3 + 2HCl = H2SiO3 + 2NaCl二.硅酸 (H2SiO3)制备:
可溶性硅酸盐(如Na2SiO3)与酸反应
Na2SiO3 + 2HCl = H2SiO3 + 2NaClNa2SiO3 + CO2+H2O= H2SiO3 + 2Na2CO3性质:白色,胶状,不溶于水的物质
酸性比碳酸弱.
用途:可作干燥剂和催化剂的载体小结:1.SiO2
存在形态
物理性质
化学性质
2. H2SiO3
制备
用途
二氧化碳二氧化硅空气硅石、石英、水晶、玛瑙、沙子、硅藻土熔、沸点低, 微溶于水熔点高,硬度大,不溶于水CO2+H2O=H2CO3不反应CO2+2NaOH=Na2CO3+H2OSiO2+2NaOH=Na2SiO3+H2OCO2+CaO=CaCO3存 在物理性质不反应与氢氟酸反应SiO2+4HF=SiF4↑+2H2O化学性质与水反应与NaOH反应与CaO反应与酸反应课堂练习1:1.填表并比较.练习2:CO2通入下列各溶液中,不可能产生沉淀的是 ( )
A 石灰水 B 饱和碳酸钠溶液
C 硅酸钠溶液 D 氯化钙溶液
下列物质中主要成分不是SiO2 的是( )
A水晶 B玛瑙 C硅石 D硅胶
下列物质中,能够与NaOH溶液反应的是( )
A 碳酸钠 B硅酸钠 C二氧化硅 D氢氧化铝
