无机非金属材料的主角—硅[上学期]
文档属性
| 名称 | 无机非金属材料的主角—硅[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 51.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-03-07 00:00:00 | ||
图片预览






文档简介
课件15张PPT。第四章 第一节
无机非金属材料的主角—硅
一、二氧化硅和硅酸(一)二氧化硅
1、物理性质:
有晶体和无定形两大类。晶体二氧化硅叫石英、水晶,天然二氧化硅叫硅石。坚硬难熔的固体2、化学性质(1)酸性氧化物:但是不溶于水,也不与水反应
与氢氧化钠作用:
SiO2 + 2NaOH=== Na2SiO3+H2O
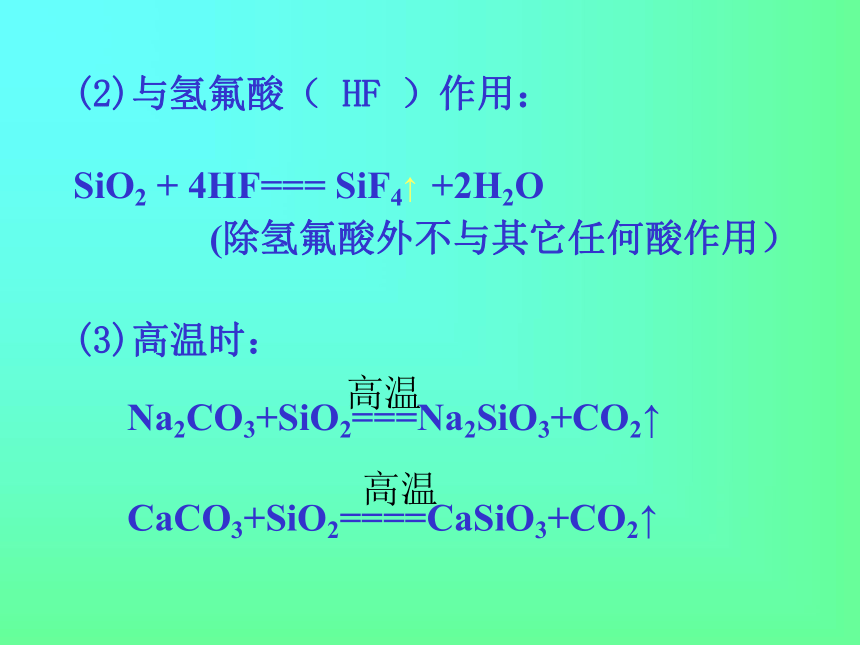
(除氢氟酸外不与其它任何酸作用)
(3)高温时:
3、二氧化硅的用途 硅石——建筑材料(坚硬难熔的固体)
光纤——高性能通信材料 石英——石英玻璃
(石英电子表、石英钟、耐高温的试管) 水晶——电子工业(重要部件、光学仪器)、
工艺品、眼镜片 玛瑙——精密仪器的轴承、耐磨器皿、装饰品(二)硅酸(H2SiO3)硅酸不溶于水,属于弱酸,其酸性比碳酸弱:H2SiO3 + 2NaOH === Na2SiO3+2H2O硅酸的制备SiO2 + 2NaOH === Na2SiO3+H2ONa2SiO3+CO2+H2O===Na2CO3+H2SiO3↓ Na2SiO3 + 2HCl === H2SiO3 ↓ + 2NaCl二、硅酸盐1、结构复杂,种类繁多,多数不溶于
水(钾与钠盐易溶)是构成地壳岩石
的主要成分。2、用二氧化硅和金属氧化物的形式 表示其组成:硅酸钠 Na2SiO3 (Na2O·SiO2)4、常见硅酸盐材料
陶瓷
玻璃
水泥三、硅单质1、硅在自然界的存在、含量、分布不存在游离态的硅,硅元素存在的二氧化硅及硅酸盐中 地壳中含量仅次于氧、占第二位 分布于各种矿物和岩石里,是构成矿物和岩石的主要成分2、物理性质:灰黑色,有金属光泽、硬而脆的固体,
熔沸点较高。是良好的半导体材料。3、硅的化学性质 常温下, 不活泼,只与氟气、氢氟酸、强碱作用 Si+2F2==SiF4Si+4HF==SiF4+2H2 加热下,硅可与许多非金属反应 4、硅的工业制备和用途 工业制备
SiO2+2C====Si+2CO 高温Si + 2Cl2 ==== SiCl4加热高温SiCl4 + 2H2 ==== Si + 4HCl粗硅提纯:用途
一、二氧化硅和硅酸(一)二氧化硅
1、物理性质:
有晶体和无定形两大类。晶体二氧化硅叫石英、水晶,天然二氧化硅叫硅石。坚硬难熔的固体2、化学性质(1)酸性氧化物:但是不溶于水,也不与水反应
与氢氧化钠作用:
SiO2 + 2NaOH=== Na2SiO3+H2O
(除氢氟酸外不与其它任何酸作用)
(3)高温时:
3、二氧化硅的用途 硅石——建筑材料(坚硬难熔的固体)
光纤——高性能通信材料 石英——石英玻璃
(石英电子表、石英钟、耐高温的试管) 水晶——电子工业(重要部件、光学仪器)、
工艺品、眼镜片 玛瑙——精密仪器的轴承、耐磨器皿、装饰品(二)硅酸(H2SiO3)硅酸不溶于水,属于弱酸,其酸性比碳酸弱:H2SiO3 + 2NaOH === Na2SiO3+2H2O硅酸的制备SiO2 + 2NaOH === Na2SiO3+H2ONa2SiO3+CO2+H2O===Na2CO3+H2SiO3↓ Na2SiO3 + 2HCl === H2SiO3 ↓ + 2NaCl二、硅酸盐1、结构复杂,种类繁多,多数不溶于
水(钾与钠盐易溶)是构成地壳岩石
的主要成分。2、用二氧化硅和金属氧化物的形式 表示其组成:硅酸钠 Na2SiO3 (Na2O·SiO2)4、常见硅酸盐材料
陶瓷
玻璃
水泥三、硅单质1、硅在自然界的存在、含量、分布不存在游离态的硅,硅元素存在的二氧化硅及硅酸盐中 地壳中含量仅次于氧、占第二位 分布于各种矿物和岩石里,是构成矿物和岩石的主要成分2、物理性质:灰黑色,有金属光泽、硬而脆的固体,
熔沸点较高。是良好的半导体材料。3、硅的化学性质 常温下, 不活泼,只与氟气、氢氟酸、强碱作用 Si+2F2==SiF4Si+4HF==SiF4+2H2 加热下,硅可与许多非金属反应 4、硅的工业制备和用途 工业制备
SiO2+2C====Si+2CO 高温Si + 2Cl2 ==== SiCl4加热高温SiCl4 + 2H2 ==== Si + 4HCl粗硅提纯:用途
