无机非金属材料的主角-硅[下学期]
文档属性
| 名称 | 无机非金属材料的主角-硅[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-04-23 20:23:00 | ||
图片预览








文档简介
课件22张PPT。高考第一轮复习(必修1—08)
第四章 非金属及其化合物(1)
无机非金属材料的主角要求:1、认真听讲
2、适当做好听课笔记
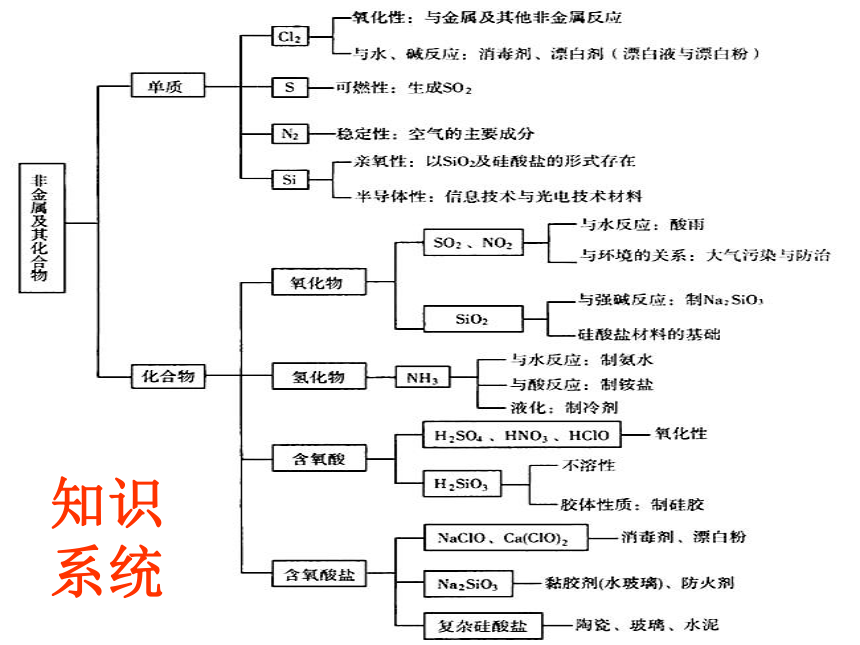
3、及时做相应的巩固练习知识系统第四章
非金属及其化合物第一节
无机非金属材料
的主角——硅占地壳质量的90%以上地球生物生存的根基——硅酸盐、空气、水、阳光学习目标:
1、了解硅元素在自然界的存在,硅的原子结构及性质。
2、了解二氧化硅的存在、性质和重要用途。
3、了解硅酸、硅酸盐的主要性质和用途;硅单质的制法。
重点: SiO2的性质。
难点:SiO2的结构、硅酸盐的组成1、Si在自然界中的存在形态:概况:(阅读P.62中段后小结)2、Si在自然界中的存在形式:3、Si在周期表中位于: 4、C、Si原子的最外电子层上有4个电子(画出C、Si原子的结构简图),其原子既难失去电子又难得到电子(难于形成阴、阳离子),主要形成4价的化合物。 SiO2和硅酸盐C:+2、+4、-4Si:+4、-4化合态5、主要化合价第IVA族第3周期。一、二氧化硅和硅酸
1、二氧化硅(SiO2)(1)存在:结晶形:石英无定形水晶玛瑙…… (2) SiO2晶体是具有正四面体结构的立体网状结构的晶体。 SiO2不是分子式,是化学式,表示二氧化硅晶体中硅氧原子的个数比。(3)、 SiO2物理性质: SiO2是一坚硬难熔的固体不溶于水,纯净的二氧化硅无色透明。硅石(12%)(用途广泛)(4) 、SiO2的化学性质 很稳定 ?是酸性氧化物,具有酸性氧化物的通性。高温a 、不能与水化合b、与碱性氧化物化合:SiO2+CaO CaSiO3
SiO2+Na2O Na2SiO3C、与碱反应:SiO2+2NaOH Na2SiO3+H2O注意:盛碱溶液的试剂瓶一般用橡胶塞,不能用
玻璃塞。为什么?高温?与HF反应:SiO2+4HF SiF4↑+2H2O注意:一般用塑料试剂瓶盛氢氟酸,不能用玻璃
试剂瓶。为什么?(用于雕刻玻璃)?弱氧化性:SiO2 + 2C Si + 2CO↑高温Si + C SiC(金刚砂)高温SiO2 + 3C SiC + 2CO↑高温SiO2 + 2Mg Si+ 2MgO高温SiO2 + 4Mg Mg2Si + 2MgO高温?与Na2CO3等反应:
SiO2 + Na2CO3 Na2SiO3 + CO2↑
SiO2 + CaCO3 CaSiO3 + CO2↑高温高温
制光导纤维、石英玻璃、石英钟表等;制造电子工业中的重要部件、光学仪器、高级工艺品、眼镜片、精密仪器、轴承、耐磨器皿等;制作装饰品。
(5)、SiO2的用途与危害:
在隧道开凿,石英粉加工等工作环境下易形成含有二氧化硅的粉尘,人长期吸入含有二氧化硅的粉尘,就会患硅肺病(旧称矽肺)。危害:用途:二氧化硅和二氧化碳的比较CO2SiO2表示二氧化碳分子及其组成表示二氧化硅晶体中硅氧原子个数比气态固态很小很大可溶于水不溶于水很低很高高温稳定很稳定CO2+H2O=H2CO3不反应CO2+CaO = CaCO3SiO2+CaO = CaSiO3CO2+2NaOH =
Na2CO3+H2OSiO2+2NaOH =
Na2SiO3+H2O不反应SiO2+4HF =
SiF4↑+2H2O化学性质高温 SiO2 + Na2CO3 ===
Na2SiO3 + CO2↑
SiO2 + CaCO3 ==
CaSiO3 + CO2↑高温高温CO2 + C === 2CO高温 SiO2 + 2C ===
Si + 2CO↑CO2+H2O+Na2CO3
==2NaHCO3
CO2 +H2O+ CaCO3
== Ca(HCO3)22、硅酸(H2SiO3) H2SiO3是SiO2的对应水化物( SiO2 是H2SiO3的酸酐),是一种不溶性酸,是一种白色固体,其酸性比H2CO3还弱。(1)制法——可溶性硅酸盐与酸反应:滴入酚酞后溶液变为红色,再滴入稀盐酸,溶液红色变浅至无色,同时有白色胶状沉淀产生 a、Na2SiO3溶液呈碱性,b、可溶性硅酸盐与盐酸反应生成不溶于水的硅酸,c、先形成硅酸溶胶,后形成硅酸凝胶,d、静置则形成硅酸沉淀。实验4-1Na2SiO3 + 2HCl == 2NaCl + H2SiO3↓(2)酸性太弱,只能与强碱发生中和反应
H2SiO3 + 2NaOH == Na2SiO3 + 2H2O(3)不稳定(比H2CO3稳定),受热易分解 用H2CO3可制得H2SiO3 ,可证明H2SiO3 的酸性比H2CO3弱。SiO32- + H2O + CO2== CO32- + H2SiO3↓Na2SiO3 + H2O + CO2 == Na2CO3 + H2SiO3↓ SiO32- + 2H+ == H2SiO3↓Na2SiO3 + 2HCl == 2NaCl + H2SiO3↓3、硅酸钠(Na2SiO3),俗名叫泡花碱,白色固体,易溶 于水,其水溶液俗名叫水玻璃。2、结构复杂,一般不溶于水,化学性质很稳定1、由硅、氧和金属元素组成的化合物的总称。二、硅酸盐先变干,后燃烧仅变干,不燃烧Na2SiO3溶液可作木材、纸张的防火剂 水玻璃是无色粘稠的液体,不能燃烧,不易被腐蚀,热稳定性强。可用作肥皂填料,木材、织物的防腐剂和防火剂,建筑、纸张的黏胶剂。(2)氧化物化学式法:
金属氧化物(低价?高价)?二氧化硅?水(1)盐化学式法:
如:Na2SiO3、CaSiO3、K2SiO3 等4、硅酸盐组成的表示方法:滑 石:3MgO?4SiO2?H2O云 母:K2O?3Al2O3?6SiO2?2H2O沸 石:Na2O?Al2O3?3SiO2?2H2O石 棉:3MgO?CaO?4SiO2高岭石(黏土):Al2O3?2SiO2?2H2O 如:能表示成盐的形式吗?5、土壤胶体的形成、特点和应用:
(阅读上段P.66)6、重要的无机非金属材料:
(1)传统硅酸盐材料 :陶瓷、玻璃、水泥
(2)新型无机非金属材料:新型陶瓷、光导纤维……阅读P.66~67[科学视野]
(3)其它:见P.671、晶体结构三、硅单质 硅单质有晶体和无定形两种,晶体硅的结构跟金刚石相似,都是具有正四面体结构的立体网状结构的晶体。3、化学性质 常温下,硅的化学性质很稳定,除F2、HF和强碱外,硅不跟其它物质(如O2、Cl2、H2SO4、HNO3等 )反应。
晶体硅是带有金属光泽、灰黑色、硬而脆的固体,熔、沸点高,导电性介于导体和绝缘体之间,是良好的半导体材料。2、物理性质(1)常温下能发生的反应
Si+2F2== SiF4 Si+4HF= SiF4 ↑ +2H2↑
Si+2NaOH+H2O==Na2SiO3+2H2↑生氢剂:4、用途 晶体硅可用来制造集成电路、晶体管、整流器等半导体器件和光电池,硅芯片是各种计算机、微电子产品的核心,硅还可以用于制造铝合金、铁合金等。5、硅的工业制法 高纯硅的一般纯度要求达到99.9999%,甚至达到99.9999999%以上。布置作业:1、熟记本节课涉及的化学方程式
2、完成优化设计同步训练相应练习
第四章 非金属及其化合物(1)
无机非金属材料的主角要求:1、认真听讲
2、适当做好听课笔记
3、及时做相应的巩固练习知识系统第四章
非金属及其化合物第一节
无机非金属材料
的主角——硅占地壳质量的90%以上地球生物生存的根基——硅酸盐、空气、水、阳光学习目标:
1、了解硅元素在自然界的存在,硅的原子结构及性质。
2、了解二氧化硅的存在、性质和重要用途。
3、了解硅酸、硅酸盐的主要性质和用途;硅单质的制法。
重点: SiO2的性质。
难点:SiO2的结构、硅酸盐的组成1、Si在自然界中的存在形态:概况:(阅读P.62中段后小结)2、Si在自然界中的存在形式:3、Si在周期表中位于: 4、C、Si原子的最外电子层上有4个电子(画出C、Si原子的结构简图),其原子既难失去电子又难得到电子(难于形成阴、阳离子),主要形成4价的化合物。 SiO2和硅酸盐C:+2、+4、-4Si:+4、-4化合态5、主要化合价第IVA族第3周期。一、二氧化硅和硅酸
1、二氧化硅(SiO2)(1)存在:结晶形:石英无定形水晶玛瑙…… (2) SiO2晶体是具有正四面体结构的立体网状结构的晶体。 SiO2不是分子式,是化学式,表示二氧化硅晶体中硅氧原子的个数比。(3)、 SiO2物理性质: SiO2是一坚硬难熔的固体不溶于水,纯净的二氧化硅无色透明。硅石(12%)(用途广泛)(4) 、SiO2的化学性质 很稳定 ?是酸性氧化物,具有酸性氧化物的通性。高温a 、不能与水化合b、与碱性氧化物化合:SiO2+CaO CaSiO3
SiO2+Na2O Na2SiO3C、与碱反应:SiO2+2NaOH Na2SiO3+H2O注意:盛碱溶液的试剂瓶一般用橡胶塞,不能用
玻璃塞。为什么?高温?与HF反应:SiO2+4HF SiF4↑+2H2O注意:一般用塑料试剂瓶盛氢氟酸,不能用玻璃
试剂瓶。为什么?(用于雕刻玻璃)?弱氧化性:SiO2 + 2C Si + 2CO↑高温Si + C SiC(金刚砂)高温SiO2 + 3C SiC + 2CO↑高温SiO2 + 2Mg Si+ 2MgO高温SiO2 + 4Mg Mg2Si + 2MgO高温?与Na2CO3等反应:
SiO2 + Na2CO3 Na2SiO3 + CO2↑
SiO2 + CaCO3 CaSiO3 + CO2↑高温高温
制光导纤维、石英玻璃、石英钟表等;制造电子工业中的重要部件、光学仪器、高级工艺品、眼镜片、精密仪器、轴承、耐磨器皿等;制作装饰品。
(5)、SiO2的用途与危害:
在隧道开凿,石英粉加工等工作环境下易形成含有二氧化硅的粉尘,人长期吸入含有二氧化硅的粉尘,就会患硅肺病(旧称矽肺)。危害:用途:二氧化硅和二氧化碳的比较CO2SiO2表示二氧化碳分子及其组成表示二氧化硅晶体中硅氧原子个数比气态固态很小很大可溶于水不溶于水很低很高高温稳定很稳定CO2+H2O=H2CO3不反应CO2+CaO = CaCO3SiO2+CaO = CaSiO3CO2+2NaOH =
Na2CO3+H2OSiO2+2NaOH =
Na2SiO3+H2O不反应SiO2+4HF =
SiF4↑+2H2O化学性质高温 SiO2 + Na2CO3 ===
Na2SiO3 + CO2↑
SiO2 + CaCO3 ==
CaSiO3 + CO2↑高温高温CO2 + C === 2CO高温 SiO2 + 2C ===
Si + 2CO↑CO2+H2O+Na2CO3
==2NaHCO3
CO2 +H2O+ CaCO3
== Ca(HCO3)22、硅酸(H2SiO3) H2SiO3是SiO2的对应水化物( SiO2 是H2SiO3的酸酐),是一种不溶性酸,是一种白色固体,其酸性比H2CO3还弱。(1)制法——可溶性硅酸盐与酸反应:滴入酚酞后溶液变为红色,再滴入稀盐酸,溶液红色变浅至无色,同时有白色胶状沉淀产生 a、Na2SiO3溶液呈碱性,b、可溶性硅酸盐与盐酸反应生成不溶于水的硅酸,c、先形成硅酸溶胶,后形成硅酸凝胶,d、静置则形成硅酸沉淀。实验4-1Na2SiO3 + 2HCl == 2NaCl + H2SiO3↓(2)酸性太弱,只能与强碱发生中和反应
H2SiO3 + 2NaOH == Na2SiO3 + 2H2O(3)不稳定(比H2CO3稳定),受热易分解 用H2CO3可制得H2SiO3 ,可证明H2SiO3 的酸性比H2CO3弱。SiO32- + H2O + CO2== CO32- + H2SiO3↓Na2SiO3 + H2O + CO2 == Na2CO3 + H2SiO3↓ SiO32- + 2H+ == H2SiO3↓Na2SiO3 + 2HCl == 2NaCl + H2SiO3↓3、硅酸钠(Na2SiO3),俗名叫泡花碱,白色固体,易溶 于水,其水溶液俗名叫水玻璃。2、结构复杂,一般不溶于水,化学性质很稳定1、由硅、氧和金属元素组成的化合物的总称。二、硅酸盐先变干,后燃烧仅变干,不燃烧Na2SiO3溶液可作木材、纸张的防火剂 水玻璃是无色粘稠的液体,不能燃烧,不易被腐蚀,热稳定性强。可用作肥皂填料,木材、织物的防腐剂和防火剂,建筑、纸张的黏胶剂。(2)氧化物化学式法:
金属氧化物(低价?高价)?二氧化硅?水(1)盐化学式法:
如:Na2SiO3、CaSiO3、K2SiO3 等4、硅酸盐组成的表示方法:滑 石:3MgO?4SiO2?H2O云 母:K2O?3Al2O3?6SiO2?2H2O沸 石:Na2O?Al2O3?3SiO2?2H2O石 棉:3MgO?CaO?4SiO2高岭石(黏土):Al2O3?2SiO2?2H2O 如:能表示成盐的形式吗?5、土壤胶体的形成、特点和应用:
(阅读上段P.66)6、重要的无机非金属材料:
(1)传统硅酸盐材料 :陶瓷、玻璃、水泥
(2)新型无机非金属材料:新型陶瓷、光导纤维……阅读P.66~67[科学视野]
(3)其它:见P.671、晶体结构三、硅单质 硅单质有晶体和无定形两种,晶体硅的结构跟金刚石相似,都是具有正四面体结构的立体网状结构的晶体。3、化学性质 常温下,硅的化学性质很稳定,除F2、HF和强碱外,硅不跟其它物质(如O2、Cl2、H2SO4、HNO3等 )反应。
晶体硅是带有金属光泽、灰黑色、硬而脆的固体,熔、沸点高,导电性介于导体和绝缘体之间,是良好的半导体材料。2、物理性质(1)常温下能发生的反应
Si+2F2== SiF4 Si+4HF= SiF4 ↑ +2H2↑
Si+2NaOH+H2O==Na2SiO3+2H2↑生氢剂:4、用途 晶体硅可用来制造集成电路、晶体管、整流器等半导体器件和光电池,硅芯片是各种计算机、微电子产品的核心,硅还可以用于制造铝合金、铁合金等。5、硅的工业制法 高纯硅的一般纯度要求达到99.9999%,甚至达到99.9999999%以上。布置作业:1、熟记本节课涉及的化学方程式
2、完成优化设计同步训练相应练习
