硝酸课件[下学期]
图片预览










文档简介
课件34张PPT。
硝 酸齐齐哈尔市第一中学
崔广龙第三节玻尔和诺贝尔金质奖章 玻尔(1885~1962)
丹麦物理学家
诺贝尔奖获得者王水: 能使一些不溶于强酸的金属如金、铂等溶解。
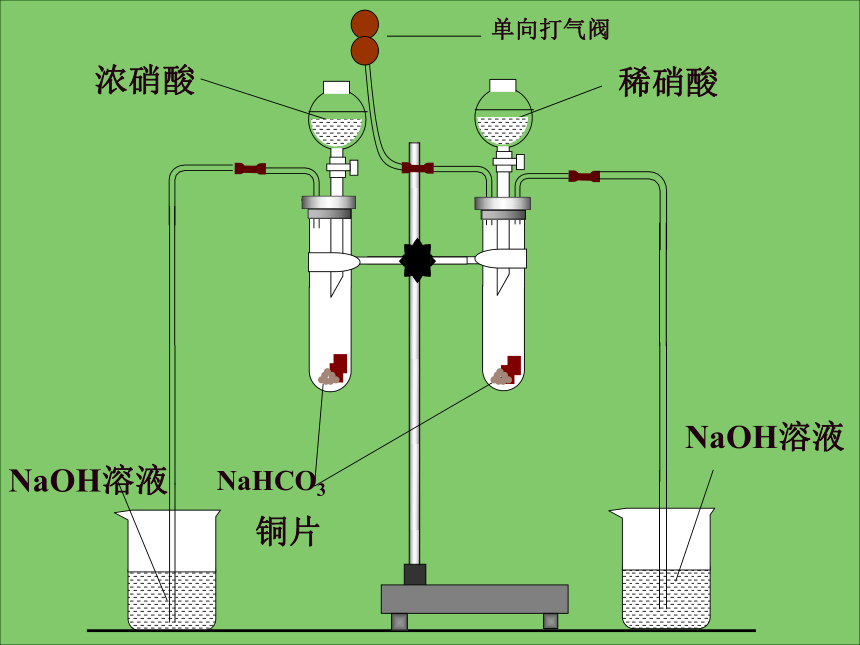
浓HNO3和浓HCl的混合物(体积比为1:3)一、硝酸的物理性质:无色液态刺激性气味能与水任意比互溶1.5027g/cm383℃一、硝酸的物理性质:易挥发(1)实验室应如何保存浓硝酸? NO2↑+ O2↑+ H2O(2)浓硝酸中的黄色应如何除去?4 4 21.硝酸的不稳定性(3)为何不用稀硝酸和活泼金属反应
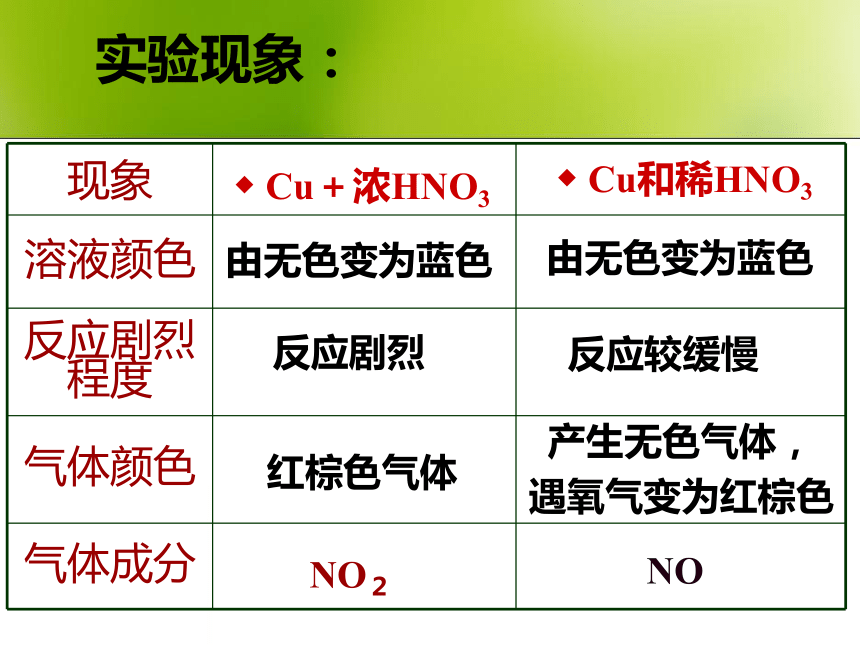
制取氢气?二、硝酸的化学性质:思考:2.硝酸的强氧化性(1)与金属的反应硫酸和硝酸与铜的反应??加热,反应产生气体,蓝色溶液不反应----NaHCO3实验现象:反应剧烈红棕色气体反应较缓慢产生无色气体,
遇氧气变为红棕色由无色变为蓝色由无色变为蓝色NONO2 ◆ Cu和稀HNO3 ◆ Cu+浓HNO3 1、表示两个反应的电子转移情况?
2、硝酸在反应中体现了哪些性质?
3、判断浓硝酸和稀硝酸哪个氧化性强?
4、铁、铝遇到浓硝酸会不会发生反应?思考:反应规律:(2)硝酸具有强的氧化性,几乎可以氧化
所有金属(金、铂 除外),一般情况下:(1)常温下,浓硝酸使铁、铝等金属钝化(3)氧化性:浓硝酸>稀硝酸稀硝酸被还原为NO浓硝酸被还原为NO2(4)硝酸浓度越大还原后的产物中氮的
化合价越高(2)与非金属的反应CO2 ↑+ NO2↑+ H2O 思考:
1、两个反应中硝酸体现了那些性质?
2、和硫反应为什么不生成二氧化硫
或亚硫酸? 4 4 2 6 6 2 H2SO4 + NO2↑ + H2O浓硝酸与木炭的反应(3)与某些化合物的反应HNO3(浓) + SO2 =(HBr 、FeCl2、 H2S 、 SO2 等)H2SO4 + NO22 2 3. 酸的通性3. 酸的通性硝酸的用途炸药塑料
染料
硝酸盐三.硝酸的用途酸的通性学会总结:强氧化性 氧化某些金属氧化某些非金属氧化某些化合物不稳定性 物理性质化学性质硝酸知识方面:用 途方法方面: 对比、类比、实验等方法自我评价1常温下能用铝制容器盛放的是( )A 浓盐酸B 浓硝酸C 稀硝酸D 稀硫酸B硝酸应该避光保存是因为它具有( )A 强酸性B 强氧化性C 挥发性D 不稳定性D自我评价2下列关于硝酸的叙述正确的是( )
A稀硝酸是弱酸,浓硝酸是强酸
B铜与浓、稀硝酸反应都能生成二氧化氮
C浓硝酸和稀硝酸都是强氧化剂
D稀硝酸与活泼金属反应主要生成氢气C 下列反应中,硝酸所起的作用属于:
A、氧化性 B、酸性
C、还原性 D、不稳定性
(1)久置的浓硝酸变黄色 ( )
(2)用硝酸浸洗附有银的试管( )
(3)用硝酸浸洗久置石灰水的
试剂瓶上的白膜 ( )
(4)用硝酸浸洗积碳的试管 ( )自我评价3DABAB自我评价4氧化等物质的量的铜,消耗的浓硝酸和稀硝酸哪个多?稀硝酸与铜的反应中,被还原的硝酸与未被还原的硝酸的质量比是多少?浓硝酸多,1:33mol : 12mol3mol : 8mol自我评价5分析在反应:中硝酸的作用?自我评价6除去铝表面的铜镀层可选用的
试剂是:( )A 稀硝酸D 浓盐酸C 浓硫酸B 浓硝酸B自我评价7将硫化氢通入不同浓度的硝酸溶液中
发生下列反应:判断硝酸浓度由大到小的顺序:② ① ④ ③ +2+4-30自我评价8将32.64g铜与140ml一定浓度的硝酸反应,铜
完全溶解产生NO和NO2的混合气体在标准状
况下的体积为 11.2L,请回答:
(1)NO的体积为 L, NO2 的体积 L
(2)待产生的气体全部释放后,向溶液中加入
Vml amol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为
mol/L 5.85.4(10-3aV+0.5)/0.14作业:教材18页 第四题谢谢各位老师光临指导
硝 酸齐齐哈尔市第一中学
崔广龙 波尔是丹麦物理学家,又是核物理研究
的大师.他由于研究了氢原子的量子轨道理论而获得诺贝尔物理学奖。二战时,波尔的祖国丹麦被德军占领.德军急切想得到波尔研究制造原子弹,波尔决定潜逃到英国。他想带走那枚诺贝尔奖章,又怕因此而带来危险。于是,临走时他将金质奖章浸泡在一瓶溶液中.二战结束后,波尔回到自己的家乡,那溶解了奖章的溶液还在,那个瓶子一动也没有动过。他用置换法从溶液中析出黄金,再把这些黄金加工成了诺贝尔奖章其样子与原来的奖章一模一样!
波尔和黄金奖章的故事 波尔是丹麦物理学家,又是核物理研究
的大师.他由于研究了氢原子的量子轨道理论而获得诺贝尔物理学奖。二战时,波尔的祖国丹麦被德军占领.德军急切想得到波尔研究制造原子弹,波尔决定潜逃到英国。他想带走那枚诺贝尔奖章,又怕因此而带来危险。于是,临走时他将金质奖章浸泡在一瓶溶液中.二战结束后,波尔回到自己的家乡,那溶解了奖章的溶液还在,那个瓶子一动也没有动过。他用置换法从溶液中析出黄金,再把这些黄金加工成了诺贝尔奖章其样子与原来的奖章一模一样!
波尔和黄金奖章的故事 小结:⑷硝酸具有强的氧化性,几乎可以氧化
所有金属(金、铂 除外)⑶常温下,浓硝酸使铁、铝等金属钝化⑵硝酸与金属反应不放出氢气(5)氧化性:浓硝酸>稀硝酸(6)一般情况下:稀硝酸被还原为NO⑴硝酸无论浓、稀都具有强氧化性浓硝酸被还原为NO2(7)硝酸浓度越大还原后的产物中氮的
化合价越高 玻尔是丹麦物理学家、诺贝尔奖章获得者。第二次世界大战期间,由于德军即将占领丹麦,玻尔被迫要离开自己的祖国。他坚信以后一定能返回祖国,决定把心爱的诺贝尔奖章留下。为了不使奖章落入德军手中,他把奖章溶解在一种溶液中,并存放在瓶子里。丹麦被德军占领后,纳粹分子闯进玻尔家中,连奖章的影子也没发现。战后,玻尔从溶液中提取出金,又重新铸成了奖章。玻尔的诺贝尔金质奖章Cu + HNO3(浓)= Cu + HNO3(稀)=1、硝酸在反应中的作用?
2、表示电子转移情况?
3、判断浓硝酸和稀硝酸哪个氧化性强?思考Cu(NO3)2+ NO2↑+ H2O Cu(NO3)2+ NO↑+ H2O 4 2 2 3 8 3 2 4化学方程式:
硝 酸齐齐哈尔市第一中学
崔广龙第三节玻尔和诺贝尔金质奖章 玻尔(1885~1962)
丹麦物理学家
诺贝尔奖获得者王水: 能使一些不溶于强酸的金属如金、铂等溶解。
浓HNO3和浓HCl的混合物(体积比为1:3)一、硝酸的物理性质:无色液态刺激性气味能与水任意比互溶1.5027g/cm383℃一、硝酸的物理性质:易挥发(1)实验室应如何保存浓硝酸? NO2↑+ O2↑+ H2O(2)浓硝酸中的黄色应如何除去?4 4 21.硝酸的不稳定性(3)为何不用稀硝酸和活泼金属反应
制取氢气?二、硝酸的化学性质:思考:2.硝酸的强氧化性(1)与金属的反应硫酸和硝酸与铜的反应??加热,反应产生气体,蓝色溶液不反应----NaHCO3实验现象:反应剧烈红棕色气体反应较缓慢产生无色气体,
遇氧气变为红棕色由无色变为蓝色由无色变为蓝色NONO2 ◆ Cu和稀HNO3 ◆ Cu+浓HNO3 1、表示两个反应的电子转移情况?
2、硝酸在反应中体现了哪些性质?
3、判断浓硝酸和稀硝酸哪个氧化性强?
4、铁、铝遇到浓硝酸会不会发生反应?思考:反应规律:(2)硝酸具有强的氧化性,几乎可以氧化
所有金属(金、铂 除外),一般情况下:(1)常温下,浓硝酸使铁、铝等金属钝化(3)氧化性:浓硝酸>稀硝酸稀硝酸被还原为NO浓硝酸被还原为NO2(4)硝酸浓度越大还原后的产物中氮的
化合价越高(2)与非金属的反应CO2 ↑+ NO2↑+ H2O 思考:
1、两个反应中硝酸体现了那些性质?
2、和硫反应为什么不生成二氧化硫
或亚硫酸? 4 4 2 6 6 2 H2SO4 + NO2↑ + H2O浓硝酸与木炭的反应(3)与某些化合物的反应HNO3(浓) + SO2 =(HBr 、FeCl2、 H2S 、 SO2 等)H2SO4 + NO22 2 3. 酸的通性3. 酸的通性硝酸的用途炸药塑料
染料
硝酸盐三.硝酸的用途酸的通性学会总结:强氧化性 氧化某些金属氧化某些非金属氧化某些化合物不稳定性 物理性质化学性质硝酸知识方面:用 途方法方面: 对比、类比、实验等方法自我评价1常温下能用铝制容器盛放的是( )A 浓盐酸B 浓硝酸C 稀硝酸D 稀硫酸B硝酸应该避光保存是因为它具有( )A 强酸性B 强氧化性C 挥发性D 不稳定性D自我评价2下列关于硝酸的叙述正确的是( )
A稀硝酸是弱酸,浓硝酸是强酸
B铜与浓、稀硝酸反应都能生成二氧化氮
C浓硝酸和稀硝酸都是强氧化剂
D稀硝酸与活泼金属反应主要生成氢气C 下列反应中,硝酸所起的作用属于:
A、氧化性 B、酸性
C、还原性 D、不稳定性
(1)久置的浓硝酸变黄色 ( )
(2)用硝酸浸洗附有银的试管( )
(3)用硝酸浸洗久置石灰水的
试剂瓶上的白膜 ( )
(4)用硝酸浸洗积碳的试管 ( )自我评价3DABAB自我评价4氧化等物质的量的铜,消耗的浓硝酸和稀硝酸哪个多?稀硝酸与铜的反应中,被还原的硝酸与未被还原的硝酸的质量比是多少?浓硝酸多,1:33mol : 12mol3mol : 8mol自我评价5分析在反应:中硝酸的作用?自我评价6除去铝表面的铜镀层可选用的
试剂是:( )A 稀硝酸D 浓盐酸C 浓硫酸B 浓硝酸B自我评价7将硫化氢通入不同浓度的硝酸溶液中
发生下列反应:判断硝酸浓度由大到小的顺序:② ① ④ ③ +2+4-30自我评价8将32.64g铜与140ml一定浓度的硝酸反应,铜
完全溶解产生NO和NO2的混合气体在标准状
况下的体积为 11.2L,请回答:
(1)NO的体积为 L, NO2 的体积 L
(2)待产生的气体全部释放后,向溶液中加入
Vml amol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为
mol/L 5.85.4(10-3aV+0.5)/0.14作业:教材18页 第四题谢谢各位老师光临指导
硝 酸齐齐哈尔市第一中学
崔广龙 波尔是丹麦物理学家,又是核物理研究
的大师.他由于研究了氢原子的量子轨道理论而获得诺贝尔物理学奖。二战时,波尔的祖国丹麦被德军占领.德军急切想得到波尔研究制造原子弹,波尔决定潜逃到英国。他想带走那枚诺贝尔奖章,又怕因此而带来危险。于是,临走时他将金质奖章浸泡在一瓶溶液中.二战结束后,波尔回到自己的家乡,那溶解了奖章的溶液还在,那个瓶子一动也没有动过。他用置换法从溶液中析出黄金,再把这些黄金加工成了诺贝尔奖章其样子与原来的奖章一模一样!
波尔和黄金奖章的故事 波尔是丹麦物理学家,又是核物理研究
的大师.他由于研究了氢原子的量子轨道理论而获得诺贝尔物理学奖。二战时,波尔的祖国丹麦被德军占领.德军急切想得到波尔研究制造原子弹,波尔决定潜逃到英国。他想带走那枚诺贝尔奖章,又怕因此而带来危险。于是,临走时他将金质奖章浸泡在一瓶溶液中.二战结束后,波尔回到自己的家乡,那溶解了奖章的溶液还在,那个瓶子一动也没有动过。他用置换法从溶液中析出黄金,再把这些黄金加工成了诺贝尔奖章其样子与原来的奖章一模一样!
波尔和黄金奖章的故事 小结:⑷硝酸具有强的氧化性,几乎可以氧化
所有金属(金、铂 除外)⑶常温下,浓硝酸使铁、铝等金属钝化⑵硝酸与金属反应不放出氢气(5)氧化性:浓硝酸>稀硝酸(6)一般情况下:稀硝酸被还原为NO⑴硝酸无论浓、稀都具有强氧化性浓硝酸被还原为NO2(7)硝酸浓度越大还原后的产物中氮的
化合价越高 玻尔是丹麦物理学家、诺贝尔奖章获得者。第二次世界大战期间,由于德军即将占领丹麦,玻尔被迫要离开自己的祖国。他坚信以后一定能返回祖国,决定把心爱的诺贝尔奖章留下。为了不使奖章落入德军手中,他把奖章溶解在一种溶液中,并存放在瓶子里。丹麦被德军占领后,纳粹分子闯进玻尔家中,连奖章的影子也没发现。战后,玻尔从溶液中提取出金,又重新铸成了奖章。玻尔的诺贝尔金质奖章Cu + HNO3(浓)= Cu + HNO3(稀)=1、硝酸在反应中的作用?
2、表示电子转移情况?
3、判断浓硝酸和稀硝酸哪个氧化性强?思考Cu(NO3)2+ NO2↑+ H2O Cu(NO3)2+ NO↑+ H2O 4 2 2 3 8 3 2 4化学方程式:
