硝酸和氨(第二课时)[上学期]
文档属性
| 名称 | 硝酸和氨(第二课时)[上学期] |  | |
| 格式 | rar | ||
| 文件大小 | 535.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-07-08 09:09:00 | ||
图片预览




文档简介
课件13张PPT。硫酸、硝酸和氨
(第二课时)实验4-9:氨的喷泉实验考考你的观察能力现象:烧杯里的液体由玻璃管进入烧瓶,形成美
丽的喷泉;烧瓶中的液体呈红色。原因:①氨气极易溶于水(1∶700) 。使烧瓶内
气压急剧下降。 ②氨气水溶液呈碱性。
一、氨气的物理性质:颜色状态气味:
密度:
水溶性:无色有刺激性气味的气体密度比空气小,
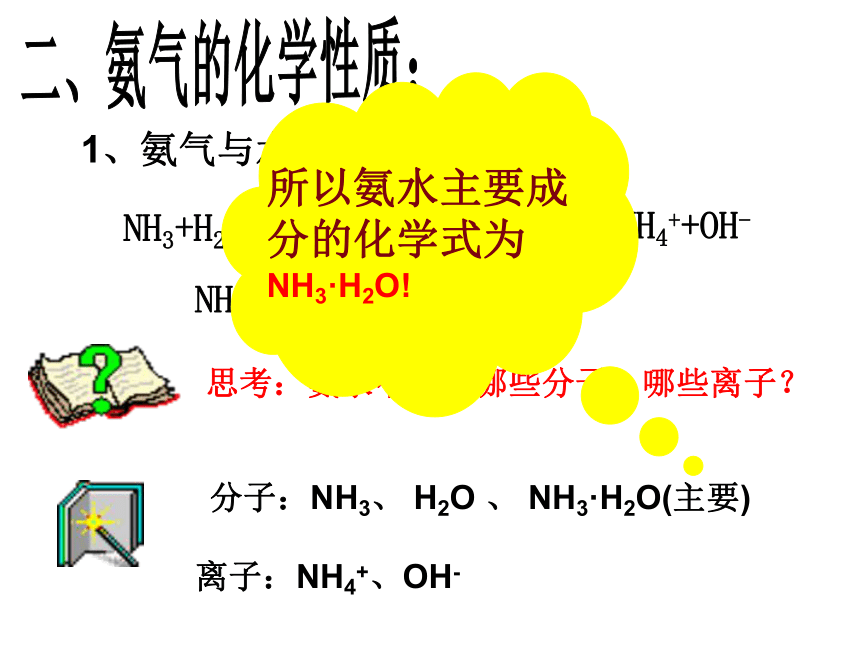
ρ(NH3)∶ ρ(空气)=17∶29极易溶于水,体积比1∶700氨气为什么能使酚酞溶液变红?科学探究你能否通过实验去证明你的观点?二、氨气的化学性质:1、氨气与水的反应:
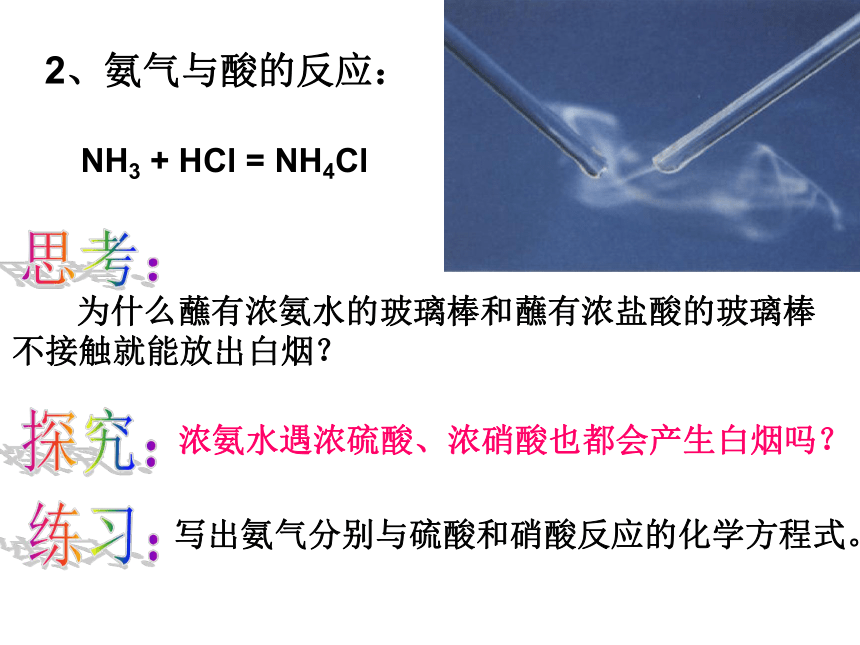
思考:氨水中存在哪些分子、哪些离子?分子:NH3、 H2O 、 NH3·H2O(主要)离子:NH4+、OH-2、氨气与酸的反应:NH3 + HCl = NH4Cl
为什么蘸有浓氨水的玻璃棒和蘸有浓盐酸的玻璃棒
不接触就能放出白烟?思考:练习:写出氨气分别与硫酸和硝酸反应的化学方程式。三、氨气的制取:科学事实:铵盐与碱反应放出氨气,在实验室里,
常用加热铵盐和碱的混合物的方法制取氨。(1)药品:氯化铵晶体、消石灰固体(2)原理:2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑(3)装置:固+固,加热型(与氧气的制取装置相同)(4)收集:向下排空气法(5)验满:②蘸有浓HCl的玻璃棒接近
试管口产生白烟。①湿润的红色石蕊试纸变蓝
(常见气体中唯一的一种碱性气体);思考:?棉花的作用:防止对流,提高集气速度和纯度。?干燥氨气的常用试剂:①CaO、碱石灰等碱性干燥剂
②无水CaCl2不能用来干燥NH3(形成CaCl2· 8NH3)
?实验室中还可以用哪些方法快速制氨气:
①加热浓氨水法(装置与实验室制氯气的发生装置相同)②浓氨水加碱石灰法(碱石灰吸水、溶解时放热)NaOH和CaO的混合物四、氨的用途:氨的用途制氮肥
铵盐
制硝酸
纯碱
有机合成
工业原料致冷剂问题解决1、在氨气泄漏时村民为何要惊跑?3、如何消除弥漫在空气中的大量氨气?2、发生氨气泄漏时村民应采取什么应急措施?例题1、下列关于氨性质的叙述中正确的是( )
A、氨气可用排水法收集
B、氨水成碱性
C、氨气和酸相遇都能产生白烟
D、在反应NH3+H+=NH4+中,氨失去电子被氧化习题巩固:B例题2、某同学在实验室中发现了一瓶有刺激性气味的
气体,根据气体的判断可能是氨气,但不知是否确实是
氨气,下列提供的方法中,你认为能帮他检验是否为
氨气的方法是( )
A、将湿润的红色石蕊试纸放在瓶口
B、将干燥的红色石蕊试纸放在瓶口
C、用蘸有浓盐酸的玻璃棒靠近瓶口
D、将湿润的蓝色石蕊试纸放在瓶口AC氨1、在氨气泄漏时村民为何要惊跑?3、如何消除弥漫在空气中的大量氨气?2、发生氨气泄漏时村民应采取什么应急措施?
丽的喷泉;烧瓶中的液体呈红色。原因:①氨气极易溶于水(1∶700) 。使烧瓶内
气压急剧下降。 ②氨气水溶液呈碱性。
一、氨气的物理性质:颜色状态气味:
密度:
水溶性:无色有刺激性气味的气体密度比空气小,
ρ(NH3)∶ ρ(空气)=17∶29极易溶于水,体积比1∶700氨气为什么能使酚酞溶液变红?科学探究你能否通过实验去证明你的观点?二、氨气的化学性质:1、氨气与水的反应:
思考:氨水中存在哪些分子、哪些离子?分子:NH3、 H2O 、 NH3·H2O(主要)离子:NH4+、OH-2、氨气与酸的反应:NH3 + HCl = NH4Cl
为什么蘸有浓氨水的玻璃棒和蘸有浓盐酸的玻璃棒
不接触就能放出白烟?思考:练习:写出氨气分别与硫酸和硝酸反应的化学方程式。三、氨气的制取:科学事实:铵盐与碱反应放出氨气,在实验室里,
常用加热铵盐和碱的混合物的方法制取氨。(1)药品:氯化铵晶体、消石灰固体(2)原理:2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑(3)装置:固+固,加热型(与氧气的制取装置相同)(4)收集:向下排空气法(5)验满:②蘸有浓HCl的玻璃棒接近
试管口产生白烟。①湿润的红色石蕊试纸变蓝
(常见气体中唯一的一种碱性气体);思考:?棉花的作用:防止对流,提高集气速度和纯度。?干燥氨气的常用试剂:①CaO、碱石灰等碱性干燥剂
②无水CaCl2不能用来干燥NH3(形成CaCl2· 8NH3)
?实验室中还可以用哪些方法快速制氨气:
①加热浓氨水法(装置与实验室制氯气的发生装置相同)②浓氨水加碱石灰法(碱石灰吸水、溶解时放热)NaOH和CaO的混合物四、氨的用途:氨的用途制氮肥
铵盐
制硝酸
纯碱
有机合成
工业原料致冷剂问题解决1、在氨气泄漏时村民为何要惊跑?3、如何消除弥漫在空气中的大量氨气?2、发生氨气泄漏时村民应采取什么应急措施?例题1、下列关于氨性质的叙述中正确的是( )
A、氨气可用排水法收集
B、氨水成碱性
C、氨气和酸相遇都能产生白烟
D、在反应NH3+H+=NH4+中,氨失去电子被氧化习题巩固:B例题2、某同学在实验室中发现了一瓶有刺激性气味的
气体,根据气体的判断可能是氨气,但不知是否确实是
氨气,下列提供的方法中,你认为能帮他检验是否为
氨气的方法是( )
A、将湿润的红色石蕊试纸放在瓶口
B、将干燥的红色石蕊试纸放在瓶口
C、用蘸有浓盐酸的玻璃棒靠近瓶口
D、将湿润的蓝色石蕊试纸放在瓶口AC氨1、在氨气泄漏时村民为何要惊跑?3、如何消除弥漫在空气中的大量氨气?2、发生氨气泄漏时村民应采取什么应急措施?
