课题3 制取氧气[上学期]
图片预览










文档简介
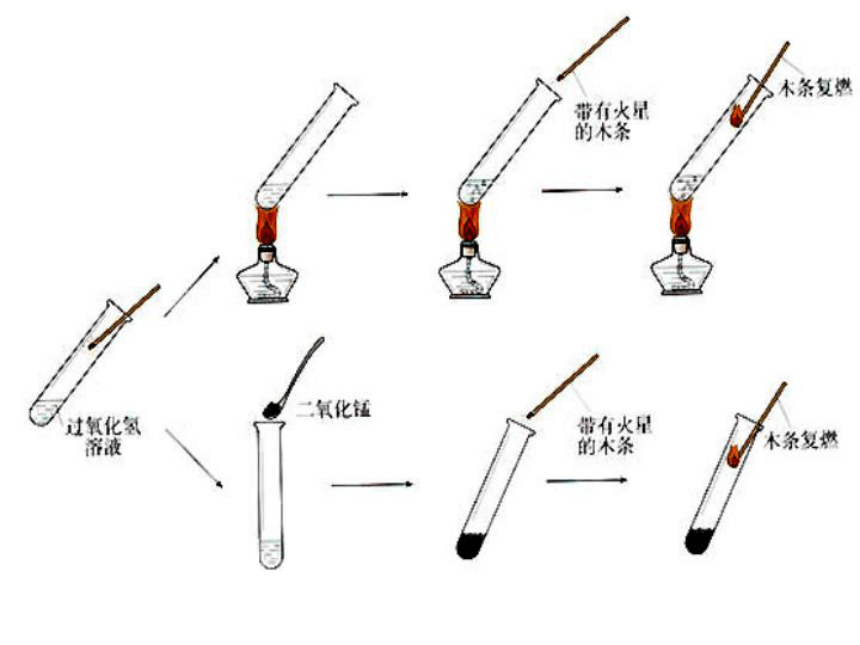
课件39张PPT。静课题3 制取氧气引言: 氧气是我们日常生活中不可缺少的物质,它具有广泛的用途,如急救病人、电氧焊、炼钢、登山、潜水等都需要较为纯净的氧气,如何制取氧气?本课题的主要内容:1、哪些物质可以产生氧气?2、怎样选择一套装置来制取氧气?3、怎样验证产生的气体是否为氧气?4、什么是催化剂?实验室制法工业制法分解过氧化氢溶液原理一、氧气的实验室制法 加热高锰酸钾加热氯酸钾实验探究一(1)在试管中加入 5 mL 5%的过氧化氢溶液,把带火星的木条伸入试管,木条 复燃。不(3)在另一支试管中加入5 mL 5%的过氧化氢溶液,并加入少量二氧化锰,把带火星的木条伸入试管,现象是 。
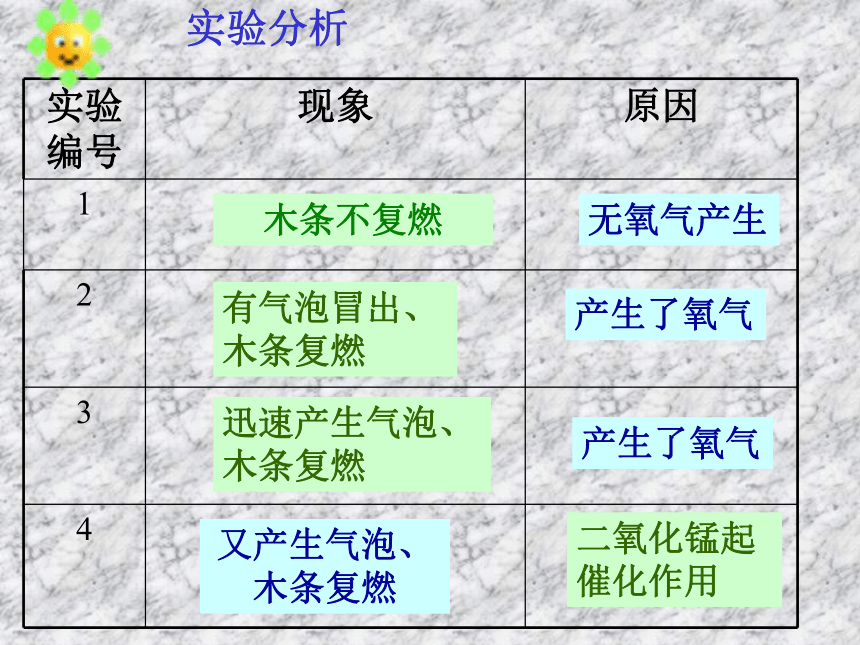
(4)在上支试管不再产生气泡时,再加入过氧化氢溶液,现象是 。迅速产生气泡,木条复燃又产生气泡,木条复燃(2)微微加热装有过氧化氢的试管,现象是现 象是 ;把带火星的木条伸入试管,现象是 。 有气泡冒出木条复燃 实验分析木条不复燃无氧气产生有气泡冒出、 木条复燃产生了氧气又产生气泡、木条复燃二氧化锰起催化作用迅速产生气泡、木条复燃产生了氧气 二氧化锰好象“永远用不完”,但却改变了过氧化氢的反应速率。催化剂(触媒): 在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质。催化作用催化剂在化学反应中所起的作用叫催化作用。催化剂一般具有以下一些特点:1.一般认为催化剂能够改变化学反应速率,这里的改变,指的是加快或减慢。2.催化剂虽能改变化学反应速率,但不能改变反应物的产率。3.催化剂可以根据需要而选择,不同的反应,催化剂可能不同。4.催化剂本身的质量和化学性质都没有改变催化剂在化工生产中有重要作用思考:
1、催化剂在反应中一定是加快反应速率。
2、过氧化氢只能用二氧化锰作催化剂。
3、二氧化锰在任何反应中都是催化剂。×××练习:下列有关催化剂的叙述正确的是( )A、在化学反应里能加快其他物质的化学反应速率,而本身的质量和性质在反应前后没有改变的物质。
B、二氧化锰是催化剂。
C、在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有改变的物质。
D、要使过氧化氢溶液分解出氧气,必须要加入二氧化锰,否则就不能发生反应。C二氧化锰加热氯酸钾
(白色)氯化钾+氧气
(白色)2、用氯酸钾制氧气KClO3 MnO2A__________B_________
C__________D_________
E___________F_________试 管铁架台酒精灯导 管集气瓶水槽 仪器名称:发生装置收集装置ABCDEF (1)原理: (暗紫色) (黑色)
KMnO4 K2MnO4 MnO2 O23、用高锰酸钾制氧气思 考用高锰酸钾、氯酸钾和过氧化氢(双氧水)制取氧气的反应是化合反应吗?化学反应之分解反应化合反应:两种或两种以上的物质生成另一种物质的反应特点:多变一分解反应:由一种反应物生成两种或两种以上其他物质的反应。特点:一变多A + B → AB → A + BAB二、氧气的工业制法原料:空气
原理:液态氮和液态氧的沸点不同,再低温蒸发(属于物理变化)
过程:空气 液态空气
降温加压升温蒸发氮气沸点 -196℃液氧沸点-183 ℃(贮存在漆成蓝色的钢瓶中)下列化学反应中,属于氧化反应的是( ),属于化合反应的是( )属于分解反应的是( )
A.甲烷+氧气 水+二氧化碳
B.水 氢气+氧气
C.氧气+二氧化碳+铜+水 碱式碳酸铜
D.氯酸钾 氯化钾+氧气ACCBD例题:下列反应中属于分解反应的是( 〕1、氧化汞 → 汞 + 氧气
2、碱式碳酸铜 → 氧化铜 + 水 + 二氧化碳
3、铁+硫酸铜 → 硫酸亚铁 + 铜
4、蜡烛+氧气 → 水 + 二氧化碳12掌握实验室制取氧气的三种方法,记住以下反应的文字表达式和化学符号:【小结】 高锰酸钾 锰酸钾+二氧化锰+氧气加热过氧化氢 H2O2, 二氧化锰 MnO2
高锰酸钾 KMnO4,锰酸钾 K2MnO4活动与探究的目标:
1.学会制取氧气的有关实验操作
2.通过实验,进一步掌握氧气的化学性质 活动与探究复习:1、实验室制取氧气有哪些反应:氯酸钾KClO3氯化钾 + 氧气KCl O2 (1)(2)高锰酸钾锰酸钾+二氧化锰+氧气KMnO4K2MnO4 MnO2过氧化氢水 + 氧气H2O2 H2O + O2(3)发生装置收集装置试 管铁架台酒精灯导 管集气瓶水槽
一、高锰酸钾制氧气的装置1、指出各仪器的名称2、装置注意事项1、试管口应略向下倾斜.
防止冷凝水回流到热的试管底部,炸裂试管2、导管稍露出胶塞即可。
有利于排出试管内的空气3、试管口应塞一团棉花。
防止高锰酸钾粉末进入导管4、铁夹应夹在试管的中上部(离管口约1/3处)
5、药品应平铺于管底,用外焰加热。
6、酒精灯内的酒精不能超过2/3。
防止引发火灾例题:改正下图中的错误,3、铁夹应夹在试管的中上部 (离管子口约1/3处)4、试管口应略向下倾斜1、应用外焰对准药品加热2、胶塞内导管稍露出胶塞少许即可方法:先将导管一端伸入水中,然后用手紧握试管,
观察水中的导管口有没有气泡冒出。
判断:如果有气泡冒出,说明装置不漏气。
思考:如果装置不漏气,放开手后有何现象?1、检查装置气密性二、氧气制取的实验操作水倒吸,形成水柱2、收集方法排水法
不易溶于水的气体向上排空气法
密度比空气大的气体向下排空气法
密度比空气小的气体 用向上排空气法收集时,将带火星的木条放在瓶口,如果木条复燃,说明该瓶内的氧气已满。3、验满方法思考:实验完毕后为什么要先移导管后灭酒精灯?.swf 4、实验室制氧气的操作步骤(1)查(检查装置的气密性)
(2)装(在试管中装少量高锰酸钾并在管口塞一团棉花)
(3)定(连接好导管和试管,并固定在铁架台上,先下后上、先左后右)
(4)点(点燃酒精灯给试管预热,然后给固体加热)
(5)收(气泡连续均匀冒出时,开始收集)
(6)移(收集完氧气后,把导管移出水槽)
(7)熄(熄灭酒精灯)答:防止水倒流,使试管炸裂。思考:1、排水法收集氧气时,开始产生气体就收集会有什么后果?
收集的气体中含有空气而不纯三、氧气的性质实验放热,剧烈燃烧,发出白光,生成一种使澄清石灰水变浑浊的无色气体点燃碳 + 氧气二氧化碳CCO2O21、《碳在氧气中燃烧》2、《铁在氧气中燃烧》放热,剧烈燃烧、火星四射生成一种黑色的固体点燃铁 + 氧气四氧化三铁FeFe3O4O2 1.实验室制取氧气时,装药品的大试管口应 ( )
(A)朝下 (B)朝上
(C)略向下倾斜 (D)略向上倾斜
2.实验室采用排水法收集氧气时,需将导气管伸入盛满水的集气瓶,这个操作应在( )
(A)加热固体药品前
(B)与加热固体药品同时
(C)开始有气泡放出时
(D)气泡连续并均匀放出时DC 练习3.为什么要塞一团棉花?为什么试管口要向下倾斜?答:刚开始有气泡冒出的气泡是空气,收集的气体不纯;当气泡连续并均匀冒出时方可收集。6.如果先熄灭酒精灯,可能会造成什么后果?答:因为氧气的密度比空气略大。答:防止加热过程中高锰酸钾粉末进入导管,污染水槽中的水;防止试管口生成的水倒流进试管底部,导致试管炸裂。4.为什么导管口开始有气泡放出时,不宜立即收集?什么时候开始收集?5.为什么要正放在桌子上?答:水槽的水倒吸进试管,导致试管炸裂。检验与验满检验:带火星的木条伸入瓶内验满:带火星的木条放在瓶口课堂习题 指出右图“用高锰酸钾制氧气”中存在的错误。
(1)试管口不应向上倾斜。
(2)伸入试管中的导气管过长。
(3)没在试管口塞一小团棉花。
(4)没有用外焰加热。 Good Bye!再见
(4)在上支试管不再产生气泡时,再加入过氧化氢溶液,现象是 。迅速产生气泡,木条复燃又产生气泡,木条复燃(2)微微加热装有过氧化氢的试管,现象是现 象是 ;把带火星的木条伸入试管,现象是 。 有气泡冒出木条复燃 实验分析木条不复燃无氧气产生有气泡冒出、 木条复燃产生了氧气又产生气泡、木条复燃二氧化锰起催化作用迅速产生气泡、木条复燃产生了氧气 二氧化锰好象“永远用不完”,但却改变了过氧化氢的反应速率。催化剂(触媒): 在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质。催化作用催化剂在化学反应中所起的作用叫催化作用。催化剂一般具有以下一些特点:1.一般认为催化剂能够改变化学反应速率,这里的改变,指的是加快或减慢。2.催化剂虽能改变化学反应速率,但不能改变反应物的产率。3.催化剂可以根据需要而选择,不同的反应,催化剂可能不同。4.催化剂本身的质量和化学性质都没有改变催化剂在化工生产中有重要作用思考:
1、催化剂在反应中一定是加快反应速率。
2、过氧化氢只能用二氧化锰作催化剂。
3、二氧化锰在任何反应中都是催化剂。×××练习:下列有关催化剂的叙述正确的是( )A、在化学反应里能加快其他物质的化学反应速率,而本身的质量和性质在反应前后没有改变的物质。
B、二氧化锰是催化剂。
C、在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有改变的物质。
D、要使过氧化氢溶液分解出氧气,必须要加入二氧化锰,否则就不能发生反应。C二氧化锰加热氯酸钾
(白色)氯化钾+氧气
(白色)2、用氯酸钾制氧气KClO3 MnO2A__________B_________
C__________D_________
E___________F_________试 管铁架台酒精灯导 管集气瓶水槽 仪器名称:发生装置收集装置ABCDEF (1)原理: (暗紫色) (黑色)
KMnO4 K2MnO4 MnO2 O23、用高锰酸钾制氧气思 考用高锰酸钾、氯酸钾和过氧化氢(双氧水)制取氧气的反应是化合反应吗?化学反应之分解反应化合反应:两种或两种以上的物质生成另一种物质的反应特点:多变一分解反应:由一种反应物生成两种或两种以上其他物质的反应。特点:一变多A + B → AB → A + BAB二、氧气的工业制法原料:空气
原理:液态氮和液态氧的沸点不同,再低温蒸发(属于物理变化)
过程:空气 液态空气
降温加压升温蒸发氮气沸点 -196℃液氧沸点-183 ℃(贮存在漆成蓝色的钢瓶中)下列化学反应中,属于氧化反应的是( ),属于化合反应的是( )属于分解反应的是( )
A.甲烷+氧气 水+二氧化碳
B.水 氢气+氧气
C.氧气+二氧化碳+铜+水 碱式碳酸铜
D.氯酸钾 氯化钾+氧气ACCBD例题:下列反应中属于分解反应的是( 〕1、氧化汞 → 汞 + 氧气
2、碱式碳酸铜 → 氧化铜 + 水 + 二氧化碳
3、铁+硫酸铜 → 硫酸亚铁 + 铜
4、蜡烛+氧气 → 水 + 二氧化碳12掌握实验室制取氧气的三种方法,记住以下反应的文字表达式和化学符号:【小结】 高锰酸钾 锰酸钾+二氧化锰+氧气加热过氧化氢 H2O2, 二氧化锰 MnO2
高锰酸钾 KMnO4,锰酸钾 K2MnO4活动与探究的目标:
1.学会制取氧气的有关实验操作
2.通过实验,进一步掌握氧气的化学性质 活动与探究复习:1、实验室制取氧气有哪些反应:氯酸钾KClO3氯化钾 + 氧气KCl O2 (1)(2)高锰酸钾锰酸钾+二氧化锰+氧气KMnO4K2MnO4 MnO2过氧化氢水 + 氧气H2O2 H2O + O2(3)发生装置收集装置试 管铁架台酒精灯导 管集气瓶水槽
一、高锰酸钾制氧气的装置1、指出各仪器的名称2、装置注意事项1、试管口应略向下倾斜.
防止冷凝水回流到热的试管底部,炸裂试管2、导管稍露出胶塞即可。
有利于排出试管内的空气3、试管口应塞一团棉花。
防止高锰酸钾粉末进入导管4、铁夹应夹在试管的中上部(离管口约1/3处)
5、药品应平铺于管底,用外焰加热。
6、酒精灯内的酒精不能超过2/3。
防止引发火灾例题:改正下图中的错误,3、铁夹应夹在试管的中上部 (离管子口约1/3处)4、试管口应略向下倾斜1、应用外焰对准药品加热2、胶塞内导管稍露出胶塞少许即可方法:先将导管一端伸入水中,然后用手紧握试管,
观察水中的导管口有没有气泡冒出。
判断:如果有气泡冒出,说明装置不漏气。
思考:如果装置不漏气,放开手后有何现象?1、检查装置气密性二、氧气制取的实验操作水倒吸,形成水柱2、收集方法排水法
不易溶于水的气体向上排空气法
密度比空气大的气体向下排空气法
密度比空气小的气体 用向上排空气法收集时,将带火星的木条放在瓶口,如果木条复燃,说明该瓶内的氧气已满。3、验满方法思考:实验完毕后为什么要先移导管后灭酒精灯?.swf 4、实验室制氧气的操作步骤(1)查(检查装置的气密性)
(2)装(在试管中装少量高锰酸钾并在管口塞一团棉花)
(3)定(连接好导管和试管,并固定在铁架台上,先下后上、先左后右)
(4)点(点燃酒精灯给试管预热,然后给固体加热)
(5)收(气泡连续均匀冒出时,开始收集)
(6)移(收集完氧气后,把导管移出水槽)
(7)熄(熄灭酒精灯)答:防止水倒流,使试管炸裂。思考:1、排水法收集氧气时,开始产生气体就收集会有什么后果?
收集的气体中含有空气而不纯三、氧气的性质实验放热,剧烈燃烧,发出白光,生成一种使澄清石灰水变浑浊的无色气体点燃碳 + 氧气二氧化碳CCO2O21、《碳在氧气中燃烧》2、《铁在氧气中燃烧》放热,剧烈燃烧、火星四射生成一种黑色的固体点燃铁 + 氧气四氧化三铁FeFe3O4O2 1.实验室制取氧气时,装药品的大试管口应 ( )
(A)朝下 (B)朝上
(C)略向下倾斜 (D)略向上倾斜
2.实验室采用排水法收集氧气时,需将导气管伸入盛满水的集气瓶,这个操作应在( )
(A)加热固体药品前
(B)与加热固体药品同时
(C)开始有气泡放出时
(D)气泡连续并均匀放出时DC 练习3.为什么要塞一团棉花?为什么试管口要向下倾斜?答:刚开始有气泡冒出的气泡是空气,收集的气体不纯;当气泡连续并均匀冒出时方可收集。6.如果先熄灭酒精灯,可能会造成什么后果?答:因为氧气的密度比空气略大。答:防止加热过程中高锰酸钾粉末进入导管,污染水槽中的水;防止试管口生成的水倒流进试管底部,导致试管炸裂。4.为什么导管口开始有气泡放出时,不宜立即收集?什么时候开始收集?5.为什么要正放在桌子上?答:水槽的水倒吸进试管,导致试管炸裂。检验与验满检验:带火星的木条伸入瓶内验满:带火星的木条放在瓶口课堂习题 指出右图“用高锰酸钾制氧气”中存在的错误。
(1)试管口不应向上倾斜。
(2)伸入试管中的导气管过长。
(3)没在试管口塞一小团棉花。
(4)没有用外焰加热。 Good Bye!再见
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
