第四单元 课题1 原子的构成[上学期]
文档属性
| 名称 | 第四单元 课题1 原子的构成[上学期] |  | |
| 格式 | rar | ||
| 文件大小 | 925.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-01-20 19:54:00 | ||
图片预览








文档简介
课件20张PPT。课题1 原子的结构 (第一课时)(化学科组)课前练习:1:物质都是由_____ _____等微粒构成的2:分子 原子两种微粒的本质区别在于:在化学反应中,分子可以________,分成________,而原子不能再分,原子是化学反应中的___________.分子原子再分 原子最小粒子提出问题:那么原子到底是不是简单的,不可分割的实心球体呢?原子结构模型的演变1803年汤姆原子模型1911年玻尔原子模型1913年 1904年卢瑟福原子模型道尔顿原子模型电子云模型1927-1935年近代科学原子论(1803年)一切物质都是由最小的不能再分的粒子——原子构成。
原子模型:原子是坚实的、不可再分的实心球。英国化学家道尔顿
(J.Dalton , 1766~1844)“化学的新时代是从原子论开始的”
——恩格斯原子并不是构成物质的最小微粒 ——汤姆生发现了电子(1897年)电子是种带负电、有一定质量的微粒,普遍存在于各种原子之中。
汤姆生原子模型:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子。英国物理学家汤姆生
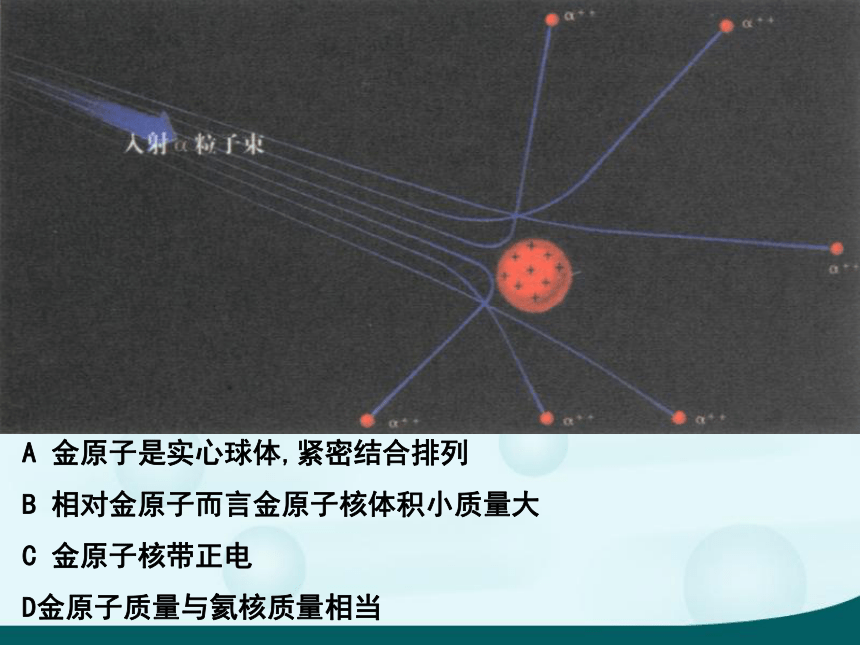
(J.J.Thomson ,1856~1940)α粒子散射实验(1909年) ——原子有核卢瑟福和他的助手做了著名α粒子散射实验。根据实验,卢瑟福在1911年提出原子有核模型。
卢瑟福原子模型(又称行星原子模型):原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。原子核的质量几乎等于原子的全部质量,电子在原子核外空间绕核做高速运动。英国科学家卢瑟福
(E.Rutherford,1871~1937)A 金原子是实心球体,紧密结合排列
B 相对金原子而言金原子核体积小质量大
C 金原子核带正电
D金原子质量与氦核质量相当
玻尔原子模型(1913年)玻尔借助诞生不久的量子理论改进了卢瑟福的模型。
玻尔原子模型(又称分层模型):当原子只有一个电子时,电子沿特定球形轨道运转;当原子有多个电子时,它们将分布在多个球壳中绕核运动。
不同的电子运转轨道是具有一定级差的稳定轨道。
丹麦物理学家玻尔
(N.Bohr,1885~1962)电子云模型 (现代物质结构学说)现代科学家们在实验中发现,电子在原子核周围有的区域出现的次数多,有的区域出现的次数少,就像“云雾”笼罩在原子核周围。因而提出了“电子云模型”。
电子云密度大的地方,表明电子在核外单位体积内出现的机会多,反之,出现的机会少。
如:氢原子的电子云电子云现代物质结构学说原子原子核核外电子:(原子中心)质子:中子:(带正电)提出问题:原子核为什么会带正电呢?原子的质量又集中在什么部位呢 ? ? ? 原子的构成:现在请同学们看以下表格:构成原子的各种粒子的电性和质量如下表:每个质子带1个单位正电荷不显电性每个电子带1个单位的负电荷原子的质量主要集中在原子核上.提问:那么整个原子又是否带电呢?1:核内的_________与核外的_________相等,又由于质子带_______,电子带________,所以整个原子_______ 电性3:不同种类的原子,质子数_______,核外电子数也 ______.4:氢原子核内没有_________2:在原子中,核电荷数=__________ = __________质子数电子数正电负电不显质子数核外电子数不同不同中子原子的构成原子原子核质子带负电荷带正电荷不带电荷1.6748×10-27千克 1.6726×10-27千克 9.1176×10-31千克 质子数(核电荷数)= 核外电子数
原子不显电性核外电子中子小结:课堂练习: 在分子、原子、质子、中子、电子这些粒子 中选择合适的答案,填在空格上(1)能直接构成物质的粒子有_________________
(2)保持物质化学性质的最小粒子是______________
(3)显示电中性的粒子有_____________________
(4)带正电荷的粒子有_______________
(5)带负电荷的粒子有_______________
(6)质量最小的粒子是_______________
(7)在化学反应中可以再分解的粒子是________
在化学反应中最小的粒子是____________
(8)原子的种类是由______的个数决定的.质量是由_______和_________的个数决定的分子、原子分子分子、原子、中子质子电子电子分子原子质子质子中子
原子模型:原子是坚实的、不可再分的实心球。英国化学家道尔顿
(J.Dalton , 1766~1844)“化学的新时代是从原子论开始的”
——恩格斯原子并不是构成物质的最小微粒 ——汤姆生发现了电子(1897年)电子是种带负电、有一定质量的微粒,普遍存在于各种原子之中。
汤姆生原子模型:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子。英国物理学家汤姆生
(J.J.Thomson ,1856~1940)α粒子散射实验(1909年) ——原子有核卢瑟福和他的助手做了著名α粒子散射实验。根据实验,卢瑟福在1911年提出原子有核模型。
卢瑟福原子模型(又称行星原子模型):原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。原子核的质量几乎等于原子的全部质量,电子在原子核外空间绕核做高速运动。英国科学家卢瑟福
(E.Rutherford,1871~1937)A 金原子是实心球体,紧密结合排列
B 相对金原子而言金原子核体积小质量大
C 金原子核带正电
D金原子质量与氦核质量相当
玻尔原子模型(1913年)玻尔借助诞生不久的量子理论改进了卢瑟福的模型。
玻尔原子模型(又称分层模型):当原子只有一个电子时,电子沿特定球形轨道运转;当原子有多个电子时,它们将分布在多个球壳中绕核运动。
不同的电子运转轨道是具有一定级差的稳定轨道。
丹麦物理学家玻尔
(N.Bohr,1885~1962)电子云模型 (现代物质结构学说)现代科学家们在实验中发现,电子在原子核周围有的区域出现的次数多,有的区域出现的次数少,就像“云雾”笼罩在原子核周围。因而提出了“电子云模型”。
电子云密度大的地方,表明电子在核外单位体积内出现的机会多,反之,出现的机会少。
如:氢原子的电子云电子云现代物质结构学说原子原子核核外电子:(原子中心)质子:中子:(带正电)提出问题:原子核为什么会带正电呢?原子的质量又集中在什么部位呢 ? ? ? 原子的构成:现在请同学们看以下表格:构成原子的各种粒子的电性和质量如下表:每个质子带1个单位正电荷不显电性每个电子带1个单位的负电荷原子的质量主要集中在原子核上.提问:那么整个原子又是否带电呢?1:核内的_________与核外的_________相等,又由于质子带_______,电子带________,所以整个原子_______ 电性3:不同种类的原子,质子数_______,核外电子数也 ______.4:氢原子核内没有_________2:在原子中,核电荷数=__________ = __________质子数电子数正电负电不显质子数核外电子数不同不同中子原子的构成原子原子核质子带负电荷带正电荷不带电荷1.6748×10-27千克 1.6726×10-27千克 9.1176×10-31千克 质子数(核电荷数)= 核外电子数
原子不显电性核外电子中子小结:课堂练习: 在分子、原子、质子、中子、电子这些粒子 中选择合适的答案,填在空格上(1)能直接构成物质的粒子有_________________
(2)保持物质化学性质的最小粒子是______________
(3)显示电中性的粒子有_____________________
(4)带正电荷的粒子有_______________
(5)带负电荷的粒子有_______________
(6)质量最小的粒子是_______________
(7)在化学反应中可以再分解的粒子是________
在化学反应中最小的粒子是____________
(8)原子的种类是由______的个数决定的.质量是由_______和_________的个数决定的分子、原子分子分子、原子、中子质子电子电子分子原子质子质子中子
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
