质量守恒定律复习课件[上学期]
文档属性
| 名称 | 质量守恒定律复习课件[上学期] |  | |
| 格式 | rar | ||
| 文件大小 | 175.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-11-03 11:31:00 | ||
图片预览








文档简介
课件23张PPT。质量守恒定律及其应用复习课1、质量守恒定律
2、学反应“质量守恒”的原因:
3、化学反应中的“变”与“不变”
从微观上看不发生改变的是_____________、
___________、____________;一定发生改变的是_____________.
从宏观上看不发生改变的是___________________、
______________________;一定发生改变的是__________________.考点归纳:原子的种类原子的数目原子的质量分子的种类物质的总质量元素的种类和质量物质的种类把握关键词① 化学反应③ 质量总和④ 等于② 参加下列说法能用质量守恒定律解释的是A.mg水受热变为mg的水蒸气
B.62g磷和80g的氧反应生成142g五氧化二磷
C.20g食盐溶于80g水得到100g的食盐水
D.拧开盛酒精的瓶盖一段时间后质量变小三、质量守恒定律的应用1、简单计算例1、在化学反应A +B = C 中,10克A物质恰好与8克B物质完全反应,则生成C物质的质量为 ( )
A、 8克 B、18克 C、10克 D、无法确定
例2、将27.5克高锰酸钾粉末加热,完全反应后剩余固体物质的质量为17.9克,则生成氧气的质量为 ( )
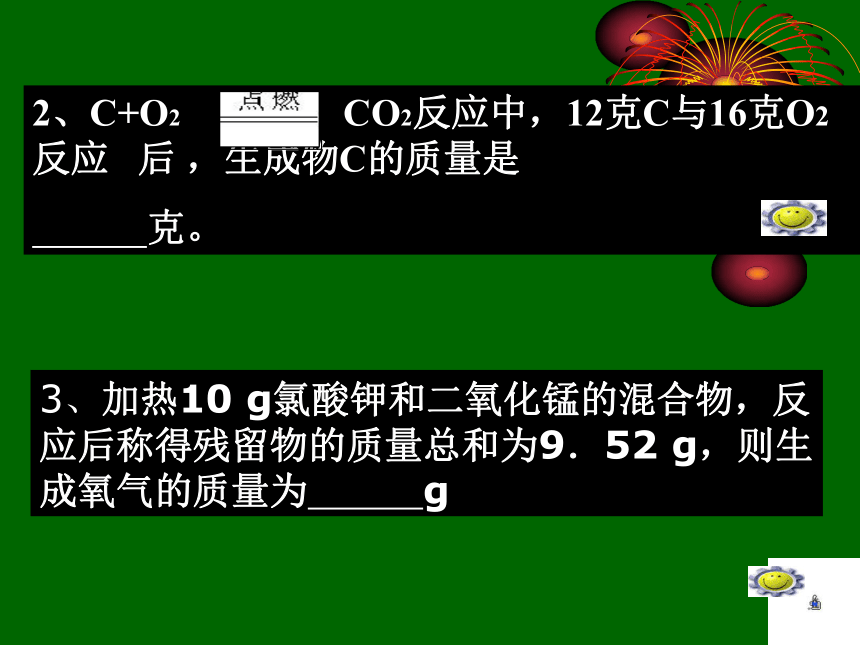
A、9.6克 B、12.6克 C、6.6克 D、14.9克(化学反应前后物质的总质量守恒)2、C+O2 CO2反应中,12克C与16克O2反应 后 ,生成物C的质量是
克。3、加热10 g氯酸钾和二氧化锰的混合物,反应后称得残留物的质量总和为9.52 g,则生成氧气的质量为 g2、确定物质的元素组成例3 : 植物进行光合作用可简单表示为
H2O + CO2 淀粉 + O2 由此判断:淀粉中一定含有 ____________元素,可能含有 元素。(化学反应前后元素种类守恒) 1、 某物质在空气中燃烧生成二氧化硫和水,能否根据这一事实,推断出蜡烛中肯定会有什么元素?可能会有什么元素? 一定有的元素:
可能有的元素:硫元素、氢元素氧元素、一定质量的某化合物完全燃烧,消耗9.6克氧气,生成8.8克二氧化碳和5.4克水。对该化合物的组成判断正确的是( )
A、含有C、H、O三种元素
B、只含有C、H两种元素
C、分子中C、H原子个数比为1﹕3 D、以上答案都不正确3、确定化学式例4、
西班牙的瑞奥汀河是一条酸河,河水中含有硫酸和硫酸亚铁。经调查发现,酸河形成的原因是由于上游河床含有的某种物质R在水中氧的作用下发生反应所致,其反应的化学方程式2R+2H2O+7O2====2FeSO4+2H2SO4则R的化学式为( )
A. FeS B. Fe2S3 C. FeS2 D. FeO(化学反应前后原子的种类、数目守恒)2006年中考题:食物中的糖类给人体提供热量,某糖X在人体内发生的反应是:
X+6O2=6CO2+6H2O,则X的化学式为:___________;判断的依据是_______________。C6H12O6质量守恒定律4、解释一些实验事实: 镁带在空气中燃烧生成氧化镁后的质量比原来金属镁的质量大,有人说这个事实不符合质量守恒定律,你说对吗?为什么?答:此说法不对。镁带在空气里燃烧,是镁和
氧气发生了化学反应。根据质量守恒定
律,反应后生成物氧化镁的质量,一定等
于参加反应的镁带和氧气的质量和,所以
生成物的质量比镁带质量大。2、有人说他能使水变成汽油(含有大量的碳、氢元素),一本万利。现在,他要把这项发明权超低价卖给你,你会买吗?请你用化学知识揭开骗子的可恶面纱。1、根据质量守恒定律解释以下现象: 高锰酸钾受热分解后,剩余固体的质量比原反应物的质量小。二、化学方程式含义:质的方面:表示反应物是什么物质,生成物是什么物质量的方面:配平的化学方程式可以表示:
(1)反应物、生成物之间的质量比。
(2)参加反应的反应物的总质量等于生成物的总质量
(3)各种微粒的对应关系三、化学方程式的书写1、要尊重客观事实
2、要遵守质量守恒定律原则化学方程式书写的步骤:书写常见错误。1.臆造不存在的反应。
2.写错物质的化学式。
3.反应条件出错。
4 .末配平。
5.漏标或多标“↑”或“↓”符号。根据已学知识判断下列反应方程式是否正确。如有错误,请指出错误之处。
(1)3Fe+2O2 Fe2O3
(2)Mg+O2 MgO2
(3)CH4+O2 CO2+H2O点燃点燃根据化学方程式的计算例1、加热分解5.8克氯酸钾,可以得到多少克氧气?解:设加热分解5.8克氯酸钾得到氧气的质量为x1、设未知数:
一般是求什么,
设什么。245965.8克x245∶96==5.8克∶xX=2.3克答:加热分解5.8克氯酸钾,可得到2.3克氧气。2、正确的写出
化学方程式:3、找出有关物质
的量:上下对齐,
已知量单位要写出4、列比例式:5、求解:
(除不尽时一般
保留一位小数)6、简明写出
答案。根据化学方程式的计算步骤:
设.写. 找.列.解.答练、将7.9g的KMnO4加热分解,能得到标准状况下的氧气多少升?(标准状况下氧气的密度为1.429g/L)
练习:1、在化学反应2X2 +3Y2 = 2R 中,若用X、Y表示R的化学式,其中正确的是( )
(A)X3Y2 (B)X2Y (C)X3Y4 (D)XY22、铅丹 + 4HNO3 =PbO2 + 2Pb(NO3)2 + 2H2O ,根据化学方程式可推知铅丹的化学式为( )
A. Pb B. PbO C. Pb2O3 D. Pb3O4 4、在化学反应2XY2+Y2=2Z中Z的化学式为( )
A、X2Y3 B、XY3
C、X2Y6 D、 X2Y4B5、在化学反应前后,肯定没有变化( )
①原子的数目 ②元素的种类
③原子的种类 ④物质的总质量
⑤物质的种类 ⑥分子的种类
A. ① ③ ⑤ B. ② ④ ⑥
C. ④ ⑤ ⑥ D. ① ② ③ ④D6、某纯净物M密封稍加热就分解为氨气(NH3)、 二氧化碳和水,则该物质中含有 种元素,它 们分别是__________________.四N 、H 、 C 、 O7. 不能用质量守恒定律解释的是( )
A. 潮湿的衣服在阳光下晒干? ?? B. 蜡烛燃烧越来越短 C. 铁丝烧后质量增加??? D. 高锰酸钾受热后质量减小A9. 反应4P + 5O2 点燃 2P2O5中,每 质量的磷和 质量的氧气反应生成 质量的五氧化二磷 1241602848、根据化学方程式不能获得的信息是( )
A、该反应中的反应物和生成物
B、各反应物和生成物的质量比
C、反应发生所需要的条件
D、化学反应的快慢D在一密闭容器内有四种物质,在一定条件下充分反应后,测得反应前后各物质的质量如下: 讨论:1、参加反应的物质是 ,反应后生成的物质是 。
2、反应后D的质量X为 g。
你的理由是: A、DB、C9参加反应的各物质的质量总和等于反应后生成的各物质质量总和。Y+14+2-4反应中改变的质量即2+14=4+Y; 则Y=12。反应后D的质量X=21-Y=9g2、配平下列化学方程式
(1) C + CO2 2CO
(2) Al + O2 Al2O3
(3) CuO + C Cu + CO2
(4) C2H2 + O2 H2O + CO2
(5) H2S + O2 S + H2O点燃高温课堂练习34 3 22 22 5 2 42 2 2
2、学反应“质量守恒”的原因:
3、化学反应中的“变”与“不变”
从微观上看不发生改变的是_____________、
___________、____________;一定发生改变的是_____________.
从宏观上看不发生改变的是___________________、
______________________;一定发生改变的是__________________.考点归纳:原子的种类原子的数目原子的质量分子的种类物质的总质量元素的种类和质量物质的种类把握关键词① 化学反应③ 质量总和④ 等于② 参加下列说法能用质量守恒定律解释的是A.mg水受热变为mg的水蒸气
B.62g磷和80g的氧反应生成142g五氧化二磷
C.20g食盐溶于80g水得到100g的食盐水
D.拧开盛酒精的瓶盖一段时间后质量变小三、质量守恒定律的应用1、简单计算例1、在化学反应A +B = C 中,10克A物质恰好与8克B物质完全反应,则生成C物质的质量为 ( )
A、 8克 B、18克 C、10克 D、无法确定
例2、将27.5克高锰酸钾粉末加热,完全反应后剩余固体物质的质量为17.9克,则生成氧气的质量为 ( )
A、9.6克 B、12.6克 C、6.6克 D、14.9克(化学反应前后物质的总质量守恒)2、C+O2 CO2反应中,12克C与16克O2反应 后 ,生成物C的质量是
克。3、加热10 g氯酸钾和二氧化锰的混合物,反应后称得残留物的质量总和为9.52 g,则生成氧气的质量为 g2、确定物质的元素组成例3 : 植物进行光合作用可简单表示为
H2O + CO2 淀粉 + O2 由此判断:淀粉中一定含有 ____________元素,可能含有 元素。(化学反应前后元素种类守恒) 1、 某物质在空气中燃烧生成二氧化硫和水,能否根据这一事实,推断出蜡烛中肯定会有什么元素?可能会有什么元素? 一定有的元素:
可能有的元素:硫元素、氢元素氧元素、一定质量的某化合物完全燃烧,消耗9.6克氧气,生成8.8克二氧化碳和5.4克水。对该化合物的组成判断正确的是( )
A、含有C、H、O三种元素
B、只含有C、H两种元素
C、分子中C、H原子个数比为1﹕3 D、以上答案都不正确3、确定化学式例4、
西班牙的瑞奥汀河是一条酸河,河水中含有硫酸和硫酸亚铁。经调查发现,酸河形成的原因是由于上游河床含有的某种物质R在水中氧的作用下发生反应所致,其反应的化学方程式2R+2H2O+7O2====2FeSO4+2H2SO4则R的化学式为( )
A. FeS B. Fe2S3 C. FeS2 D. FeO(化学反应前后原子的种类、数目守恒)2006年中考题:食物中的糖类给人体提供热量,某糖X在人体内发生的反应是:
X+6O2=6CO2+6H2O,则X的化学式为:___________;判断的依据是_______________。C6H12O6质量守恒定律4、解释一些实验事实: 镁带在空气中燃烧生成氧化镁后的质量比原来金属镁的质量大,有人说这个事实不符合质量守恒定律,你说对吗?为什么?答:此说法不对。镁带在空气里燃烧,是镁和
氧气发生了化学反应。根据质量守恒定
律,反应后生成物氧化镁的质量,一定等
于参加反应的镁带和氧气的质量和,所以
生成物的质量比镁带质量大。2、有人说他能使水变成汽油(含有大量的碳、氢元素),一本万利。现在,他要把这项发明权超低价卖给你,你会买吗?请你用化学知识揭开骗子的可恶面纱。1、根据质量守恒定律解释以下现象: 高锰酸钾受热分解后,剩余固体的质量比原反应物的质量小。二、化学方程式含义:质的方面:表示反应物是什么物质,生成物是什么物质量的方面:配平的化学方程式可以表示:
(1)反应物、生成物之间的质量比。
(2)参加反应的反应物的总质量等于生成物的总质量
(3)各种微粒的对应关系三、化学方程式的书写1、要尊重客观事实
2、要遵守质量守恒定律原则化学方程式书写的步骤:书写常见错误。1.臆造不存在的反应。
2.写错物质的化学式。
3.反应条件出错。
4 .末配平。
5.漏标或多标“↑”或“↓”符号。根据已学知识判断下列反应方程式是否正确。如有错误,请指出错误之处。
(1)3Fe+2O2 Fe2O3
(2)Mg+O2 MgO2
(3)CH4+O2 CO2+H2O点燃点燃根据化学方程式的计算例1、加热分解5.8克氯酸钾,可以得到多少克氧气?解:设加热分解5.8克氯酸钾得到氧气的质量为x1、设未知数:
一般是求什么,
设什么。245965.8克x245∶96==5.8克∶xX=2.3克答:加热分解5.8克氯酸钾,可得到2.3克氧气。2、正确的写出
化学方程式:3、找出有关物质
的量:上下对齐,
已知量单位要写出4、列比例式:5、求解:
(除不尽时一般
保留一位小数)6、简明写出
答案。根据化学方程式的计算步骤:
设.写. 找.列.解.答练、将7.9g的KMnO4加热分解,能得到标准状况下的氧气多少升?(标准状况下氧气的密度为1.429g/L)
练习:1、在化学反应2X2 +3Y2 = 2R 中,若用X、Y表示R的化学式,其中正确的是( )
(A)X3Y2 (B)X2Y (C)X3Y4 (D)XY22、铅丹 + 4HNO3 =PbO2 + 2Pb(NO3)2 + 2H2O ,根据化学方程式可推知铅丹的化学式为( )
A. Pb B. PbO C. Pb2O3 D. Pb3O4 4、在化学反应2XY2+Y2=2Z中Z的化学式为( )
A、X2Y3 B、XY3
C、X2Y6 D、 X2Y4B5、在化学反应前后,肯定没有变化( )
①原子的数目 ②元素的种类
③原子的种类 ④物质的总质量
⑤物质的种类 ⑥分子的种类
A. ① ③ ⑤ B. ② ④ ⑥
C. ④ ⑤ ⑥ D. ① ② ③ ④D6、某纯净物M密封稍加热就分解为氨气(NH3)、 二氧化碳和水,则该物质中含有 种元素,它 们分别是__________________.四N 、H 、 C 、 O7. 不能用质量守恒定律解释的是( )
A. 潮湿的衣服在阳光下晒干? ?? B. 蜡烛燃烧越来越短 C. 铁丝烧后质量增加??? D. 高锰酸钾受热后质量减小A9. 反应4P + 5O2 点燃 2P2O5中,每 质量的磷和 质量的氧气反应生成 质量的五氧化二磷 1241602848、根据化学方程式不能获得的信息是( )
A、该反应中的反应物和生成物
B、各反应物和生成物的质量比
C、反应发生所需要的条件
D、化学反应的快慢D在一密闭容器内有四种物质,在一定条件下充分反应后,测得反应前后各物质的质量如下: 讨论:1、参加反应的物质是 ,反应后生成的物质是 。
2、反应后D的质量X为 g。
你的理由是: A、DB、C9参加反应的各物质的质量总和等于反应后生成的各物质质量总和。Y+14+2-4反应中改变的质量即2+14=4+Y; 则Y=12。反应后D的质量X=21-Y=9g2、配平下列化学方程式
(1) C + CO2 2CO
(2) Al + O2 Al2O3
(3) CuO + C Cu + CO2
(4) C2H2 + O2 H2O + CO2
(5) H2S + O2 S + H2O点燃高温课堂练习34 3 22 22 5 2 42 2 2
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
