金属的化学性质[下学期]
图片预览





文档简介
课件13张PPT。课题2 金属的化学性质东莞市济川中学
卢德枢老师本节课的学习目标
一、金属的化学性质
二、置换反应
三、金属活动性顺序及应用依据1、金属与氧气的反应
Mg +O2 ===
Al + O2 ===
Fe + O2 ===
Cu + O2 === 点燃加热点燃点燃2MgO2Al2O3
Fe3O42CuO一、金属的化学性质在空气中在纯氧中不燃烧,表面变黑活泼程度:Mg>Al、Fe>Cu
243322探究目的:比较镁、铁、铜、锌四种金属的活泼程度
你的假设是:
实验内容:将盐酸(或稀硫酸)加入四支试管中,观察
观察注意:1、金属与酸能否反应
(1)可与盐酸、稀硫酸反应的金属有:
(2)不与盐酸、稀硫酸反应的金属有:
2、若能反应,请比较各金属反应的剧烈程度
剧烈程度从大到小为:
3、反应中,伴随着的现象是:
你的结论是:
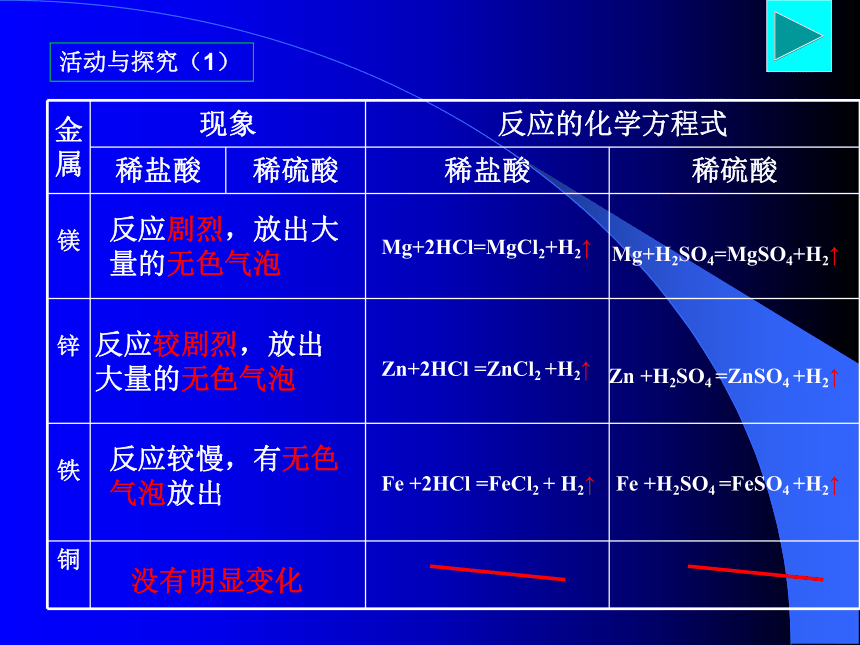
活动与探究(1)Mg、Zn、FeCu活泼程度:Mg>Zn>Fe> CuMg>Zn>Fe有气泡生成活动与探究(1)反应剧烈,放出大量的无色气泡反应较剧烈,放出大量的无色气泡反应较慢,有无色气泡放出没有明显变化Mg+2HCl=MgCl2+H2↑Zn+2HCl =ZnCl2 +H2↑Fe +2HCl =FeCl2 + H2↑Mg+H2SO4=MgSO4+H2↑Zn +H2SO4 =ZnSO4 +H2↑Fe +H2SO4 =FeSO4 +H2↑
Mg + 2HCl == MgCl2 + H2↑
Fe + 2HCl == FeCl2 + H2↑
Zn + H2SO4 == ZnSO4 + H2↑
Fe + H2SO4 == FeSO4 + H2↑
单质单质化合物化合物二、置换反应
由一种单质与一种化合物反应,生成另一种单质与另一种化合物的化学变化。
2、金属与酸的反应活动与探究(2)铝表面有红色的固体析出铜丝表面有白色的固体析出没有明显变化Al+CuSO4=FeSO4+CuCu+2AgNO3=Cu(NO3)2+2Ag铝与硫酸铜溶液的反应铜与硝酸银溶液的反应实验结论:(1)Mg>Al、Fe>Cu
(2) Mg>Zn>Fe> Cu
(3) Al> Cu>Ag活动性: Mg>Zn>Fe> Cu>Ag金属活动性由强减弱K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au三、金属活动性顺序钾 钙 钠 镁 铝 锌 铁 锡 铅(氢)铜 汞 银 铂 金判断的依据:
1、在金属活动性顺序里,位置越前,它的活动性越强。
2、在金属活动性顺序里,位于氢前的金属能置换出盐酸、
稀硫酸中的氢。
3、在金属活动性顺序里,位于前面的金属能把后面的金
属从它们化合物的溶液里置换出来。(K、Ca、Na三种金属除外)(不是氢气)(钾最强)1、请设计一个实验方案,鉴别真假黄金。
2、下列物质能否发生反应?写出能发生反应的化学方程式。
(1)银与稀盐酸
(2)锌与硫酸铜溶液
(3)铜与硫酸锌溶液
(4)铝与硝酸银溶液练习家庭小实验 收集几种金属,取少量分别放入几个小玻璃杯中,然后向各个玻璃杯中加入一些食醋(主要成分是醋酸),仔细观察发生的现象,试根据现象判断这几种金属的活动性差异。
卢德枢老师本节课的学习目标
一、金属的化学性质
二、置换反应
三、金属活动性顺序及应用依据1、金属与氧气的反应
Mg +O2 ===
Al + O2 ===
Fe + O2 ===
Cu + O2 === 点燃加热点燃点燃2MgO2Al2O3
Fe3O42CuO一、金属的化学性质在空气中在纯氧中不燃烧,表面变黑活泼程度:Mg>Al、Fe>Cu
243322探究目的:比较镁、铁、铜、锌四种金属的活泼程度
你的假设是:
实验内容:将盐酸(或稀硫酸)加入四支试管中,观察
观察注意:1、金属与酸能否反应
(1)可与盐酸、稀硫酸反应的金属有:
(2)不与盐酸、稀硫酸反应的金属有:
2、若能反应,请比较各金属反应的剧烈程度
剧烈程度从大到小为:
3、反应中,伴随着的现象是:
你的结论是:
活动与探究(1)Mg、Zn、FeCu活泼程度:Mg>Zn>Fe> CuMg>Zn>Fe有气泡生成活动与探究(1)反应剧烈,放出大量的无色气泡反应较剧烈,放出大量的无色气泡反应较慢,有无色气泡放出没有明显变化Mg+2HCl=MgCl2+H2↑Zn+2HCl =ZnCl2 +H2↑Fe +2HCl =FeCl2 + H2↑Mg+H2SO4=MgSO4+H2↑Zn +H2SO4 =ZnSO4 +H2↑Fe +H2SO4 =FeSO4 +H2↑
Mg + 2HCl == MgCl2 + H2↑
Fe + 2HCl == FeCl2 + H2↑
Zn + H2SO4 == ZnSO4 + H2↑
Fe + H2SO4 == FeSO4 + H2↑
单质单质化合物化合物二、置换反应
由一种单质与一种化合物反应,生成另一种单质与另一种化合物的化学变化。
2、金属与酸的反应活动与探究(2)铝表面有红色的固体析出铜丝表面有白色的固体析出没有明显变化Al+CuSO4=FeSO4+CuCu+2AgNO3=Cu(NO3)2+2Ag铝与硫酸铜溶液的反应铜与硝酸银溶液的反应实验结论:(1)Mg>Al、Fe>Cu
(2) Mg>Zn>Fe> Cu
(3) Al> Cu>Ag活动性: Mg>Zn>Fe> Cu>Ag金属活动性由强减弱K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au三、金属活动性顺序钾 钙 钠 镁 铝 锌 铁 锡 铅(氢)铜 汞 银 铂 金判断的依据:
1、在金属活动性顺序里,位置越前,它的活动性越强。
2、在金属活动性顺序里,位于氢前的金属能置换出盐酸、
稀硫酸中的氢。
3、在金属活动性顺序里,位于前面的金属能把后面的金
属从它们化合物的溶液里置换出来。(K、Ca、Na三种金属除外)(不是氢气)(钾最强)1、请设计一个实验方案,鉴别真假黄金。
2、下列物质能否发生反应?写出能发生反应的化学方程式。
(1)银与稀盐酸
(2)锌与硫酸铜溶液
(3)铜与硫酸锌溶液
(4)铝与硝酸银溶液练习家庭小实验 收集几种金属,取少量分别放入几个小玻璃杯中,然后向各个玻璃杯中加入一些食醋(主要成分是醋酸),仔细观察发生的现象,试根据现象判断这几种金属的活动性差异。
同课章节目录
