第八单元 金属与金属材料|课题2 金属的化学性质[下学期]
文档属性
| 名称 | 第八单元 金属与金属材料|课题2 金属的化学性质[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 185.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-03-18 07:33:00 | ||
图片预览






文档简介
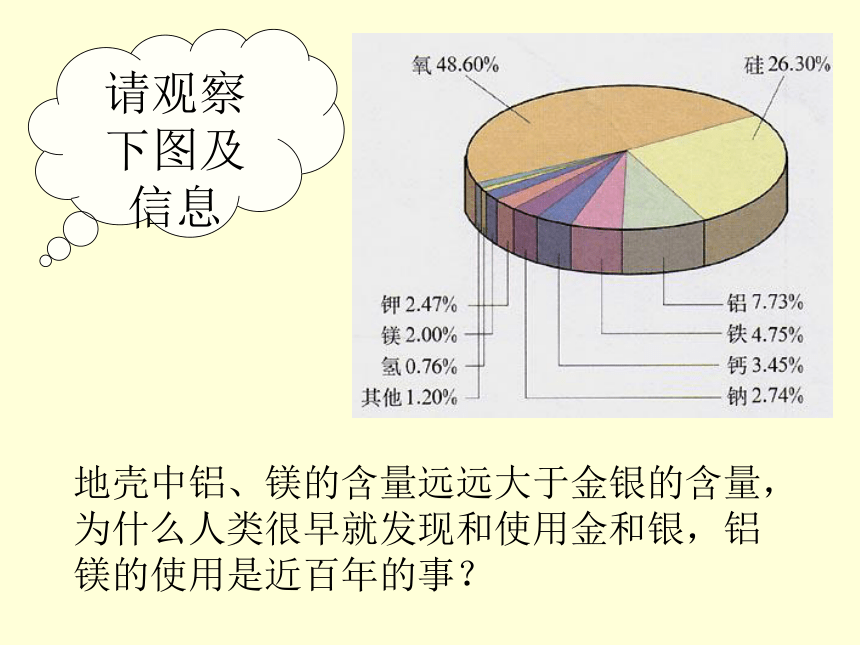
课件17张PPT。金属的化学性质坦洲实验中学初三化学组请观察右图两种金属的颜色金、银不与氧气反应请观察下图及信息地壳中铝、镁的含量远远大于金银的含量,为什么人类很早就发现和使用金和银,铝镁的使用是近百年的事?一、金属与氧气在常温下反应 2Cu+ O2 = 2CuO 4Al + 3O2 = 2Al2O3 2Mg + O2 = 2MgO 请回忆在第七单元化学反应的能量变化中,我们演示过一个放热反应是哪一个?反应现象如何?Mg+2HCl=MgCl2 +H2↑二、金属与酸反应有快有无有无较快较慢哪些金属能与盐酸反应?哪些不能?反应的剧烈程度如何?讨论反应后生成什么气体?根据反应时是否有气泡产生及产生气泡速度的快慢,可否判断金属的活动性强弱?结论:Mg>Zn>Fe>Cu反应化学方程式:Mg+2HCl=MgCl2 +H2↑Zn+2HCl=ZnCl2 +H2↑Fe+2HCl=FeCl2 +H2↑上述反应有什么特点?讨论是否为分解反应还是化合反应?置换反应:由一种单质与一种化合 物反应,生成另一种单质与另一种化合物的反应Fe+2HCl=FeCl2 +H2↑回忆1、碳与氧化铜反应2、氢气与氧化铜反应 2CuO + C 2Cu + CO2 ↑ CuO + H2 Δ Cu + H2O 高温 (碳抢占了氧化铜中铜的位置)(氢抢占了氧化铜中铜的位置)1、抢占位置: Cl+ MgH2、定化学式:MgCl2+H2例:3、配 平:MgCl2+H21、抢占位置: Cl+ ZnH2、定化学式:ZnCl2+H2例:3、配 平:2HCl+ZnZnCl2+H2二、金属与酸反应有快有无有无较快较慢Mg+H2SO4 =Zn+H2SO4 =Fe+H2SO4 =MgSO4+H2↑
ZnSO4+H2 ↑
FeSO4+H2 ↑想一想 所见金属中是否为各种金属的本质颜色?
如果不是本质颜色,那么原因又是什么? Mg+2HCl=MgCl2 +H2↑Mg+2HCl →MgH2 +Cl2↑
ZnSO4+H2 ↑
FeSO4+H2 ↑想一想 所见金属中是否为各种金属的本质颜色?
如果不是本质颜色,那么原因又是什么? Mg+2HCl=MgCl2 +H2↑Mg+2HCl →MgH2 +Cl2↑
同课章节目录
