人教版高中化学必修一4.3硫和氮的氧化物(第1课时)
文档属性
| 名称 | 人教版高中化学必修一4.3硫和氮的氧化物(第1课时) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-16 08:40:28 | ||
图片预览











文档简介
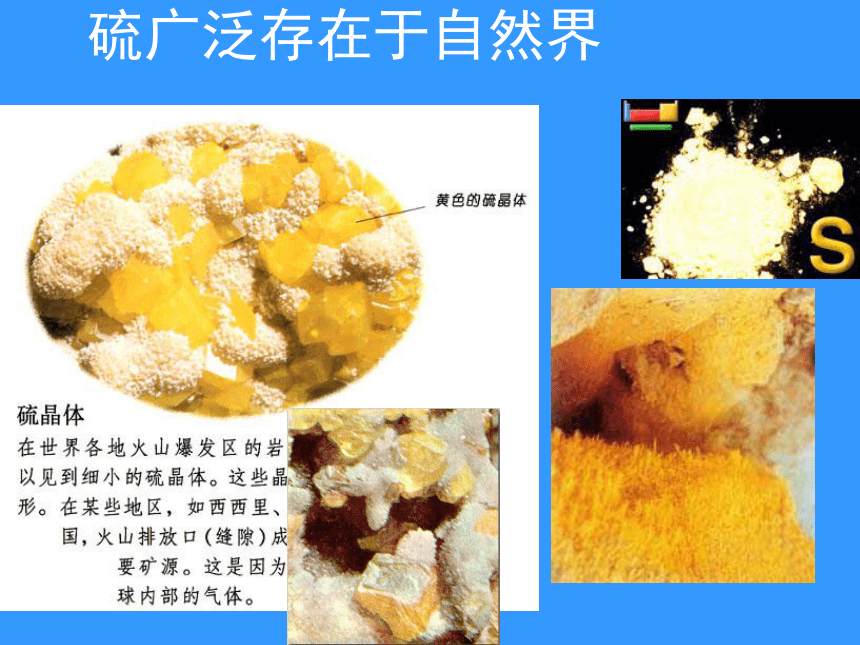
课件53张PPT。第三节 硫和氮的氧化物硫广泛存在于自然界 游离态的硫存在于火山喷口附近或地壳的岩层里 硫广泛存在于自然界 化合态的硫主要以硫化物和硫酸盐的形式存在石膏黄铁矿黄铜矿化合态的硫主要以硫化物和硫酸盐的形式存在石膏CaSO4·2H2O硫铁矿FeS2黄铜矿CuFeS2芒硝:Na2SO4·10H2O硫还是一种生命元素,组成某些蛋白质离不开它 蛋白质中的硫:蛋黄内含硫,如果煮鸡蛋的时间过长,硫会转移到蛋黄的边缘,形成灰色的细环。硫是增强人们体质的蛋白质中至关重要的一部分。蛋白质分解后会产生硫化氢,有臭蛋味的有毒气体。硫还是一种生命元素,组成某些蛋白质离不开它,石油、天然气、煤等化石燃料中经常含硫的原因。一、硫( sulphur) 淡黄色晶体(俗称硫磺)质脆,容易研成粉末。不溶于水,微溶于酒精,易溶于二硫化碳。 熔沸点低(112.8℃, 444.6 ℃)1、硫的物理性质:它能氧化某些非金属单质2、硫的化学性质:硫在空气中燃烧,发出微弱的淡蓝色火焰,在氧气燃烧,明亮的蓝紫色火焰。 著名的杭州灵隐寺的“摩崖石刻”近年经酸雨侵蚀,佛像眼睛、鼻子、耳朵等剥蚀严重,面目皆非,修补后,古迹不“古”。 受酸雨伤害的水稻 未受酸雨伤害的水稻 二.二氧化硫(sulphur dioxide)1.无色、有刺激性气味、有毒气体2.比空气密度大3.易溶于水
(1体积水溶解40体积SO2)4.易液化(101KPa沸点是-10℃)(NH3溶于水1:700 )(HCl 溶于水1:500 )(一).二氧化硫的物理性质:实验室制SO2气体,应注意什么?该如何收集? 实验室制SO2应注意防止空气污染!
用向上排空气法收集。 思考(二).二氧化硫的化学性质:⑴与水的反应:1、具有酸性氧化物的通性SO2溶于水 【现象】:
①紫色石蕊试液变成红色;
②液体沿试管内壁上升。 【实验】:实验:二氧化硫与品红溶液的作用(二).二氧化硫的化学性质:(中强酸)二氧化硫气体的水溶液可以使紫色的石蕊试液变为红色。⑴与水的反应:思考: 如何检验二氧化硫气体已经充满容器?1、具有酸性氧化物的通性可逆反应: 在同一条件下,
既能向正反应方向进行,
同时又能向负反应方向进行的反应叫做可逆反应。把向生成物方向进行的反应叫做正反应,
把向反应物方向进行的反应叫做逆反应SO2+2NaOH=Na2SO3 + H2O ⑵与碱的反应:CO2+2NaOH=Na2CO3 + H2OCO2+Na2CO3 +H2O=2NaHCO3CO2+NaOH=NaHCO3SO2+Na2SO3 +H2O=2NaHSO3SO2+NaOH=NaHSO3思考:实验室制取SO2,可选择碱液吸收尾气,防止空气污染。怎样区别SO2与CO2?⑵与碱的反应:SO2与澄清石灰水反应,
有与CO2类似的现象。 CO2+Ca(OH)2=CaCO3↓+ H2OSO2+Ca(OH)2=CaSO3↓+ H2O⑶与盐的反应:SO2+ Na2SO3 + H2O = 2NaHSO3⑷与碱性氧化物的反应:SO2+Na2O = Na2SO3SO2 + CaO = CaSO3 亚硫酸盐的溶解性规律除钠、钾、铵盐外,
其余大多难溶于水,
这一点与碳酸盐极为相似。SO2 中的S化合价是+4价:“高价氧化,低价还 ,中间价态两边转”∴ SO2既有氧化性,又有还原性。
被氧化2.还原性 SO3 + H2O==H2SO4SO3是一种无色固体,
熔点16.8℃,
沸点44.8℃。SO3 + H2O==H2SO4SO3是一种无色固体,
熔点16.8℃,
沸点44.8℃。SO3 + CaO = CaSO4SO3+Ca(OH)2=CaSO4 + H2O思考:SO2能不能与氯水、为什么?SO2 +Cl2+2H2O=H2SO4 +2HCl(两种气体生成两种强酸)3、氧化性2H2S+SO2 ==3S↓ +2H2O还原剂 氧化剂4.二氧化硫的漂白性:实验:二氧化硫与品红溶液的作用现象:向品红溶液中通入SO2气体,品红溶液的颜色逐渐褪去变为无色,二氧化硫有漂白作用,但漂白后的新物质不稳定,易恢复原来的颜色。 给试管加热以后,溶液又变为红色。 SO2可以用来漂白纸浆、毛、丝、草编制品等。 *据市场调查,市售一次性筷子在制作时为了增白、防腐,也是用硫磺熏蒸,因此多数一次性筷子含二氧化硫量超标,提醒消费者使用前先闻一下是否有酸味。*白木耳又叫银耳,属真菌类食品,具有生津、止咳、降火等功效。一些不法分子为了得到更白的银耳,在大硼内放置了硫磺,采用传统的“硫磺熏蒸”工艺,银耳中往往含有一定量的二氧化硫,最近上海质检部门对21种银耳进行抽查,二氧化硫含量居然全部超标,最高达2.23g/kg,最低达0.125g/kg。因此银耳并非越白越好。吸附
有色
色素将有色的色素
氧化为稳定的
无色物质
与色素结合
成不稳定的
无色物质物理
变化化学变化(三)、二氧化硫的用途⑵可以漂白纸浆、毛、丝、草编制品等。 ⑶杀灭霉菌和细菌。⑷作食物和干果的防腐剂。⑴制造硫酸:小结SO2重视环境保护,防止酸雨危害环境!与H2O反应与碱反应酸酐与碱性氧化物 氧化性还原性+4价为检验SO2中是否混有少量的CO2气体杂质,以下方法正确的是 A、通入澄清石灰水中
B、先通入澄清石灰水中,再通入品红溶液中
C、先通入足量酸性高锰酸钾溶液中,再通入澄清石灰水中C* 下列反应中,SO2被还原的是A、SO2+CaO=CaSO3
B、SO2+Br2+2H2O=H2SO4+2HBr
C、SO2+2Mg=S+2MgO
D、SO2+H2O2=H2SO4C关于SO2的下列说法不正确的是
A.是无色无味的气体
B.易液化
C.一定条件下能与O2反应
D.具有氧化性和还原性
E.水溶液具有强酸性
F.能使品红溶液褪色 AE*下列变化中不属于化学变化的是 A、SO2使品红溶液褪色
B、氯水使有色布条褪色
C、活性炭使红墨水褪色
D、O3使某些染料褪色C 品红溶液品红溶液 KMnO4
溶液澄清石灰水 木炭 1、虚线框中的装置可用来检验碳与浓硫酸在加热条件下反应产生的所有气体 浓H2SO4 无水CuSO4① ② ③ ⑴如果装置中①②③的三部分仪器的连接 顺序改为②①③,则可以检验出的物质是: ,不能检验出的物质⑵如果将仪器的连接顺序改为①③②,则 可以检验出的物质是: , 不能检验出的物质
⑶如果将仪器的连接顺序改为②③①,则可以检验出的物质是: ,不能检验出的物质是: 。澄清石灰水 木炭 浓H2SO4 ⑴①②③连接 顺序改为②①③,则可以检验出的物质是: ,不能检验出的物质是: 。② ① ③SO2 CO2 H2O 木炭 浓H2SO4 ⑵ 改为①③ ② ,则可以检验出的物质是: ,不能检验出的物质是: 。品红溶液品红溶液 KMnO4
溶液① ③ ② SO2 H2OCO2木炭 浓H2SO4 ⑶改为② ③ ①,则可以检验出的物质是: ,不能检验出的物质是: 。② ③ ①SO2 CO2 H2O 澄清石灰水稀氨水和酚酞稀氨水中的NH3逸出,所以溶液的颜色变浅(2)在试管中注入
某无色溶液,加热试管,
溶液变为红色,
冷却后恢复无色,则此溶液可能是 __ __溶液;加热时溶液由无色变为红色的原因是: 溶有SO2气体的品红 SO2气体逸出,品红溶液恢复红色。 2研究性学习小组进行SO2的制备及性质探究实验。
⑴ 根据反应
Na2SO3(固) + H2SO4(浓) == Na2SO4 + SO2↑+H2O,制备SO2气体。
①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图(每种装置都有若干个) 带孔
橡皮塞 锥形瓶 集气瓶 漏斗 导管 液体 固体分液Na2SO3 NaOH 浓H2SO4 ② 实验过程中,使用分液漏斗滴加浓硫酸的操作是_______________________________________ 。 。
⑵ 将SO2气体分别通入下列溶液中:
① 品红溶液,现象是______________。
② 溴水溶液,现象是______________。
③ 硫化钠溶液,现象是____________。
⑶ 有一小组在实验中发现,SO2氧化产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)
① 原因_________,验证方法____________。
② 原因__________,验证方法_____________ 。
③ 原因_______________,验证方法_ 打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加 溶液褪色溶液褪色有浅黄色沉淀 ⑶ 有一小组在实验中发现,SO2氧化产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)
① 原因___________,验证方法 :
② 原因__________,验证方法:
③ 原因_______________,验证方法
Na2SO3变质 不是浓硫酸 取待测试样于试管中,先滴加足量稀盐酸,再加入BaCl2溶液,有白色沉淀产生,证明Na2SO3固体变质 用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明不是浓硫酸。 利用图示装置,选用适当的试剂完成下述实验或得出相应的实验结论。SO2气体使品红褪色浓H2SO4Na2SO3品红溶液利用图示装置,选用适当的试剂完成下述实验或得出相应的实验结论。4、有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。请回答下列问题:
⑴第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
⑵请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
2Na2O2+2SO2=2Na2SO3+O2取白色固体,加稀硫酸,产生能使品红溶液褪色的气体。上述方案是否合理?。请简要说明两点理由:
①
② BaCl2
溶液 稀硝酸白色
沉淀 将B中反应后的固体溶解于水 仍有部分白色沉淀不溶解,证明有Na2SO4生成(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:稀硝酸能将亚硫酸钡氧化为硫酸钡,如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根
(1体积水溶解40体积SO2)4.易液化(101KPa沸点是-10℃)(NH3溶于水1:700 )(HCl 溶于水1:500 )(一).二氧化硫的物理性质:实验室制SO2气体,应注意什么?该如何收集? 实验室制SO2应注意防止空气污染!
用向上排空气法收集。 思考(二).二氧化硫的化学性质:⑴与水的反应:1、具有酸性氧化物的通性SO2溶于水 【现象】:
①紫色石蕊试液变成红色;
②液体沿试管内壁上升。 【实验】:实验:二氧化硫与品红溶液的作用(二).二氧化硫的化学性质:(中强酸)二氧化硫气体的水溶液可以使紫色的石蕊试液变为红色。⑴与水的反应:思考: 如何检验二氧化硫气体已经充满容器?1、具有酸性氧化物的通性可逆反应: 在同一条件下,
既能向正反应方向进行,
同时又能向负反应方向进行的反应叫做可逆反应。把向生成物方向进行的反应叫做正反应,
把向反应物方向进行的反应叫做逆反应SO2+2NaOH=Na2SO3 + H2O ⑵与碱的反应:CO2+2NaOH=Na2CO3 + H2OCO2+Na2CO3 +H2O=2NaHCO3CO2+NaOH=NaHCO3SO2+Na2SO3 +H2O=2NaHSO3SO2+NaOH=NaHSO3思考:实验室制取SO2,可选择碱液吸收尾气,防止空气污染。怎样区别SO2与CO2?⑵与碱的反应:SO2与澄清石灰水反应,
有与CO2类似的现象。 CO2+Ca(OH)2=CaCO3↓+ H2OSO2+Ca(OH)2=CaSO3↓+ H2O⑶与盐的反应:SO2+ Na2SO3 + H2O = 2NaHSO3⑷与碱性氧化物的反应:SO2+Na2O = Na2SO3SO2 + CaO = CaSO3 亚硫酸盐的溶解性规律除钠、钾、铵盐外,
其余大多难溶于水,
这一点与碳酸盐极为相似。SO2 中的S化合价是+4价:“高价氧化,低价还 ,中间价态两边转”∴ SO2既有氧化性,又有还原性。
被氧化2.还原性 SO3 + H2O==H2SO4SO3是一种无色固体,
熔点16.8℃,
沸点44.8℃。SO3 + H2O==H2SO4SO3是一种无色固体,
熔点16.8℃,
沸点44.8℃。SO3 + CaO = CaSO4SO3+Ca(OH)2=CaSO4 + H2O思考:SO2能不能与氯水、为什么?SO2 +Cl2+2H2O=H2SO4 +2HCl(两种气体生成两种强酸)3、氧化性2H2S+SO2 ==3S↓ +2H2O还原剂 氧化剂4.二氧化硫的漂白性:实验:二氧化硫与品红溶液的作用现象:向品红溶液中通入SO2气体,品红溶液的颜色逐渐褪去变为无色,二氧化硫有漂白作用,但漂白后的新物质不稳定,易恢复原来的颜色。 给试管加热以后,溶液又变为红色。 SO2可以用来漂白纸浆、毛、丝、草编制品等。 *据市场调查,市售一次性筷子在制作时为了增白、防腐,也是用硫磺熏蒸,因此多数一次性筷子含二氧化硫量超标,提醒消费者使用前先闻一下是否有酸味。*白木耳又叫银耳,属真菌类食品,具有生津、止咳、降火等功效。一些不法分子为了得到更白的银耳,在大硼内放置了硫磺,采用传统的“硫磺熏蒸”工艺,银耳中往往含有一定量的二氧化硫,最近上海质检部门对21种银耳进行抽查,二氧化硫含量居然全部超标,最高达2.23g/kg,最低达0.125g/kg。因此银耳并非越白越好。吸附
有色
色素将有色的色素
氧化为稳定的
无色物质
与色素结合
成不稳定的
无色物质物理
变化化学变化(三)、二氧化硫的用途⑵可以漂白纸浆、毛、丝、草编制品等。 ⑶杀灭霉菌和细菌。⑷作食物和干果的防腐剂。⑴制造硫酸:小结SO2重视环境保护,防止酸雨危害环境!与H2O反应与碱反应酸酐与碱性氧化物 氧化性还原性+4价为检验SO2中是否混有少量的CO2气体杂质,以下方法正确的是 A、通入澄清石灰水中
B、先通入澄清石灰水中,再通入品红溶液中
C、先通入足量酸性高锰酸钾溶液中,再通入澄清石灰水中C* 下列反应中,SO2被还原的是A、SO2+CaO=CaSO3
B、SO2+Br2+2H2O=H2SO4+2HBr
C、SO2+2Mg=S+2MgO
D、SO2+H2O2=H2SO4C关于SO2的下列说法不正确的是
A.是无色无味的气体
B.易液化
C.一定条件下能与O2反应
D.具有氧化性和还原性
E.水溶液具有强酸性
F.能使品红溶液褪色 AE*下列变化中不属于化学变化的是 A、SO2使品红溶液褪色
B、氯水使有色布条褪色
C、活性炭使红墨水褪色
D、O3使某些染料褪色C 品红溶液品红溶液 KMnO4
溶液澄清石灰水 木炭 1、虚线框中的装置可用来检验碳与浓硫酸在加热条件下反应产生的所有气体 浓H2SO4 无水CuSO4① ② ③ ⑴如果装置中①②③的三部分仪器的连接 顺序改为②①③,则可以检验出的物质是: ,不能检验出的物质⑵如果将仪器的连接顺序改为①③②,则 可以检验出的物质是: , 不能检验出的物质
⑶如果将仪器的连接顺序改为②③①,则可以检验出的物质是: ,不能检验出的物质是: 。澄清石灰水 木炭 浓H2SO4 ⑴①②③连接 顺序改为②①③,则可以检验出的物质是: ,不能检验出的物质是: 。② ① ③SO2 CO2 H2O 木炭 浓H2SO4 ⑵ 改为①③ ② ,则可以检验出的物质是: ,不能检验出的物质是: 。品红溶液品红溶液 KMnO4
溶液① ③ ② SO2 H2OCO2木炭 浓H2SO4 ⑶改为② ③ ①,则可以检验出的物质是: ,不能检验出的物质是: 。② ③ ①SO2 CO2 H2O 澄清石灰水稀氨水和酚酞稀氨水中的NH3逸出,所以溶液的颜色变浅(2)在试管中注入
某无色溶液,加热试管,
溶液变为红色,
冷却后恢复无色,则此溶液可能是 __ __溶液;加热时溶液由无色变为红色的原因是: 溶有SO2气体的品红 SO2气体逸出,品红溶液恢复红色。 2研究性学习小组进行SO2的制备及性质探究实验。
⑴ 根据反应
Na2SO3(固) + H2SO4(浓) == Na2SO4 + SO2↑+H2O,制备SO2气体。
①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图(每种装置都有若干个) 带孔
橡皮塞 锥形瓶 集气瓶 漏斗 导管 液体 固体分液Na2SO3 NaOH 浓H2SO4 ② 实验过程中,使用分液漏斗滴加浓硫酸的操作是_______________________________________ 。 。
⑵ 将SO2气体分别通入下列溶液中:
① 品红溶液,现象是______________。
② 溴水溶液,现象是______________。
③ 硫化钠溶液,现象是____________。
⑶ 有一小组在实验中发现,SO2氧化产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)
① 原因_________,验证方法____________。
② 原因__________,验证方法_____________ 。
③ 原因_______________,验证方法_ 打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加 溶液褪色溶液褪色有浅黄色沉淀 ⑶ 有一小组在实验中发现,SO2氧化产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)
① 原因___________,验证方法 :
② 原因__________,验证方法:
③ 原因_______________,验证方法
Na2SO3变质 不是浓硫酸 取待测试样于试管中,先滴加足量稀盐酸,再加入BaCl2溶液,有白色沉淀产生,证明Na2SO3固体变质 用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明不是浓硫酸。 利用图示装置,选用适当的试剂完成下述实验或得出相应的实验结论。SO2气体使品红褪色浓H2SO4Na2SO3品红溶液利用图示装置,选用适当的试剂完成下述实验或得出相应的实验结论。4、有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。请回答下列问题:
⑴第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
⑵请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
2Na2O2+2SO2=2Na2SO3+O2取白色固体,加稀硫酸,产生能使品红溶液褪色的气体。上述方案是否合理?。请简要说明两点理由:
①
② BaCl2
溶液 稀硝酸白色
沉淀 将B中反应后的固体溶解于水 仍有部分白色沉淀不溶解,证明有Na2SO4生成(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:稀硝酸能将亚硫酸钡氧化为硫酸钡,如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根
