人教版高中化学必修一第四章第二节富集在海水中的元素——氯 课件
文档属性
| 名称 | 人教版高中化学必修一第四章第二节富集在海水中的元素——氯 课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-16 08:38:21 | ||
图片预览











文档简介
课件33张PPT。第四章 非金属及其化合物第二节
富集在海水中的元素—氯长芦盐场我国海盐产量最大的盐场,主要分布于河北省和天津市的渤海沿岸,其中以塘沽盐场规模最大,年产盐119万吨。 以NaCl为主要成分的食盐,至今仍是人类惟一必须的食用盐。 知识拓展 :
海洋生物资源 大陆架的浅海海底:
石油、天然气、煤、硫、磷等
近岸带的滨海砂矿:
砂、贝壳等建筑材料和金属矿产
多数海盆中:
深海锰结核知识拓展:
海底矿产资源【思考与交流1 】你对氯气了解多少?氯气是一种什么样的物质?有什么样的性质?
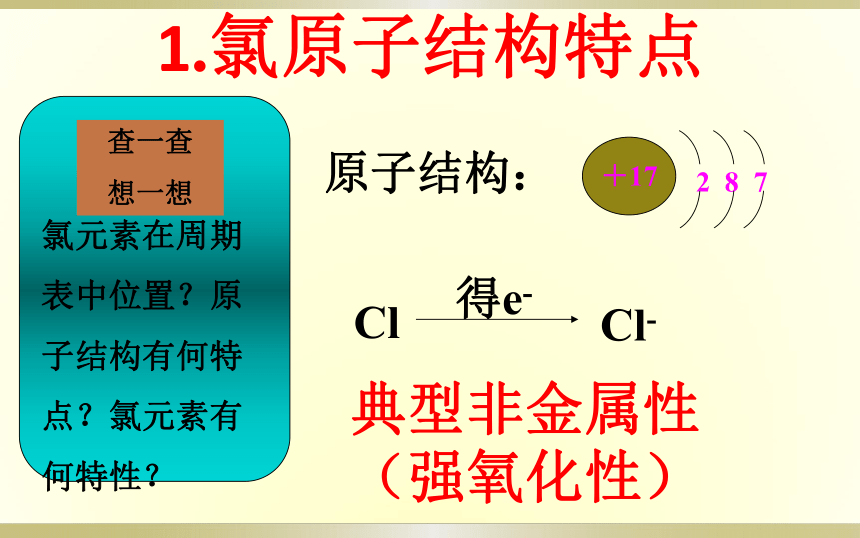
1915年4月22日下午5时,在第一次世界大战两军对峙的比利时伊珀尔战场。趁着顺风,德军一声令下开启了大约6000只预先埋伏的压缩氯气钢瓶。刹那间在68千米宽的正面形成2米高的黄绿色气体幕墙滚滚向前推进,纵深到达10-15公里,对手毫无防范,致使5千多人死亡,一万五千多人中毒致伤。一位战地记者进行了如此描述:“他们已经死亡,两手伸展着好像要挥去上方的死神。尸体遍野,他们极度痛苦的肺在喘息,满嘴都是黄色液体。”这就是战争史上的第一次化学战,从此,化学战作为最邪恶的战争被写入了人类战争的史册。这种气体就是我们研究的氯气。 第一次世界大战的伊普雷战役中,德国5分钟释放了180吨氯气,使15000人中毒,三分之一的人死去。人类历史上第一次大规模使用化学武器1.氯原子结构特点 原子结构: 典型非金属性 (强氧化性)Cl得e-Cl-化合价:-1,+1,+2,+3,
+4,+5,+6,+7
得电子能力强,非金属性强1774年舍勒 发现氯气
他将这种元素命名为Chlorine,这个名称
来自希腊文,有“绿色”的意思。我国早
年译文将其译成“绿气”,后改为氯气。舍勒测定过软锰矿(二氧化锰)的性质。他用盐酸与软锰矿反应,发现了一种强烈的刺鼻气味的黄绿色气体(Cl2)。氯气有毒想想怎样闻氯气2.氯气的性质(1)物理性质①氯气是黄绿色
②有刺激性气味,有毒的气体
③易液化
④密度比空气大
⑤能溶于水(1体积水可溶解2体积氯气)——加压液化,贮存在钢瓶中——向上排空气法收集不能用排水法收集,可用排饱和食盐水法收集闻氯气的方法是:用手轻轻地在瓶口扇动,仅使极少量的氯气飘进鼻孔。
注意:这是闻各种气体气味的方法。在一定条件(点燃或灼热)下氯气能否与金属反应?金属的价态有什么规律?铜与氯气铜丝在氯气里剧烈燃烧,产生棕黄色的烟,产物溶于水后,溶液呈蓝绿色。现象铁与氯气现象铁丝剧烈燃烧,产生—————色的————棕褐烟钠与氯气现象剧烈燃烧,火焰呈——色,生成———晶体白色反应规律:生成高价金属的氯化物 ?FeCl3和CuCl2能用它们的金属与盐酸反应制取吗?黄①氯气与金属反应 ?(2)氯气的化学性质例2:怎样制取FeCl2。 Fe+2HCl FeCl2+H2↑例1:下列化合物中,不能由氯气和相应的金属直接反应来制取的是
A. FeCl3 B. CaCl2 C. FeCl2 D. KCl(C)干燥的氯气
常温不与铁反应纯净的氢气在氯气中安静地燃烧,发出苍白色火焰,放出大量的热,瓶口有大量白雾产生。燃烧:任何发光发热的剧烈的化学反应叫做燃烧。燃烧不一定要有氧气参加,燃烧的本质是氧化还原反应。实验证明,在一定条件下,Cl2还能与P、S、C等非金属直接化合。实验现象氢气和氯气的混合气体光照后发生爆炸。通过H2在Cl2中燃烧的实验,你对燃烧的条件及其本质有什么新的认识?②氯气与非金属反应 探究结果:【实验4-4】【思考与交流】现象:有色纸条褪色 将红纸放到氯水中红纸褪色,为什么?是氯气具有漂白性,还是氯气与水反应后生成的新物质具有漂白性?如何通过实验验证你的猜想?如何证明氯气分子有无漂白性?【实验4-5】:将干燥的有色纸条放入盛满氯气的试管中,塞好塞子现象:有色纸条不褪色结论:干燥的氯气没有漂白性③氯气与水反应次氯酸的性质:3、强氧化性
漂白作用1、弱酸性2、不稳定易分解可用于自来水的杀菌、消毒,可用做漂白剂。阅读与思考(1)打开自来水龙头为何有刺激性气味?
(2)氯气溶于水为何有杀菌、消毒作用?
(3)干燥的Cl2有杀菌、消毒和漂白作用吗?次氯酸酸性:H2CO3 >HClO液氯与氯水的区别?新制氯水与久置氯水的区别?纯净物混合物分子:离子:Cl2、HClO、H2OH+,Cl-,ClO-,O H-分子:H2O离子:H+,Cl-,O H-新制有氧化性,无酸性和漂白性有酸性,强氧化性,能漂白,消毒,光照时HClO分解久置只有Cl2子实验室中使用的氯水只能现配现用,并盛放在棕色试剂瓶中。只有酸性根据氯气与水的反应原理,推测氯气与NaOH能否发生反应?若反应,其产物是什么?④氯气与碱反应2NaOH+Cl2=NaClO+NaCl+H2O有效成分:NaClO2 Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O漂白粉、漂粉精漂白液有效成分:Ca(ClO)2 氯气跟碱反应的化学方程式有规律吗?日常 Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO工业 Ca(ClO)2+2HCl===CaCl2+2HClO漂白原理:(反应原理:强酸制取弱酸)氯水、漂白液、漂白粉、漂粉精的漂白作用都是因反应生成的HClO漂白液和漂白粉的漂白原理
A.NaClO+HCl=NaCl+HClO
2NaClO+CO2+H2O=Na2CO3 + 2HClO
B.Ca(ClO)2+2HCl=CaCl2+2HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
(漂白粉在潮湿的空气中容易失效)注:此处为“强酸制弱酸,弱酸可以制更弱的酸”。⑤与盐溶液的反应与FeCl2 、NaBr、KI等盐溶液反应(表现氯气的强氧化性)2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
Cl2 + 2Br- = 2Cl- + Br2
Cl2 + 2 I- = 2Cl- + I2[思考与交流]氯水如何保存?为什么?久置氯水和新制氯水有何区别?答:棕色玻璃瓶密封避光保存
新制氯水:H+ 、 Cl- 、 ClO- 、 HClO、Cl2 、 H2O,有强氧化性。
久置氯水:盐酸溶液,无强氧化性。1.氯气的实验室制法
(1)反应原理:
(2)仪器装置:
主要仪器:铁架台、酒精灯、圆底烧瓶、分液漏斗、集气瓶、烧杯等。装置如下图所示。说明:C装置的作用是除去Cl2中的HCl;D装置的作用是干燥Cl2;F装置的作用是吸收多余的Cl2,防止污染环境。
(3)收集方法:
①向上排空气法(Cl2密度大于空气)。
②排饱和食盐水法(Cl2在饱和NaCl溶液中的溶解度很小,且用此法可除去实验过程中挥发产生的HCl气体)。(4)验满方法:
①将湿润的淀粉碘化钾试纸靠近盛Cl2的瓶口,观察到试纸立即变蓝,则证明已集满。
②将湿润的蓝色石蕊试纸靠近盛Cl2的瓶口,观察到试纸立即发生先变红后褪色的变化,则证明已集满。
(5)尾气处理: Cl2有毒,易污染空气,需用NaOH溶液吸收。
2.实验室制取氯气的其他方法
可用KMnO4、KClO3、Ca(ClO)2等氧化剂代替MnO2与浓盐酸反应(不需加热):3、氯气的用途杀菌消毒
制漂白粉(液)
作制高纯硅、锗和钛的中间物质
合成塑料、橡胶、农药、药品等
观察实验4-6有关反应的离子方程式是:
Ag+ + Cl– == AgCl ?
2Ag+ + CO32- == Ag2CO3 ?
Ag2CO3 + 2H+ == 2Ag+ + CO2 ?+ H2O 某溶液中加入AgNO3溶液产生白色沉淀,则可确定该溶液中一定有氯离子,这种说法对不对? 取少量(适量)待测液于试管中,先滴加几滴稀HNO3,再滴加几滴AgNO3溶液。若开始无明显现象,后有沉淀产生,则说明待测液中有Cl–。(2)方法和结论:(1)试剂:AgNO3溶液、稀硝酸小 结 ?例3、下列说法正确的是: A、Cl2有毒,Cl-也有毒 B、Cl和Cl-化学性质一样C、 Cl2和Cl-都是黄绿色 D、液氯并非氯水例4.将新制的氯水缓缓滴入预先滴有酚酞的 NaOH溶液中,当滴到一定量时红色完全褪去。产生这一现象的原因可能有两种:
(1)是______________________________________
(2)是_____________________________________________新制氯水中的HCl、HClO与 NaOH发生中和反应,使NaOH无剩余。新制氯水中HClO具有漂白性,使红色溶液褪色D1、不能由单质直接化合而成的是( )
A、AlCl3 B、NaCl C、FeCl2 D、CuCl2 2、自来水可以氯气用消毒、某学生用这种自来水去配制下列物质的溶液,不会产生明显的药品变质问题的是( )
①AgNO3②FeCl3③AlCl3 ④ NaOH ⑤FeCl2
⑥Na2CO3
A、①②⑥ B、③④ C、② ③ D、 ④⑤⑥CC
富集在海水中的元素—氯长芦盐场我国海盐产量最大的盐场,主要分布于河北省和天津市的渤海沿岸,其中以塘沽盐场规模最大,年产盐119万吨。 以NaCl为主要成分的食盐,至今仍是人类惟一必须的食用盐。 知识拓展 :
海洋生物资源 大陆架的浅海海底:
石油、天然气、煤、硫、磷等
近岸带的滨海砂矿:
砂、贝壳等建筑材料和金属矿产
多数海盆中:
深海锰结核知识拓展:
海底矿产资源【思考与交流1 】你对氯气了解多少?氯气是一种什么样的物质?有什么样的性质?
1915年4月22日下午5时,在第一次世界大战两军对峙的比利时伊珀尔战场。趁着顺风,德军一声令下开启了大约6000只预先埋伏的压缩氯气钢瓶。刹那间在68千米宽的正面形成2米高的黄绿色气体幕墙滚滚向前推进,纵深到达10-15公里,对手毫无防范,致使5千多人死亡,一万五千多人中毒致伤。一位战地记者进行了如此描述:“他们已经死亡,两手伸展着好像要挥去上方的死神。尸体遍野,他们极度痛苦的肺在喘息,满嘴都是黄色液体。”这就是战争史上的第一次化学战,从此,化学战作为最邪恶的战争被写入了人类战争的史册。这种气体就是我们研究的氯气。 第一次世界大战的伊普雷战役中,德国5分钟释放了180吨氯气,使15000人中毒,三分之一的人死去。人类历史上第一次大规模使用化学武器1.氯原子结构特点 原子结构: 典型非金属性 (强氧化性)Cl得e-Cl-化合价:-1,+1,+2,+3,
+4,+5,+6,+7
得电子能力强,非金属性强1774年舍勒 发现氯气
他将这种元素命名为Chlorine,这个名称
来自希腊文,有“绿色”的意思。我国早
年译文将其译成“绿气”,后改为氯气。舍勒测定过软锰矿(二氧化锰)的性质。他用盐酸与软锰矿反应,发现了一种强烈的刺鼻气味的黄绿色气体(Cl2)。氯气有毒想想怎样闻氯气2.氯气的性质(1)物理性质①氯气是黄绿色
②有刺激性气味,有毒的气体
③易液化
④密度比空气大
⑤能溶于水(1体积水可溶解2体积氯气)——加压液化,贮存在钢瓶中——向上排空气法收集不能用排水法收集,可用排饱和食盐水法收集闻氯气的方法是:用手轻轻地在瓶口扇动,仅使极少量的氯气飘进鼻孔。
注意:这是闻各种气体气味的方法。在一定条件(点燃或灼热)下氯气能否与金属反应?金属的价态有什么规律?铜与氯气铜丝在氯气里剧烈燃烧,产生棕黄色的烟,产物溶于水后,溶液呈蓝绿色。现象铁与氯气现象铁丝剧烈燃烧,产生—————色的————棕褐烟钠与氯气现象剧烈燃烧,火焰呈——色,生成———晶体白色反应规律:生成高价金属的氯化物 ?FeCl3和CuCl2能用它们的金属与盐酸反应制取吗?黄①氯气与金属反应 ?(2)氯气的化学性质例2:怎样制取FeCl2。 Fe+2HCl FeCl2+H2↑例1:下列化合物中,不能由氯气和相应的金属直接反应来制取的是
A. FeCl3 B. CaCl2 C. FeCl2 D. KCl(C)干燥的氯气
常温不与铁反应纯净的氢气在氯气中安静地燃烧,发出苍白色火焰,放出大量的热,瓶口有大量白雾产生。燃烧:任何发光发热的剧烈的化学反应叫做燃烧。燃烧不一定要有氧气参加,燃烧的本质是氧化还原反应。实验证明,在一定条件下,Cl2还能与P、S、C等非金属直接化合。实验现象氢气和氯气的混合气体光照后发生爆炸。通过H2在Cl2中燃烧的实验,你对燃烧的条件及其本质有什么新的认识?②氯气与非金属反应 探究结果:【实验4-4】【思考与交流】现象:有色纸条褪色 将红纸放到氯水中红纸褪色,为什么?是氯气具有漂白性,还是氯气与水反应后生成的新物质具有漂白性?如何通过实验验证你的猜想?如何证明氯气分子有无漂白性?【实验4-5】:将干燥的有色纸条放入盛满氯气的试管中,塞好塞子现象:有色纸条不褪色结论:干燥的氯气没有漂白性③氯气与水反应次氯酸的性质:3、强氧化性
漂白作用1、弱酸性2、不稳定易分解可用于自来水的杀菌、消毒,可用做漂白剂。阅读与思考(1)打开自来水龙头为何有刺激性气味?
(2)氯气溶于水为何有杀菌、消毒作用?
(3)干燥的Cl2有杀菌、消毒和漂白作用吗?次氯酸酸性:H2CO3 >HClO液氯与氯水的区别?新制氯水与久置氯水的区别?纯净物混合物分子:离子:Cl2、HClO、H2OH+,Cl-,ClO-,O H-分子:H2O离子:H+,Cl-,O H-新制有氧化性,无酸性和漂白性有酸性,强氧化性,能漂白,消毒,光照时HClO分解久置只有Cl2子实验室中使用的氯水只能现配现用,并盛放在棕色试剂瓶中。只有酸性根据氯气与水的反应原理,推测氯气与NaOH能否发生反应?若反应,其产物是什么?④氯气与碱反应2NaOH+Cl2=NaClO+NaCl+H2O有效成分:NaClO2 Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O漂白粉、漂粉精漂白液有效成分:Ca(ClO)2 氯气跟碱反应的化学方程式有规律吗?日常 Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO工业 Ca(ClO)2+2HCl===CaCl2+2HClO漂白原理:(反应原理:强酸制取弱酸)氯水、漂白液、漂白粉、漂粉精的漂白作用都是因反应生成的HClO漂白液和漂白粉的漂白原理
A.NaClO+HCl=NaCl+HClO
2NaClO+CO2+H2O=Na2CO3 + 2HClO
B.Ca(ClO)2+2HCl=CaCl2+2HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
(漂白粉在潮湿的空气中容易失效)注:此处为“强酸制弱酸,弱酸可以制更弱的酸”。⑤与盐溶液的反应与FeCl2 、NaBr、KI等盐溶液反应(表现氯气的强氧化性)2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
Cl2 + 2Br- = 2Cl- + Br2
Cl2 + 2 I- = 2Cl- + I2[思考与交流]氯水如何保存?为什么?久置氯水和新制氯水有何区别?答:棕色玻璃瓶密封避光保存
新制氯水:H+ 、 Cl- 、 ClO- 、 HClO、Cl2 、 H2O,有强氧化性。
久置氯水:盐酸溶液,无强氧化性。1.氯气的实验室制法
(1)反应原理:
(2)仪器装置:
主要仪器:铁架台、酒精灯、圆底烧瓶、分液漏斗、集气瓶、烧杯等。装置如下图所示。说明:C装置的作用是除去Cl2中的HCl;D装置的作用是干燥Cl2;F装置的作用是吸收多余的Cl2,防止污染环境。
(3)收集方法:
①向上排空气法(Cl2密度大于空气)。
②排饱和食盐水法(Cl2在饱和NaCl溶液中的溶解度很小,且用此法可除去实验过程中挥发产生的HCl气体)。(4)验满方法:
①将湿润的淀粉碘化钾试纸靠近盛Cl2的瓶口,观察到试纸立即变蓝,则证明已集满。
②将湿润的蓝色石蕊试纸靠近盛Cl2的瓶口,观察到试纸立即发生先变红后褪色的变化,则证明已集满。
(5)尾气处理: Cl2有毒,易污染空气,需用NaOH溶液吸收。
2.实验室制取氯气的其他方法
可用KMnO4、KClO3、Ca(ClO)2等氧化剂代替MnO2与浓盐酸反应(不需加热):3、氯气的用途杀菌消毒
制漂白粉(液)
作制高纯硅、锗和钛的中间物质
合成塑料、橡胶、农药、药品等
观察实验4-6有关反应的离子方程式是:
Ag+ + Cl– == AgCl ?
2Ag+ + CO32- == Ag2CO3 ?
Ag2CO3 + 2H+ == 2Ag+ + CO2 ?+ H2O 某溶液中加入AgNO3溶液产生白色沉淀,则可确定该溶液中一定有氯离子,这种说法对不对? 取少量(适量)待测液于试管中,先滴加几滴稀HNO3,再滴加几滴AgNO3溶液。若开始无明显现象,后有沉淀产生,则说明待测液中有Cl–。(2)方法和结论:(1)试剂:AgNO3溶液、稀硝酸小 结 ?例3、下列说法正确的是: A、Cl2有毒,Cl-也有毒 B、Cl和Cl-化学性质一样C、 Cl2和Cl-都是黄绿色 D、液氯并非氯水例4.将新制的氯水缓缓滴入预先滴有酚酞的 NaOH溶液中,当滴到一定量时红色完全褪去。产生这一现象的原因可能有两种:
(1)是______________________________________
(2)是_____________________________________________新制氯水中的HCl、HClO与 NaOH发生中和反应,使NaOH无剩余。新制氯水中HClO具有漂白性,使红色溶液褪色D1、不能由单质直接化合而成的是( )
A、AlCl3 B、NaCl C、FeCl2 D、CuCl2 2、自来水可以氯气用消毒、某学生用这种自来水去配制下列物质的溶液,不会产生明显的药品变质问题的是( )
①AgNO3②FeCl3③AlCl3 ④ NaOH ⑤FeCl2
⑥Na2CO3
A、①②⑥ B、③④ C、② ③ D、 ④⑤⑥CC
