安徽省涡阳县高考复习中心2006年理综仿真模拟无机框图推断试题(55题)[下学期]
文档属性
| 名称 | 安徽省涡阳县高考复习中心2006年理综仿真模拟无机框图推断试题(55题)[下学期] |

|
|
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-10-03 00:00:00 | ||
图片预览

文档简介
安徽省涡阳县高考复习中心2006年理综仿真模拟
无机框图推断试题
1.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,B跟Cl2反应除生成C外,另一产物是盐酸盐。
用化学式号填写下列空格:
(1)A是__________。
(2)当X是强酸时,A、B、C、D、E、F均含同一种元素,F是__________。
(3)当X是强碱时,A、B、C、D、E、F均含同一种元素,F是__________。
(4)B跟Cl2反应的化学方程式是________________________________________。
2.如图,各物质有下列转化关系:
请回答以下问题:
①若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是_______________。
②若B为常见金属或非金属单质,E是酸酐,且为易挥发的晶体,则A是_______________;D转化为E的一定条件是_______________。
③若C是水,B是有机化合物,且是同系物中相对分子质量最小的物质,E能使紫色石蕊试液变红色。则A是_______________。
3.下列物质间在一定条件下可实现图中所示的一系列变化。其中固体W的焰色反应呈紫色,A是一切生物都不能缺少的气体。
请回答:
(1)判断X、Y各是什么物质 X__________Y__________。
(2)写出有关反应的化学方程式:
①Z+H2SO4 (浓)→C
②W+H2SO4 (浓)→D+T
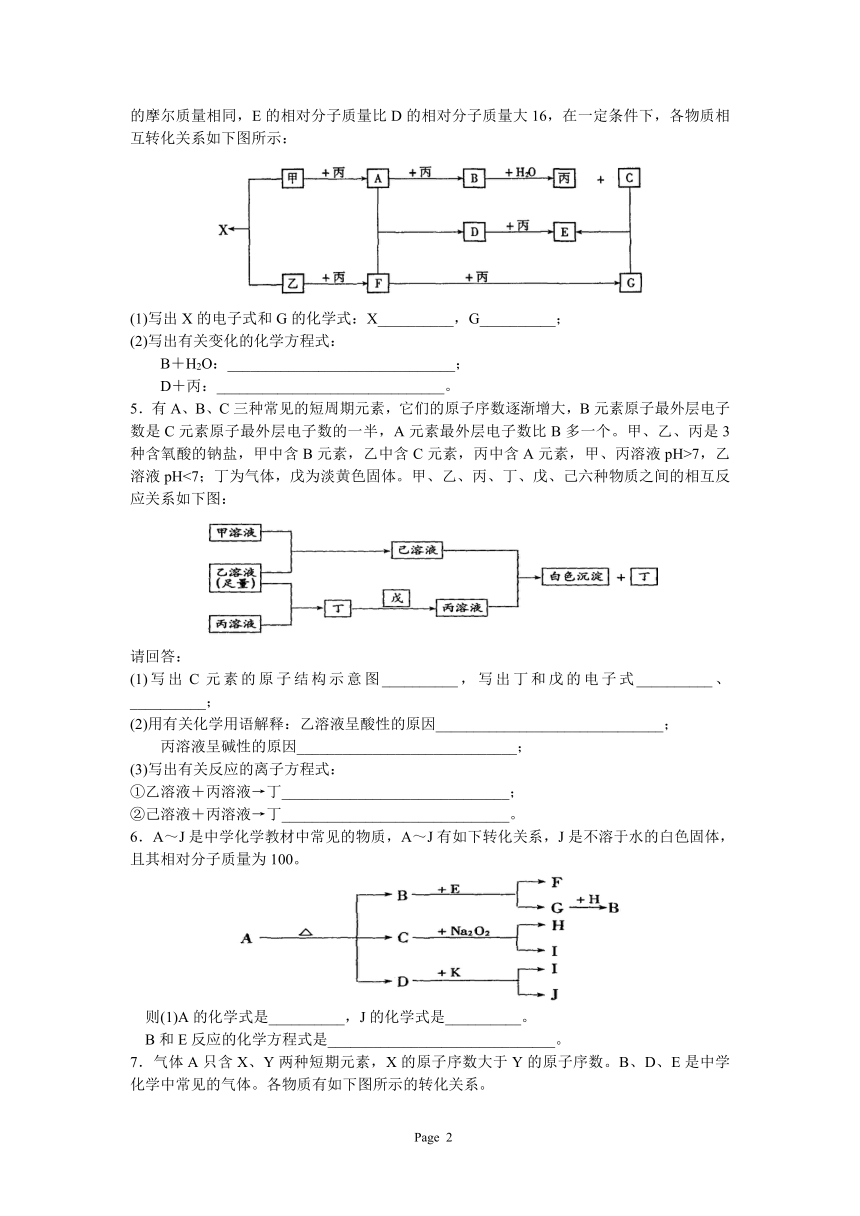
4.已知甲、乙、丙为常见单质,A、B、C、D、E、F、G、X均为常见的化合物;B和X的摩尔质量相同,E的相对分子质量比D的相对分子质量大16,在一定条件下,各物质相互转化关系如下图所示:
(1)写出X的电子式和G的化学式:X__________,G__________;
(2)写出有关变化的化学方程式:
B+H2O:______________________________;
D+丙:______________________________。
5.有A、B、C三种常见的短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:
请回答:
(1)写出C元素的原子结构示意图__________,写出丁和戊的电子式__________、__________;
(2)用有关化学用语解释:乙溶液呈酸性的原因______________________________;
丙溶液呈碱性的原因_____________________________;
(3)写出有关反应的离子方程式:
①乙溶液+丙溶液→丁______________________________;
②己溶液+丙溶液→丁______________________________。
6.A~J是中学化学教材中常见的物质,A~J有如下转化关系,J是不溶于水的白色固体,且其相对分子质量为100。
则(1)A的化学式是__________,J的化学式是__________。
B和E反应的化学方程式是______________________________。
7.气体A只含X、Y两种短期元素,X的原子序数大于Y的原子序数。B、D、E是中学化学中常见的气体。各物质有如下图所示的转化关系。
回答下列问题:
(1)若气体A是混合气体,X与Y的质量比小于3,则气体A中肯定有(写化学式) __________;
(2)若气体A为单一气体,且分子是直线型结构。又知X与Y两元素的质量比数值上等于X的相对原子质量。A分子的电子式为__________,A燃烧的化学方程式为______________________________;
(3)C与固体单质甲在高温下发生反应的化学方程式为______________________________。固体乙为常见化合物,写出一种固体乙的化学式__________。
8.图中①~⑩分别代表有关反应中的一种物质,它们均是中学化学中常见物质。已知①~③和⑥~⑩中分别含有同一种元素。
(1)分别写出①、④、⑧的化学式或离子符号:
①_________,④_________,⑧_________。
(2)写出下列反应方程式,是离子反应的写出离子方程式:
①+OH—→________________________________
⑤-→________________________________
①+⑥—→________________________________
⑨+空气→________________________________
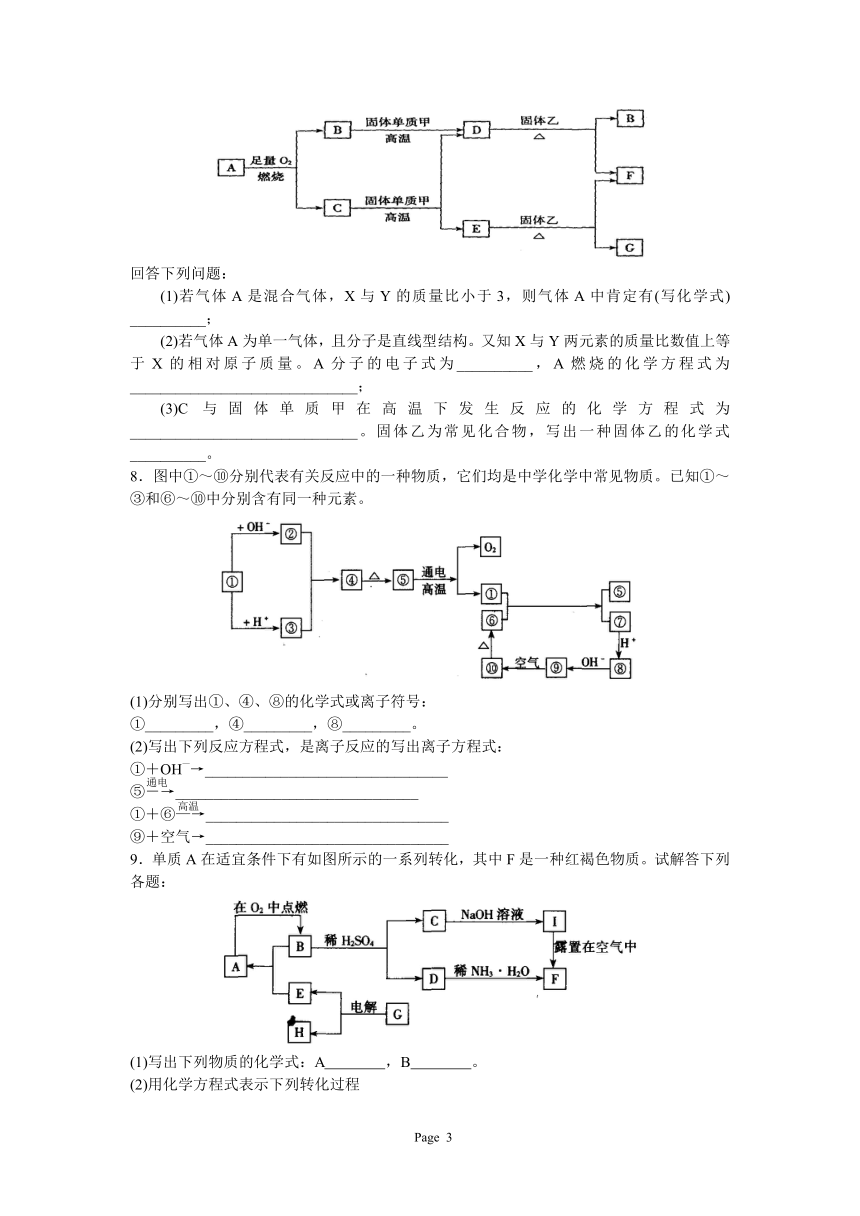
9.单质A在适宜条件下有如图所示的一系列转化,其中F是一种红褐色物质。试解答下列各题:
(1)写出下列物质的化学式:A ,B 。
(2)用化学方程式表示下列转化过程
B+H2SO4→C+D:___________________________。
I露置在空气中转化为F:___________________________。
(3)G可能是_________或_________;每生成1molE同时生成与其对应H的物质的量是 _________ mol或_________mol。
10.某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现图所示的物质之间的变化:
据此判断:
(1)固体B所含物质的化学式为______________。
(2)固体E所含物质的化学式为______________。
(3)反应①的离子方程式为______________。
11.以下各单质和化合物之间存在下列转化关系(各单质和化合物中所含元素均为短周期元素):
(1)试确定单质A和B的化学式:A________,B________。
(2)写出化合物甲与NaOH溶液反应的化学方程式________________________________。
(3)写出化合物乙转化为化合物丁的离子方程式________________________________。
12.硫酸钡是惟一无毒的钡盐,工业上以BaSO4等为原料通入图所示流程反应可以制备锌钡白和过氧化氢:
(1)上述流程中共有7个化学反应,其中有__________个属于氧化还原反应。
(2)写出过氧化氢的电子式:__________;写出物质H的电子式:__________。
(3)写出下列化学反应方程式:
反应①:____________________;
反应③:____________________;
反应④:____________________;
反应⑦:____________________。
13.下列关系图中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸。当X无论是强酸还是强碱时,都有如下转化关系:
当X是强酸时,A、B、C、D、E均含有同一元素:当X是强碱时,A、B、C、D、E均含有另一种元素。回答下列问题:
A是_______________,Y是______________,Z是_____________。
当X是强碱时,E是 _______________,当X是强酸,E是____________。
写出A与X反应的离子方程式:
①_______________________________________________;
②_______________________________________________。
14.下图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。
(1)写出下列各物质的名称或化学式:
X: ;B: ;F: ;G: 。
(2)写出下列变化的反应方程式:
A→D: ;G→E: 。
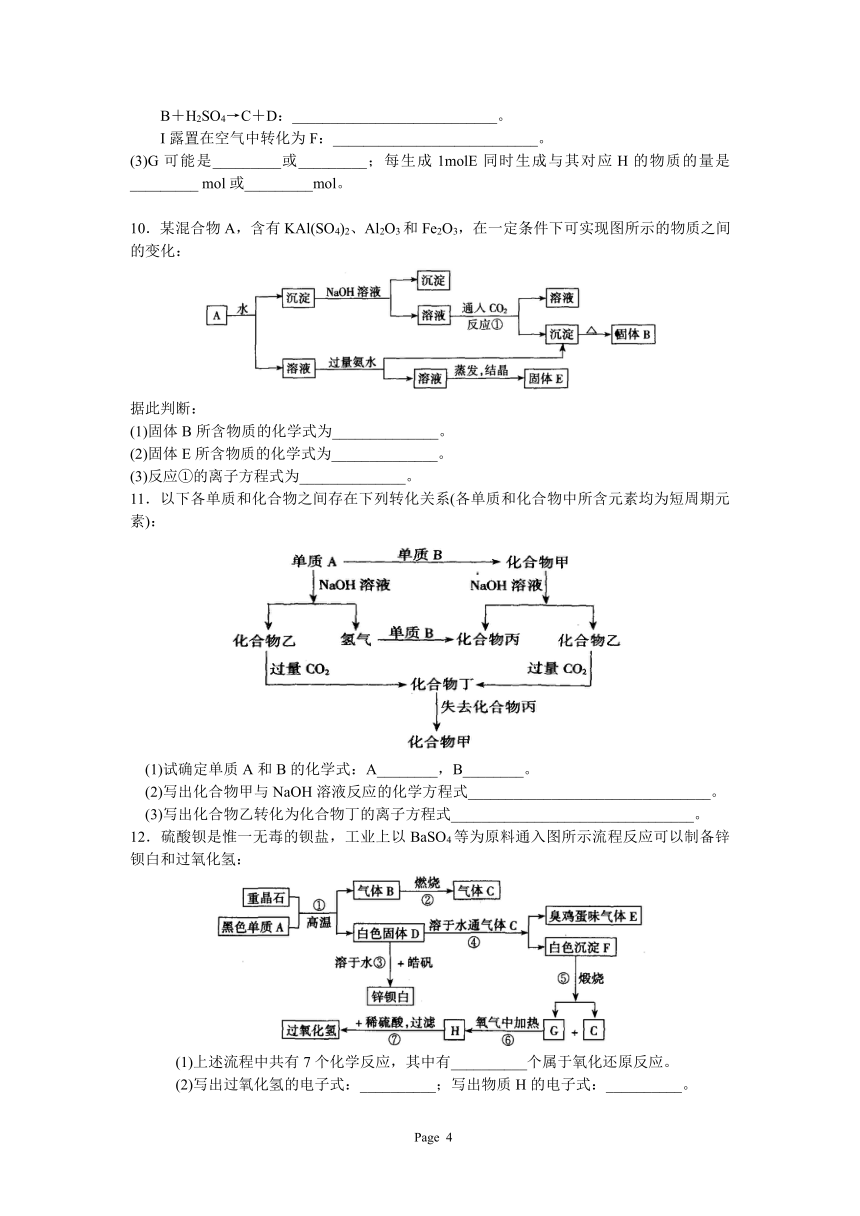
15.
(3)溶液I中所含的金属离子是 。单质B加强碱溶液生成单质F和溶液K的离子反应方程式是 。
(4)由C→E+F弱改用浓酸,则不能选用的浓酸是 。
16.室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下面框图进行反应,又知E溶液是无色的,请回答:
(1)A是 ,B是 ,C是 (填化学式)
(2)反应⑥的化学方程式为: 。
(3)反应④的离子方程式为: 。
17.下图是中学化学中常见的物质间化学反应关系的图示,其中A的焰色反应呈黄色,E、F为有刺激性气味的气体,G为强酸性溶液,H为既难溶于水、也难溶于稀酸的白色固体。
试回答:
(1)写出化学式:A_______________;B_______________。
(2)写出下列反应的离子方程式:
①C→E:______________________________;
②D→H:______________________________;
③E+F+H2O→G:______________________________。
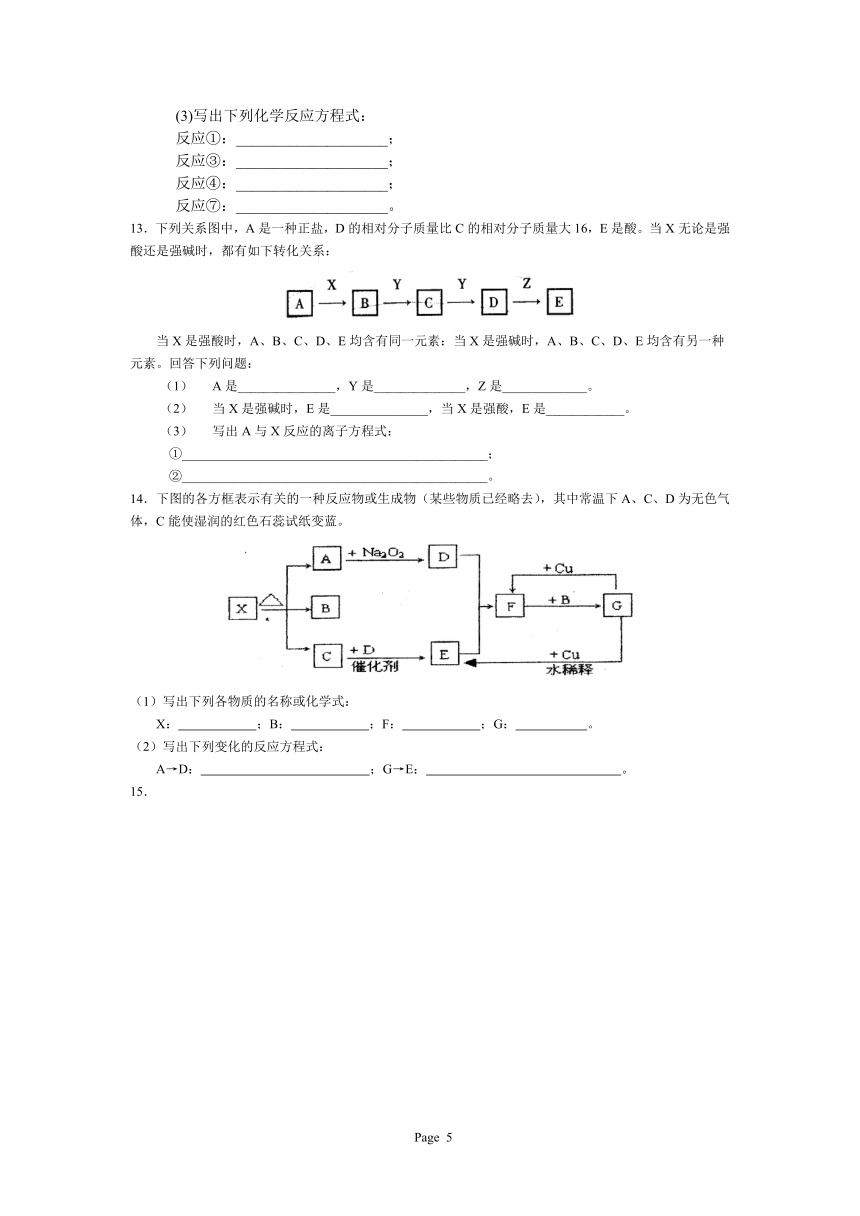
18.下图①一⑩分别代表有关反应中的一种物质,请填写以下空白。①、③、④的化学式分别是:_________,_________,_________。
⑧与⑨反应的化学方程式是:__________________。
19.已知下列转化关系中的中学化学常见物质A、B、C、D、E中均含有同一种元素,
A、C均为气体,E为液体,下图中箭头上的反应物和反应条件均已略去。
(1)当A与E发生化合反应时,能观察到空气中形成大量的白烟,则A—E共同含有甲
元素。可知:A的化学式为 ,E的化学式为 。当小心加
热A与E化合的生成物F时,可能得到一种无色无味的气体G和一种无色无味的
液体H,写出F分解生成的G+H的化学方程式 。
(2)当A与E反应生成B和C时,则A—E共同含有乙元素。此时:B为淡黄色固体,C气体易液化,常温常压下D是气体,冰水冷却D时变成无色晶体,此无色晶体的化学式是 ,在A—E各物质中,一定条件下能与D发生氧化还原反应的物质有 (填字母)。D溶于纯净的E时,能按物质的量比1:1化合,生成物的化学式可表示为 (写成化合物、复合物或氧化物均可)。
20.下图中的每一方框表示有关的一种反应物或生成物,其中A、C为无色气体
请填写下列空白:
(1)物质X可以是 ,C是 ,F是 (写分子式)
(2)写出反应①②③的化学方程式
21.现有A、B、C、D、E、X、Y和M等物质,它们均为纯净物在一定条件下,可发生下列转化,其中X、Y为常见双原子气体单质,其中X为有色气体,B为常见金属单质,质软。E为由两种常见元素(按原子个数1:1)组成的液体,A为黑色化合物,上述各步转化中只写出其中一种生成物,其它生成物没有写出(也有可能反应只有一种生成物)。
试回答:
(1)写出化学式 , X ,E ;
(2)写出离子方程:A→X ;
C→D 。
(3)A+E反应的化学方程式为: ;
22.
已知A—L所代表的物质(溶液中的溶质)都是中学化学里常见的物质。通常状况下,
A、B均是淡黄色固体,C是红棕色粉末状固体,D是气体单质,E是无色无味气体,K
是不溶于水的酸。反应①—③是化学工业生产重要产品的全部反应,反应④是工业生产
普通玻璃的反应之一。一定条件下各物质间的相互转化关系如图所示,(反应时加入或
生成水均没标出)
请填写下列空白:
(1)写出下列物质的化学式:B ;D的同素异形体 。
(2)写出化合物A的电子式 。
(3)完成下列反应方程式:
①I+G→M+L的离子方程式:
②反应④的化学方程式:
23.下列每一方框中的字母代表某物质或其溶液,其中A为常见的气态氧化物,B为
液态非金属单质,E、F为常见金属单质,I和M两溶液反应后可生成胶状白色沉淀,各
物质有如下转化关系:
试填写下列空白:
(1)B的化学式为 ,F的化学式为 ;
(2)E 和氧化物G反应的化学方程式为 ;
(3)C和D在一定条件下可反应生成A和B,其反应的化学方程式为
。
24. X、Y、Z为短周期元素的单质,X、Y的组成元素为同主族元素,U、V为它们的化合物,这些物质之间的关系如右图所示,其中反应条件和某些产物已经略去。
(1)若V是水,则:①X是 、U是
②由于U有剧毒,工业上产生的U要经过处理变
成单质Y后方能排放,以防止大
气污染。富玛克斯法治理U的方法和步骤如下:
第一步:用2%~3%的Na2CO3溶液作吸收剂生成2种酸式盐;
第二步:再加入一种RNO(液)(R表示芳香烃基)
与生成的一种酸式盐的水溶液反应生成硫、碱和RNHOH;
第三步:第二步生成的碱在溶液中与另一种酸式盐反应生成正盐;
第四步:RNHOH与空气中的氧发生反应又得到RNO。
则:第一步反应的化学方程式为
请对富玛克斯法的优点做一简要评价:
(2)若U、V均为氧化物,则:
①写出反应I的化学方程式: ;
②在计算机长距离联网使用的传输速度快、信息量大的线路,使用的材料的主要化学成
分是U,该材料的名称是: 。
③这种材料埋在地下时,如果裸露在碱性土壤中,结果会断路,用离子方程式说明原因
。
25.下图为一些常见物质的转化关系图。电解C溶液的反应是无机化工生产中的一种重要反应,Q、M为常见单质;F、L是含有同一种元素的化合物,该元素在两种化合物中的价态不同。
试回答下列问题:
(1)用化学式表示:B: D:
(2)完成下列反应的化学方程式:
①F+L=M+H2O 。
其中氧化产物与还原产物的物质的量比 。
②电解C的饱和溶液(用单线桥法表示其电子转移的方向和数目)
。
(3)写出R与NaOH溶液反应的离子方程式
。
26.(16分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中A与D及C与E分别是同主族元素,B与C为相邻元素;C、E两元素原子核内质子数之和是A、D两元素原子核内质子数之和的2倍。据此,回答下列问题。
(1)A、C两元素可形成化合物甲,其分子由四原子核构成,此分子的电子式为:
;已知甲为二元弱酸,写出甲在水中的电离方程式 。
(2)写出由A、C、E三种元素的形成的六原子核化合物乙的水溶液和甲的水溶液反应
的化学方程式 。
(3)写出一种由A、B、C三种元素形成的常见无机化合物(填化学式) ,
其溶于水后对水的电离起 作用(填“抑制”、“促进”或“不影响”),其原
因是: 。
(4)用A元素的单质和C元素的单质制成的新型化学电源已
在宇宙飞船中使用。如右图所示,两个电极均由多孔性
碳制成,通入气体由空隙中逸出,并在电极表面放电。
①a是 极,电极反应式为: 。
②b是 极,电极反应式为: 。
27.已知固体甲、E、I、F均为常见的单质,其中E在常温下为气态。G为白色胶状沉淀,既能溶解于盐酸,又能溶解于氢氧化钠溶液。A在常温下为气态,与氧气完全反应时的体积比是1:2。W是由三种处在不同短周期的元素组成的化合物,与水反应生成A和G时的化学计量数之比为1:3:3:1。各物质有如下图所示的转化关系(部分反应的产物未全部表示)。试回答下列问题:
(1)B的电子式为 ,固体乙的化学式可能是 ;
(2)上述转化中,①C→E ②D→F ③E→F ④I→F ⑤I→E ⑥A→B 其中属于置换反应的是(填序号) ;
(3)写出W和水反应的化学方程式______________________________________________,
I和NaOH溶液反应的离子方程式__ _______________________________。
28. A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如下图所示:
请回答下列问题:
(1)元素A在元素周期表中的位置为 周期 族。
(2)写出K的电子式 。 (3)写出H和D反应的化学方程式 。
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式 。
(5)写出A与G反应的化学方程式 。
(6)K与E反应时产生的现象有 ;
该反应的化学方程式为 。
29.下图中A~J分别代表相关反应中的一种物质,已知A受热分解得到相同物质的量的B、C、D(图中有部分生成物未写出)。
请填写以下空白:
(1)B的电子式为 ,D分子的空间构型为 。
(2)写出反应①、②的化学方程式:
① ;
② 。
(3)反应③的离子方程式为: 。
30.单质A、M、X有如下转化关系(反应物和生成物中的水及反应条件已略去)。
已知X、B、C、N是常见气体。
(1)X的一种同素异形体与人类的生存环境关系密切,该同素异形体的分子式为 。
(2)能否确定A、M一定是非金属单质? (填“能”、“不能”),理由是
。
(3)C、E的分子结构相似,E的电子式为 。
(4)N能使溴水褪色,反应的化学方程式为 。
请写出鉴别C和N的一种试剂 (不能用溴水)
(5)请写出下列反应的化学方程式:
①N+X—→P: 。
②A+Q—→ : 。
31.甲、乙、丙是短周期元素形成的三种常见单质,A、B、C是三种常见的化合物,A为淡黄色固体;它们之间的转化关系如图所示。
请填写下列空白:
(1)A的化学式: ;B的电子式: 。
(2)写出甲和B反应的离子方程式 。
(3)1molA和足量B反应时转移的电子为 mol。
(4)单质乙和丙在浓KOH溶液中可以制成原电池,请写出该电池的电极反应方程式:
负极 ; 正极 。
32.有人对某合金的粉末进行如下实验分析:
(1)由此可知,该合金的组成元素中金属至少有 种
(2)写出B2变D2的离子方程式
(3)对固体C3的实验设计不合理,为了得到准确的结论,改进实验的方法是
33.(7分)X、Y、A、B、C、D是中学化学教材中常见的物质,且有如下转化关系。气体
C的式量比气体X的式量大2,产物中水已忽略。
回答下列问题:
(1)X分子的电子式是 。
(2)在上述转化过程中作还原剂的物质有(填物质的化学式) ;
(3)A与浓HNO3反应的化学方程式为 ;
(4)测定气体C的相对分子质量,测得的数值与气体的相对分子质量有差异的原因是(用
化学方程式表示) 。
34.已知X是一种复盐,C、D、E、H均为气体,F为白色不溶于水的物质;反应①是工业生产中的重要反应,反应④⑥⑦是实验室重要的物质检验反应,这些物质有如下图所示的转化关系(生成物中的水均已略去)。
试回答:
(1)写出下列物质的化学式K ,H ;
(2)向J的溶液中滴加2滴KSCN溶液,可观察到 ;若将一定量J的饱和溶液滴入到沸水中,反应后液体的颜色变为 ,其反应的离子方程式为: ;若再向该反应后的液体中逐滴滴入稀硫酸,直至过量,整个滴加过程中所观察到的现象是
。
(3)已知X与足量的B反应生成的E和F的物质的量之比为2:1,则X的化学式(不考虑结晶水)为: ;
(4)写出下列反应的离子方程式:
反应② ;
反应③ ;
反应⑤ 。
35.图中A~K都是中学化学中常见物质。A是一种酸,E、F、I通常状况下是气体,其中E有刺激性气味,X、Y是常见的金属单质,J为红褐色沉淀。参加反应的水以及生成的水在图中均已略去。
请回答下列问题:
(1)E的电子式为 ,J的化学式为 。
(2)写出K溶液与Y反应的离子方程式 。
(3)写出D溶液与X反应的离子方程式 。
(4)写出A+B→C+E的化学方程式 。
(5)如果n(A): n(B)为6:1,则B可能的化学式为 。
36. A.B.C.D.E是中学化学常见单质,构成它们的元素的原子序数分别为α、B. C.D.е;且3 (a+b) = 2 (a+c) = 3 (d-a);X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(图中反应物和产物中的H2O已略去):
(1)Y的电子式为 ,构成D单质的元素在周期表中位于 周期 族
(2)反应③的离子方程式为
E的氧化物与D在一定条件下反应的化学方程式为:
(3)固体N常温下即挥发,183℃升华,几乎溶于所有的有机溶剂和H2O中,据此判断
N为 型晶体。
(4)25℃时,PH=5的W和N的水溶液中由H2O电离出来的H+离子浓度之比为
37.已知A是一种由短周期元素组成的盐,H是引起温室效应的主要气体之一,Y是一种常见液体,E的相对分子质量比D大16,L、K均为白色沉淀,且K光照后无变化。它们存在如下转化关系(反应条件及部分产物已略去):
请回答下列问题:
⑴A的化学式是___________,Y的电子式是______ ____。
⑵反应①的化学方程式是_________________ ___________。
⑶反应②的离子方程式是_________________ ___________。
⑷将L加热后得到的固体物质在熔融条件下电解的化学方程式是________________ _。
38. A、B、C、D、均为中学化学常见的物质,它们间的反应关系如下图所示。
(1)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则B的化学式 。
有关反应的化学方程式为 。
(2)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液。
①A是NaHCO3时,该反应的离子方程式为:
。
②A是一种淡黄色固体,且A与B以物质的量之比为2:1相混合时,推知B的化学式为 。
(3)若A是碳化钙(CaC2),A与B的溶液反应时只生成气体C、CaCO3和水;C的燃烧热为1300kJ·mol-1,则B的化学式为 ;C燃烧的热化学方程式为 。
39.已知化合物A~M均为中学化学常见物质,它们之间存在如下图所示的转化关系。A、B、F、L均可形成原子晶体,其中B、F为非金属单质,D为金属单质,其余均为化合物;E、H、K均属于汽车尾气中的大气污染物,其中H是一种红棕色气体;I常温时为无色液体;A、F、L含有同种元素; A与B在高温下能发生反应,当B的用量不同时,反应物与生成物种类有如下图所示的转化关系①和②;C的稀溶液跟D发生反应时,也会因为D的用量不同,发生如下图所示的④、⑤反应,而生成不同的产物。
根据以上信息,完成下列填空:
(1)写出C、E、H的化学式C 、E 、H ;
(2)反应②中,氧化剂和还原剂的质量比为 ;
(3)B、F、L形成的原子晶体的熔点由高到低的顺序为(用化学式表示):
。
(4)从A~F中选择合适的物质,用离子方程式完成J和M的相互转化:
; 。
40.已知下列反应的框图中,B、E、F、I分别代表一种单质,A、C、D是氧化物,H、G是盐类,水作为反应物或产物时均略去不写,据图分析回答问题。
(1)B单质是 。
(2)说出反应②和③的实际应用的例子:②可应用于 ;③可应用于 ;
(3)写出反应③的化学方程式: ;
写出反应④的离子方程式: ;
写出反应⑤的离子方程式: 。
41.下图转化关系中的物质均为中学化学学过的物质。已知:A的焰色以应呈黄色;G是一种白色物质,微溶液于水;常温下,D、F均为气态单质,H、I为气态化合物;M是一种合成树脂,常用于制备塑料和合成纤维。
根据上述物质间的转化关系,填写下列空白:
(1)F的分子式为 ,H的电子式为 。
(2)反应①的离子方程式为 。
(3)反应⑤的化学方程式为 。
(4)向J、K的混合物中加入足量I的浓溶液,可得到F气体。反应的离子方程式为:
。
(5)实验室由C制得的气体H常有特殊难闻的臭味,可能的原因是
。
42.(14分)
物质A~J相互关系如下图,其中A为酸式盐,B为某二价主族金属元素的化合物,等物质的量的A、B与适量水充分混合恰好完全反应。常温常压下C、D、F、I均为气态,且I能使澄清石灰水变浑浊。反应④是工业上生产化合物J的重要方法,G是一种中学化学中常见的强酸。
(1)C的电子式是 ,E的化学式是 ,G的化学式是 。
(2)写出下列两物质反应的化学方程式:
B+H2O: ;
C+O2: 。
(3)A的溶液与过量NaOH溶液共热,发生反应的离子方程式为
。
43.下列图17所示反应有直接进行的,也有在溶液中进行的,其中部分产物已略去。
已知:A是固体单质;B、X、H为气体单质;D属于可溶于水的强电解质,一个D分子中含有18个电子。
(1)化学式:B为 ,F为 。
(2)用电子式表示D的形成过程为 。
(3)A是一种非常重要的工业产品。据统计,地球上每年由于腐蚀而消耗的A约占A年产量的10%。A发生腐蚀的主要原因是(填写下面的选项序号) ;
a.直接与氧气发生化学腐蚀
b.通过原电池反应发生腐蚀
c.因溶于水而消耗掉
若你选定选项a或c,请写出相应的化学方程式;若你选定选项b,请写出负极的电极反应式:
。
(4)已知H的密度比空气的密度大,则①中所涉及的反应的化学方程式为
,
。
(5)写出F与足量Y反应生成J的理由:
。
44. A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):
(1)若A是一种淡黄色单质固体,则B→C的化学方程式为 。
(2)若A是一种金属,C是淡黄色固体,则B的电子式为 。C物质与水反应的化学方程式为 。
(3)若C是红棕色气体,则A的化学式可能为 。
(4)若A、B、C均为单官能团有机物,则B中含有的官能团是 。
45.已知B是常见金属单质,E为常见非金属单质,H常温下为无色液体,C的浓溶液在加热时才与D反应。根据下列框图所示,试回答:
(1)L的化学式:__________F的电子式:__________
(2)反应①的离子方程式:______________________________
(3)反应②,工业上采取的反应条件:__________
(4)每生成lmolK,反应放出98.3kJ热,该反应的热化学方程式为:
____________________________________________________________
46.下图是中学化学常见的某些无机物相互转化的关系,图中Z是淡黄色固体,W是一种常见金属单质,D是红棕色固体。试剂X、A溶液、B溶液都是是单一物质的溶液,向它们的溶液中加入用硝酸酸化的硝酸银溶液,均产生白色沉淀。
请填写下列空白
①溶液M中溶质的主要成分是 (填分子式)
②B→D的化学方程式
③B→A的化学方程式
④黑色固体溶于X的离子方程式
⑤D→Y的化学方程式
⑥E的某种同素异形体近年来倍受关注,其分子式是 。
47.江苏省东临大海,利用海水等可制得多种化工产品。下图是以海水、贝壳等为原料制取几种化工产品的转化关系图,其中E是一种化肥,N是一种常见的金属单质。
试填写下列空白:
(1)N的化学式为: ;
(2)出反应①的化学方程式: ;
(3)由K溶液经如何处理才能制得N?
。
48.化合物A、B、C、D、E、F是中学化学的常见物质。这些化合物之间存在下图的关系。其中A和B的反应是一种重要的化工生产中的主要反应。
(1)在A、C、F中含有相同的元素是 。(填元素符号)
(2)化合物C可溶于水,其化学式为 ,水溶液呈 性,因为(用化学方程式或离子方程式表示) 。
(3)C的水溶液和D能否反应 ,其原因是 。
(4)该化工工业称为 。
49. A为两种固体化合物的混合物,以A为固体原料,可在实验室制备气体X,并模拟其工业制备过程。如图11所示,反应I和反应II均可生成气体X。
(1)混合物A的组成是 。
(2)工业制备X的反应为 (填I和II),其反应条件为 ,同时得到另一种气体产物的名称为 。
(3)写出实验室制备X反应的离子方程式 。
(4)工业生产X时,目前比较先进的设备为 ,
从安全方面考虑它可防止 。
50.已知物质转化关系如图18所示:
①若A为第三周期金属元素的单质,不与NaOH溶液反应;B为黑色固态的非金属单质。则反应的化学方程式为
②若A为第三周期金属元素的单质,X是红棕色粉末,化合物Y可溶于NaOH溶液。则每生成1mol B,反应中转移电子的数目为 mol;
③若X在常温下是无色液体,Y是具有磁性的黑色晶体,B是气态非金属单质。则A元素在周期表中的位置为 周期 族。该反应的化学方程式为 。
51.
在下图所示的转化关系中,A、B、C是中学化学中常见的物质,都含有同一种元素R,且所含元素均在短周期。回答下列问题。(说明:图中不含R的产物均已略去,反应②的产物之一是A)
(1)若A为气体单质,则A为__________________________。
(2)若A为两性无机化合物,由A转化为B和C的离子方程式为____________________。
(3)若A是由非金属元素组成的盐,则由A转化成B(或B、C)的离子方程式为________
___________________________________。
(4)若A为酸性氧化物,A与NaOH溶液反应有三种情况(只生成B、只生成C、同时生成B和C),则A为__________________________。
(5)若A可由家庭生活中两种常见的有机物合成,则A转化成B和C的化学方程式为_____________________ __________________。
52.由白色和黑色固体组成的混合物A,可以发生如下框图所示的一系列变化:
(1)写出反应③的化学方程式:__________________________________ __。
反应④的离子方程式:________________________________________________。
(2)操作②中的名称是________,在操作②中所使用的玻璃仪器的名称是____________。
(3)下列实验装置中可用于实验室制取气体G的发生装置是____________;为了得到纯
净干燥的气体G,可将气体通过c和d装置,c装置中存放的试剂是____________,
d装置中存放的试剂是____________。
(4)气体G有毒,为了防止污染环境,必须将尾气进行处理,请写出实验室利用烧碱溶液吸收气体G的离子方程式:____________________________________;下列e~i装置中,通常用来吸收气体G的装置是____________。
(5)J是一种极易溶于水的气体,为了防止倒吸,下列e~i装置中,可用于吸收J的是____________________________________。
53.甲、乙、丙是由短周期元素形成的三种常见单质,A、B、C是三种常见的化合物,其中B在常温下呈液态,各物间的转化关系如图:
请回答下列问题:
(1)A的化学式为: B的电子式为:
(2)写出甲和B反应的离子方程式
(3)1molA与足量B反应时转移的电子为 mol
(4)单质乙和丙被应用于燃料电池中,如图所示,两个电极均由
多孔性碳构成,通入的两种单质由孔隙逸出并在电极表面放
电。则a是电池的 极,b电极上的电极反应式为
。
54.根据下列框图关系填空。已知反应①、③是工业生产中的重要反应,D、E常温下为气体、X常温下为五色液体,H与E相对分子质量之间的关系为:Mr(H)-Mr(E)=34,又知C的焰色反应呈黄色。
(1)化合物B中所包含的化学键有___________________
(2)反应④的离子方程式:________________________________
反应⑤的化学方程式:________________________________
(3)已知每生成16gE,放出106.5kJ热量,则反应①的热化学方程式为:
______________________________________
55.在下列物质间的转化关系中,反应③为电解,每个框中的字母只代表一种物质。
试回答:
(1)A的化学式_____________________.
(2)反应①的化学反应式________________________,_____________________________;
简述能生成A物质的原因____________________________________.
(3)反应②的化学反应式____________________________________,反应的现象是______________________________________.
(4)反应③中加入NaOH溶液的原因是____________________________________.
2006年理综复习模拟无机框图推断试题(50题)答案
1.答案:(1)(NH4)2S
(2)H2SO4(3)HNO3
(4)H2S+Cl2=2HCl+S↓, 8NH3+3Cl2=N2+6NH4Cl
2.答案:①NaCl;②H2S,高温、催化剂;③CH3CH2OH
3. (2)①4KCl+MnO2+2H2SO4(浓)====Cl2↑+MnCl2+2K2SO4
②2KCl+H2SO4(浓)====2HCl↑+K2SO4
4.答案:(1) Na+[::]2-Na+, SO3
(2)2Na2O2+2H2O=4NaOH+O2;2Na2SO3+O2=2Na2SO4
5.
答案:(1) , ::C::, Na+[:::]2-Na+
(2)HSO4-= H++SO42-, CO32-+H2O=HCO3-+OH-
(3) ①2H++CO32-= CO2↑+H2O;
②2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
6. 答案:(1)NaHCO3,CaCO3
(2)2Mg+CO2======2MgO+C
7.答案:(1)H2
(2)H:CC:H;2HC≡CH+5O2 =2CO2+2H2O(3)C+H2O——→CO+H2;CuO
8.答案:(1)Al Al(OH)3 Fe2+
(2)2A1+2OH—+2H2O=2AlO2—+3H2 ↑ 2Al2O3===4A1+3O2↑
2Al+Fe2O3====2Fe+Al2O3 4Fe(OH)2+O2+H2O==4Fe(OH)3
9.答案:(1)Fe Fe3O4
(2)Fe3O4+4H2SO4= Fe2(SO4)3+FeSO4+4H2O
4Fe(OH)2+O2+H2O==4Fe(OH)3↓
(3) H2O Al2O3
10.答案:(1) Al2O3
(2) (NH4)2SO4和K2SO4
(3) AlO2—+CO2+2H2O=Al(OH)3↓+HCO3—
11.答案:(1)A1 O2
(2) Al2O3+2NaOH=2NaAO2+H2O
(3) AlO2—+CO2+2H2O=Al(OH)3↓+HCO3—
或2AlO2—+CO2+2H2O=2Al(OH)3↓+CO32—
一种单质跟NaOH溶液反应生成一种化合物和氢气,还可联想到Si,如果单质A是Si,则化合物乙是Na2SiO3,化合物丁是H2SiO3,化合物甲是SiO2,从而反推出单质B是O2故本题还可能是另一组答案。
(1)Si O2
(2)Si+2NaOH+H2O =Na2SiO3+2H2↑
(3) SiO32—+CO2+H2O=H2SiO3↓+CO32— (CO2过量生成HCO3—)
12.答案:
13.答案:(1)A是(NH4)2S Y是O2 Z是H2O
(2)E是HNO3 E是H2SO4
(3)NH4++OH-=NH3·H2O或NH4++OH-NH3↑+H2O
S2-+2H+=H2S↑
14.答案:(1)X: NH4HCO3或(NH4)2CO3; B:H2O; F:NO2; G:HNO3。
(2)A→D:2CO2+2Na2O2=2Na2CO3+O2
G→E:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
15.答案:
16.答案:(1)Fe;Cl2;H2
(2)4Fe(OH)2+O2+2H2O===4Fe(OH)3
(3)2Fe2++Cl2===2Fe3++2Cl-
17.答案:(1)A:Na2SO3 B:BaCl2
(2)①:2Cl-+2H2O2OH—+H2↑+Cl2↑
②:BaSO3+C12+H2O=BaSO4↓+2H++2Cl—
③:SO2+C12+2H2O=4H++2C1—+SO42—
18.答案:NH4HCO3或(NH4)2CO3 NH3 O2
4HNO3+C==CO2↑+4NO2↑+2H2O
19.(6分,每空1分)(1)NH3,HNO3; NH4NO3 N2O+2H2O
(2)SO3;AB;H 2S2O7或H2SO4·SO3或2SO3·H2O
20.(12分)
(1)NH4HCO3或(NH4)2CO3 NH3 NO2(写分子式)
(2)①2CO2+2Na2O2=2Na2CO3+O2
②4NH3+5O2 4NO+6H2O
③3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O
21.⑴ X Cl2 (2分)Y H2O2 (2分)
⑵ MnO2 + 4H++ 2Cl- Mn2++Cl2↑+2H2O(2分)
Al2O3 +6H+=2Al3++3H2O(2分) ⑶ 2H2O2 2 H2O +O2↑(2分)
23.(7分)
(1)FeS2(1分) O3 (1分)
(2)Na+[ ]2-Na+ (1分)
(3)①2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ …………………………(2分)
②Na2CO3+SiO2 Na2SiO3+CO2↑ …………………………(2分)
24.(1)(4分)Br2,Fe;(2)(2分)2Al+Fe2O3 2Fe+Al2O3;
(3)(2分)H2SO4(浓)+2HBr Br2+SO2↑+2H2O
25.(本题共14分)(1)①X是:O2、U是:H2S (每空1分)
②Na2CO3+H2S=NaHCO3+NaHS(2分) 总反应为:2H2S+O2 2H2O+2S↓;(2分)
RNO反应前后不变,起到催化剂的作用,是一条绝色工艺流程。(2分)
(2)①SiO2+2C Si+2CO(2分) ②光导纤维(2分)
③SiO2+2OH-=SiO+H2O(2分)
26.(1)FeCl2 FeS (2)①SO2+2H2S 3S↓+2H2O 2: 1
②2NaCl+2H2O 2NaOH+H2↑+Cl2↑ 单线桥略
(3)Al2O3+2OH— 2AlO2—+H2O
27.(16分)(1)H: O: O:H (2分) H2O2 H++HO2— HO2— H++O22— (2分,写出第一步即可得分;若写成H2O2 2H++O22—不给分)
(2)H2O2+H2SO3 H2SO4+H2O(2分)(3)HNO3(或NH3·H2O或NH4NO3)(1分)
抑制(1分) 硝酸电离产生H+,抑制水的电离(2分) (或抑制NH3·H2O电离产生OH—,抑制水的电离。或促进NH4NO3在水中完全电离出的NH4+与水电离出的OH—结合成NH3·H2O,促进了水的电离。) (4)①负(1分)2H2-4e—+4OH— 4H2O(2分) (或H2-2e—+2OH— 2H2O或H2-2e— 2H+,均给分)②正(1分)
O2+4e—+2H2O 4OH—(2分)
28.(1) Fe2O3 (2) ①③④
3) Al(CH3)3 + 3H2O = 3CH4 ↑+ Al(OH)3 ↓ 2Al + 2OH- + 2H2O = 2AlO2- + 3H2 ↑
29.(1)四;VIII (2):O::C::O: (3)3Fe3O4+8Al 4Al2O3+9Fe
(4)2Al+2OH-+2H2O=2AlO2-+3H2↑ (5)3Fe+4H2O(g) Fe3O44H2↑
(6)镁带剧烈燃烧,放出耀眼的光,瓶壁出现白色固体和黑色颗粒:
2Mg+CO2 2MgO+C (每空1分,共8分)
30.(每空2分,共10分)(1) 三角锥形
(2)2Mg+CO2 2MgO+C; 4NH3+5O2 4NO+6H2O
(3)NH4++HCO3-+2OH-+2OH NH3↑+CO+2H2O
31.(共16分)
(1)O3(2分) (2)能(2分),它们与O2反应生成的化合物B、N为气体(2分)
(3) (2分)
(4)Br2+SO2+2H2O=2HBr+H2SO4(2分);品红溶液或酸性高锰酸钾溶液(2分,写对一
种即可)
(5)①2SO2+O2 2SO3(2分)
②C+2H2SO4(浓) CO2↑+2SO2↑+2H2O(2分)
32.(15分)(1)Na2O2(2分) H :O: H(2分)
(2)2Na+2H2O====2Na++2OH-+H2↑(3分)
(3)1(2分)
(4)负极:2H2—4e-+4OH-====4H2O(3分)
正极:O2+4e-+2H2O===4OH-(3分)
33.(8分)(1)3种, (2)Al3++3NH3·H2O=Al(OH)3↓+3NH4+ (3)先加足量的稀硝酸充分反应后,溶液变蓝;再向黑色固体中加入足量的浓硝酸,生成的气体水先后通入饱和石灰水中,产生白色浑浊。
34.(7分)
(1): O : : C : : O :(1分) (2)Mg C(2分)
(3)C+4HNO3(浓) CO2↑+4NO2↑+2H2O(2分)
(4)2NO2 N2O4(2分)
35.(16分)
(1)Fe(OH)3;HCl(每空1分)
(2)溶液变为红色(1分);红褐色(1分),Fe3++3H2O 沸水 Fe(OH)3(胶体)+3H+(2分);
先有红褐色沉淀生成,后沉淀逐渐溶解,得到棕黄色溶液(2分)。
(3)(NH4)2Fe(SO4)2(2分)。
(4)每个离子方程式均为2分,写化学方程式每个扣1分
②2NH4++Fe2++4OH-微热2NH3↑+Fe(OH)2↓+2H2O
③Cl2+2OH-=Cl-+ClO-+H2O
⑤2Fe2++Cl2=2Fe3++2Cl-
36.(1) (2分) Fe(OH)3 (2分)
(2)Fe+2Fe3+=3Fe2+ (3分)
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑ (3分)
(4)2HCl+NaClO=NaCl+Cl2↑+H2O (3分)
(5)NaClO3 (2分)
37、(17分)⑴ (2分) 三 (1分) ⅢA(1分)
⑵ Al3++3AlO2-+6H2O = 4Al(OH)3↓ (3分)
Fe2O3+2Al ==== 2Fe + Al2O3 (3分)(Fe2O3若写成FeO或Fe3O4并配平也可以)
⑶ 分子 (3分) ⑷ 1∶104 (4分)
38.(10分)(1)NH4Al(SO4)2 (4分,各2分)
(2)4NH3+5O2 4NO+6H2O(2分)
(3)Al3++3AlO2-+6H2O 4Al(OH)3↓(2分) (4)2Al2O3 4Al+3O2↑
39.(15分)
(1)(NH4)SO4 (2分)
(NH4)2SO 4 +Ba(OH)2=BaSO4↓+2NH3↑+2H2O (3分)
(2)①Al3++3HCO3-====Al(OH)3↓+3CO2↑ (3分)
②Al2(SO4)3 (2分)
(3)Ca(HCO3)2 (2分)
2C2H2(g)+5O2(g)====4CO2+2H2O(1) △H=-2600kJ·mol-1 (3分)
40.(8分) (1)HNO3、CO、NO2 (2)1:2 (3)C>SiC>Si
(4) 3Fe2++4H++NO3- = 3Fe3++2H2O+NO或2Fe3++Fe=3Fe2+
41.(1)Al(2)某些金属冶炼或某些场合焊接钢轨或定向爆破时熔断钢筋。(说明:只要答出任意一点或其它合理答案均给2分) 潜艇中(太空舱中或高原等条件下)的供氧(3)2NaO2+2CO2=2Na2CO3+O2 Al2O3+2OH—=2AlO2-+H2O
2AlO2—+3H2O+CO2=2Al(OH)3↓+CO32-
42.(16分)(1)Cl2; H : C C : H(各2分共4分)
(2)2Cl-+2H2O Cl2↑+H2↑+2OH-
(3)nCH2=CH [ CH2—CH ]n
(4)ClO-+Cl-+2H+=Cl2↑+H2O
(5)气体H中混有PH3、H2S等杂质(或C中含有的硫
化物、磷化物等杂质与水反应生成PH3、H2S,混入
气体H中)
43.(14分)
(1)(7分) (3分),CaCO3(2分),HNO3(2分)
(2)(4分。每空2分)CaC2+2H2O→Ca(OH)2+C2H2↑
4NH3+5O2 4NO+6H2O
(3)(3分)NH4++HCO3-+2OH- ====CO+NH3↑+2H2O
44.(共16分,每空2分)
(1)H2;FeCl2……各2分
(3)b;Fe-2e-=Fe2+……各2分
(4)2Na2O2+2H2O=4NaOH+O2↑……2分
FeCl3+3NaOH=Fe(OH)3↓+3NaCl……2分
(5)Na2O2具有氧化性,且与水反应生成碱,故Fe2+在此条件下可被氧化生成Fe(OH)3…2
45.(1)2SO2+O2 2SO3(2分)
(2)Na+[:O:]2-Na+ 2Na2O2+2H2O=4NaOH+O2↑ (各3分,共6分)
(3)N2或NH3(2分)(写出一个即可,其它合理答案参照给分)
O
(4)—C—H或—CHO,或醛基(2分)
46(10分,每格2分)
(1)Cu(OH)2;过氧化钠电子式(略)
(2)2Cu2++2H2O 2Cu↓+O2↑+4H+
(3)常压 催化剂,400-5000C (答催化剂,加热也可)
(4)SO2 (g)+1/2O2 SO3(g);=-98.3kJ/mol
47.(14分)①Cl2(2分)
②FeCl3+3H2O Fe(OH)3+3HCl; 2Fe(OH)3 Fe2O3+3H2O(3分)
③2FeCl3+Fe 3FeCl2(2分)
④Fe3O4+8H+ 2Fe3++Fe2++4H2O(3分)
⑤2Al+Fe2O3 Al2O3+2Fe(2分)
⑥O3(2分)
48.⑴Mg(2分); ⑵NaCl(饱和)+NH3+CO2+H2O==NaHCO3↓+NH4Cl(4分);
⑶MgCl2溶液必须在氯化氢气体中进行蒸发结晶制得MgCl2晶体,熔融后电解才能制取金属镁(4分)。
49.(14分)(1)Na (2)Na2SiO3 碱性 SiO32- + 2H2O H2SiO3 + 2OH-
(3)能反应,H2CO3的酸性强于H2SiO3,可以由强酸制得弱酸(4)硅酸盐工业
(每空2分)
50.(1)KClO3和MnO2 或KClO3和KMnO4(2分)
(2)II(2分) 通电(或电解)(2分) 氢气(2分)
(3)MnO2 +2Cl-+4H+=Mn2++Cl2↑+2H2O (2分)
(4)离子交换膜电解槽(2分) 阴阳两极产生的H2和Cl2混合爆炸(2分)
51.①2Mg+CO2 2MgO+C ……………………2分
②3 ……………………2分
③四;Ⅷ;3Fe+4H2O Fe3O4+4H2
52. (15分)
(1) (3分) (2) (3分)
(3) (3分)
(4) (3分)
(5)
(3分)
53.(16分)(1)Na2O3(3分) H : O : H(3分)
(2)2Na+2H2O 2Na++2OH-+H2↑(3分)
(3)1(2分)
(4)正(2分),4OH-+2H2-4e- 4H2O(3分)
54、(每空3分)(1)离子键、非极性键(或共价键)
(2)Fe203+6H+=2Fe3++3H20, Fe2(S04)3+6NaOH =2Fe(OH)3↓+3Na2S04
(3)FeS2(s)+ 02=Fe2O3 (s) +2SO2(g); △H=-852kJ/mol
(未注明状态扣1分,写成FeS给2分)
55、(12分)(1)Mg(OH)2(2分)
(2)Mg(HCO3)2 MgCO3 + CO2 + H2O (1分) MgCO3 + H2O Mg(OH)2 + CO2 (1分)Mg(OH)2 比 MgCO3 更难溶(2分)
(3)Mg + CO2 MgO + C (2分) 发出耀眼的白光(1分) 有黑色颗粒和白色粉末生成(2分)
(4)增强水的导电性(1分)
通电
高温
A
B
C
E
+
I
M
+NaOH
C
+
D
F
+
J
H
G
+
F
+
B
+
H2O
E
气体F
气体L
B溶液
R
单质Q
单质M
红褐色沉淀
D
A溶液
B溶液
C溶液
黑 色
沉淀D
等物质的量混合
+O2
高温
稀盐酸
NaClO溶液
Al粉
高温
△
E
B
A
B
C
D
M
N
P
Q
N
C
X
X
Q
X
X
△
X
电解
Y
A
C
A
Z
W
D
②
K
D
H
A
N
E
E
C
M
③
①
E
E+F
G+H+I
J+K+I
E+L
I+K+M
A
B
C
D
①
②
③
④
⑤
A
B
+
C
D
+
高温
H2O + D + F
E + F
盐酸
盐酸
气体C
ycy
△
点燃
点燃
通电
高温
OH—
空气
催化剂
△
△
MnO2
高温
RNO
高温
高温
点燃
催化剂
加热
点燃
△
催化剂
高温或△
△
△
:
:
Na+[ :O: H ]-
高温
催化剂
△
电解
电解
一定条件
(各3分)
Cl
Cl
催化剂
△
△
. .
. .
△
△
高温
高温
Page 1
无机框图推断试题
1.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,B跟Cl2反应除生成C外,另一产物是盐酸盐。
用化学式号填写下列空格:
(1)A是__________。
(2)当X是强酸时,A、B、C、D、E、F均含同一种元素,F是__________。
(3)当X是强碱时,A、B、C、D、E、F均含同一种元素,F是__________。
(4)B跟Cl2反应的化学方程式是________________________________________。
2.如图,各物质有下列转化关系:
请回答以下问题:
①若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是_______________。
②若B为常见金属或非金属单质,E是酸酐,且为易挥发的晶体,则A是_______________;D转化为E的一定条件是_______________。
③若C是水,B是有机化合物,且是同系物中相对分子质量最小的物质,E能使紫色石蕊试液变红色。则A是_______________。
3.下列物质间在一定条件下可实现图中所示的一系列变化。其中固体W的焰色反应呈紫色,A是一切生物都不能缺少的气体。
请回答:
(1)判断X、Y各是什么物质 X__________Y__________。
(2)写出有关反应的化学方程式:
①Z+H2SO4 (浓)→C
②W+H2SO4 (浓)→D+T
4.已知甲、乙、丙为常见单质,A、B、C、D、E、F、G、X均为常见的化合物;B和X的摩尔质量相同,E的相对分子质量比D的相对分子质量大16,在一定条件下,各物质相互转化关系如下图所示:
(1)写出X的电子式和G的化学式:X__________,G__________;
(2)写出有关变化的化学方程式:
B+H2O:______________________________;
D+丙:______________________________。
5.有A、B、C三种常见的短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:
请回答:
(1)写出C元素的原子结构示意图__________,写出丁和戊的电子式__________、__________;
(2)用有关化学用语解释:乙溶液呈酸性的原因______________________________;
丙溶液呈碱性的原因_____________________________;
(3)写出有关反应的离子方程式:
①乙溶液+丙溶液→丁______________________________;
②己溶液+丙溶液→丁______________________________。
6.A~J是中学化学教材中常见的物质,A~J有如下转化关系,J是不溶于水的白色固体,且其相对分子质量为100。
则(1)A的化学式是__________,J的化学式是__________。
B和E反应的化学方程式是______________________________。
7.气体A只含X、Y两种短期元素,X的原子序数大于Y的原子序数。B、D、E是中学化学中常见的气体。各物质有如下图所示的转化关系。
回答下列问题:
(1)若气体A是混合气体,X与Y的质量比小于3,则气体A中肯定有(写化学式) __________;
(2)若气体A为单一气体,且分子是直线型结构。又知X与Y两元素的质量比数值上等于X的相对原子质量。A分子的电子式为__________,A燃烧的化学方程式为______________________________;
(3)C与固体单质甲在高温下发生反应的化学方程式为______________________________。固体乙为常见化合物,写出一种固体乙的化学式__________。
8.图中①~⑩分别代表有关反应中的一种物质,它们均是中学化学中常见物质。已知①~③和⑥~⑩中分别含有同一种元素。
(1)分别写出①、④、⑧的化学式或离子符号:
①_________,④_________,⑧_________。
(2)写出下列反应方程式,是离子反应的写出离子方程式:
①+OH—→________________________________
⑤-→________________________________
①+⑥—→________________________________
⑨+空气→________________________________
9.单质A在适宜条件下有如图所示的一系列转化,其中F是一种红褐色物质。试解答下列各题:
(1)写出下列物质的化学式:A ,B 。
(2)用化学方程式表示下列转化过程
B+H2SO4→C+D:___________________________。
I露置在空气中转化为F:___________________________。
(3)G可能是_________或_________;每生成1molE同时生成与其对应H的物质的量是 _________ mol或_________mol。
10.某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现图所示的物质之间的变化:
据此判断:
(1)固体B所含物质的化学式为______________。
(2)固体E所含物质的化学式为______________。
(3)反应①的离子方程式为______________。
11.以下各单质和化合物之间存在下列转化关系(各单质和化合物中所含元素均为短周期元素):
(1)试确定单质A和B的化学式:A________,B________。
(2)写出化合物甲与NaOH溶液反应的化学方程式________________________________。
(3)写出化合物乙转化为化合物丁的离子方程式________________________________。
12.硫酸钡是惟一无毒的钡盐,工业上以BaSO4等为原料通入图所示流程反应可以制备锌钡白和过氧化氢:
(1)上述流程中共有7个化学反应,其中有__________个属于氧化还原反应。
(2)写出过氧化氢的电子式:__________;写出物质H的电子式:__________。
(3)写出下列化学反应方程式:
反应①:____________________;
反应③:____________________;
反应④:____________________;
反应⑦:____________________。
13.下列关系图中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸。当X无论是强酸还是强碱时,都有如下转化关系:
当X是强酸时,A、B、C、D、E均含有同一元素:当X是强碱时,A、B、C、D、E均含有另一种元素。回答下列问题:
A是_______________,Y是______________,Z是_____________。
当X是强碱时,E是 _______________,当X是强酸,E是____________。
写出A与X反应的离子方程式:
①_______________________________________________;
②_______________________________________________。
14.下图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。
(1)写出下列各物质的名称或化学式:
X: ;B: ;F: ;G: 。
(2)写出下列变化的反应方程式:
A→D: ;G→E: 。
15.
(3)溶液I中所含的金属离子是 。单质B加强碱溶液生成单质F和溶液K的离子反应方程式是 。
(4)由C→E+F弱改用浓酸,则不能选用的浓酸是 。
16.室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下面框图进行反应,又知E溶液是无色的,请回答:
(1)A是 ,B是 ,C是 (填化学式)
(2)反应⑥的化学方程式为: 。
(3)反应④的离子方程式为: 。
17.下图是中学化学中常见的物质间化学反应关系的图示,其中A的焰色反应呈黄色,E、F为有刺激性气味的气体,G为强酸性溶液,H为既难溶于水、也难溶于稀酸的白色固体。
试回答:
(1)写出化学式:A_______________;B_______________。
(2)写出下列反应的离子方程式:
①C→E:______________________________;
②D→H:______________________________;
③E+F+H2O→G:______________________________。
18.下图①一⑩分别代表有关反应中的一种物质,请填写以下空白。①、③、④的化学式分别是:_________,_________,_________。
⑧与⑨反应的化学方程式是:__________________。
19.已知下列转化关系中的中学化学常见物质A、B、C、D、E中均含有同一种元素,
A、C均为气体,E为液体,下图中箭头上的反应物和反应条件均已略去。
(1)当A与E发生化合反应时,能观察到空气中形成大量的白烟,则A—E共同含有甲
元素。可知:A的化学式为 ,E的化学式为 。当小心加
热A与E化合的生成物F时,可能得到一种无色无味的气体G和一种无色无味的
液体H,写出F分解生成的G+H的化学方程式 。
(2)当A与E反应生成B和C时,则A—E共同含有乙元素。此时:B为淡黄色固体,C气体易液化,常温常压下D是气体,冰水冷却D时变成无色晶体,此无色晶体的化学式是 ,在A—E各物质中,一定条件下能与D发生氧化还原反应的物质有 (填字母)。D溶于纯净的E时,能按物质的量比1:1化合,生成物的化学式可表示为 (写成化合物、复合物或氧化物均可)。
20.下图中的每一方框表示有关的一种反应物或生成物,其中A、C为无色气体
请填写下列空白:
(1)物质X可以是 ,C是 ,F是 (写分子式)
(2)写出反应①②③的化学方程式
21.现有A、B、C、D、E、X、Y和M等物质,它们均为纯净物在一定条件下,可发生下列转化,其中X、Y为常见双原子气体单质,其中X为有色气体,B为常见金属单质,质软。E为由两种常见元素(按原子个数1:1)组成的液体,A为黑色化合物,上述各步转化中只写出其中一种生成物,其它生成物没有写出(也有可能反应只有一种生成物)。
试回答:
(1)写出化学式 , X ,E ;
(2)写出离子方程:A→X ;
C→D 。
(3)A+E反应的化学方程式为: ;
22.
已知A—L所代表的物质(溶液中的溶质)都是中学化学里常见的物质。通常状况下,
A、B均是淡黄色固体,C是红棕色粉末状固体,D是气体单质,E是无色无味气体,K
是不溶于水的酸。反应①—③是化学工业生产重要产品的全部反应,反应④是工业生产
普通玻璃的反应之一。一定条件下各物质间的相互转化关系如图所示,(反应时加入或
生成水均没标出)
请填写下列空白:
(1)写出下列物质的化学式:B ;D的同素异形体 。
(2)写出化合物A的电子式 。
(3)完成下列反应方程式:
①I+G→M+L的离子方程式:
②反应④的化学方程式:
23.下列每一方框中的字母代表某物质或其溶液,其中A为常见的气态氧化物,B为
液态非金属单质,E、F为常见金属单质,I和M两溶液反应后可生成胶状白色沉淀,各
物质有如下转化关系:
试填写下列空白:
(1)B的化学式为 ,F的化学式为 ;
(2)E 和氧化物G反应的化学方程式为 ;
(3)C和D在一定条件下可反应生成A和B,其反应的化学方程式为
。
24. X、Y、Z为短周期元素的单质,X、Y的组成元素为同主族元素,U、V为它们的化合物,这些物质之间的关系如右图所示,其中反应条件和某些产物已经略去。
(1)若V是水,则:①X是 、U是
②由于U有剧毒,工业上产生的U要经过处理变
成单质Y后方能排放,以防止大
气污染。富玛克斯法治理U的方法和步骤如下:
第一步:用2%~3%的Na2CO3溶液作吸收剂生成2种酸式盐;
第二步:再加入一种RNO(液)(R表示芳香烃基)
与生成的一种酸式盐的水溶液反应生成硫、碱和RNHOH;
第三步:第二步生成的碱在溶液中与另一种酸式盐反应生成正盐;
第四步:RNHOH与空气中的氧发生反应又得到RNO。
则:第一步反应的化学方程式为
请对富玛克斯法的优点做一简要评价:
(2)若U、V均为氧化物,则:
①写出反应I的化学方程式: ;
②在计算机长距离联网使用的传输速度快、信息量大的线路,使用的材料的主要化学成
分是U,该材料的名称是: 。
③这种材料埋在地下时,如果裸露在碱性土壤中,结果会断路,用离子方程式说明原因
。
25.下图为一些常见物质的转化关系图。电解C溶液的反应是无机化工生产中的一种重要反应,Q、M为常见单质;F、L是含有同一种元素的化合物,该元素在两种化合物中的价态不同。
试回答下列问题:
(1)用化学式表示:B: D:
(2)完成下列反应的化学方程式:
①F+L=M+H2O 。
其中氧化产物与还原产物的物质的量比 。
②电解C的饱和溶液(用单线桥法表示其电子转移的方向和数目)
。
(3)写出R与NaOH溶液反应的离子方程式
。
26.(16分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中A与D及C与E分别是同主族元素,B与C为相邻元素;C、E两元素原子核内质子数之和是A、D两元素原子核内质子数之和的2倍。据此,回答下列问题。
(1)A、C两元素可形成化合物甲,其分子由四原子核构成,此分子的电子式为:
;已知甲为二元弱酸,写出甲在水中的电离方程式 。
(2)写出由A、C、E三种元素的形成的六原子核化合物乙的水溶液和甲的水溶液反应
的化学方程式 。
(3)写出一种由A、B、C三种元素形成的常见无机化合物(填化学式) ,
其溶于水后对水的电离起 作用(填“抑制”、“促进”或“不影响”),其原
因是: 。
(4)用A元素的单质和C元素的单质制成的新型化学电源已
在宇宙飞船中使用。如右图所示,两个电极均由多孔性
碳制成,通入气体由空隙中逸出,并在电极表面放电。
①a是 极,电极反应式为: 。
②b是 极,电极反应式为: 。
27.已知固体甲、E、I、F均为常见的单质,其中E在常温下为气态。G为白色胶状沉淀,既能溶解于盐酸,又能溶解于氢氧化钠溶液。A在常温下为气态,与氧气完全反应时的体积比是1:2。W是由三种处在不同短周期的元素组成的化合物,与水反应生成A和G时的化学计量数之比为1:3:3:1。各物质有如下图所示的转化关系(部分反应的产物未全部表示)。试回答下列问题:
(1)B的电子式为 ,固体乙的化学式可能是 ;
(2)上述转化中,①C→E ②D→F ③E→F ④I→F ⑤I→E ⑥A→B 其中属于置换反应的是(填序号) ;
(3)写出W和水反应的化学方程式______________________________________________,
I和NaOH溶液反应的离子方程式__ _______________________________。
28. A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如下图所示:
请回答下列问题:
(1)元素A在元素周期表中的位置为 周期 族。
(2)写出K的电子式 。 (3)写出H和D反应的化学方程式 。
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式 。
(5)写出A与G反应的化学方程式 。
(6)K与E反应时产生的现象有 ;
该反应的化学方程式为 。
29.下图中A~J分别代表相关反应中的一种物质,已知A受热分解得到相同物质的量的B、C、D(图中有部分生成物未写出)。
请填写以下空白:
(1)B的电子式为 ,D分子的空间构型为 。
(2)写出反应①、②的化学方程式:
① ;
② 。
(3)反应③的离子方程式为: 。
30.单质A、M、X有如下转化关系(反应物和生成物中的水及反应条件已略去)。
已知X、B、C、N是常见气体。
(1)X的一种同素异形体与人类的生存环境关系密切,该同素异形体的分子式为 。
(2)能否确定A、M一定是非金属单质? (填“能”、“不能”),理由是
。
(3)C、E的分子结构相似,E的电子式为 。
(4)N能使溴水褪色,反应的化学方程式为 。
请写出鉴别C和N的一种试剂 (不能用溴水)
(5)请写出下列反应的化学方程式:
①N+X—→P: 。
②A+Q—→ : 。
31.甲、乙、丙是短周期元素形成的三种常见单质,A、B、C是三种常见的化合物,A为淡黄色固体;它们之间的转化关系如图所示。
请填写下列空白:
(1)A的化学式: ;B的电子式: 。
(2)写出甲和B反应的离子方程式 。
(3)1molA和足量B反应时转移的电子为 mol。
(4)单质乙和丙在浓KOH溶液中可以制成原电池,请写出该电池的电极反应方程式:
负极 ; 正极 。
32.有人对某合金的粉末进行如下实验分析:
(1)由此可知,该合金的组成元素中金属至少有 种
(2)写出B2变D2的离子方程式
(3)对固体C3的实验设计不合理,为了得到准确的结论,改进实验的方法是
33.(7分)X、Y、A、B、C、D是中学化学教材中常见的物质,且有如下转化关系。气体
C的式量比气体X的式量大2,产物中水已忽略。
回答下列问题:
(1)X分子的电子式是 。
(2)在上述转化过程中作还原剂的物质有(填物质的化学式) ;
(3)A与浓HNO3反应的化学方程式为 ;
(4)测定气体C的相对分子质量,测得的数值与气体的相对分子质量有差异的原因是(用
化学方程式表示) 。
34.已知X是一种复盐,C、D、E、H均为气体,F为白色不溶于水的物质;反应①是工业生产中的重要反应,反应④⑥⑦是实验室重要的物质检验反应,这些物质有如下图所示的转化关系(生成物中的水均已略去)。
试回答:
(1)写出下列物质的化学式K ,H ;
(2)向J的溶液中滴加2滴KSCN溶液,可观察到 ;若将一定量J的饱和溶液滴入到沸水中,反应后液体的颜色变为 ,其反应的离子方程式为: ;若再向该反应后的液体中逐滴滴入稀硫酸,直至过量,整个滴加过程中所观察到的现象是
。
(3)已知X与足量的B反应生成的E和F的物质的量之比为2:1,则X的化学式(不考虑结晶水)为: ;
(4)写出下列反应的离子方程式:
反应② ;
反应③ ;
反应⑤ 。
35.图中A~K都是中学化学中常见物质。A是一种酸,E、F、I通常状况下是气体,其中E有刺激性气味,X、Y是常见的金属单质,J为红褐色沉淀。参加反应的水以及生成的水在图中均已略去。
请回答下列问题:
(1)E的电子式为 ,J的化学式为 。
(2)写出K溶液与Y反应的离子方程式 。
(3)写出D溶液与X反应的离子方程式 。
(4)写出A+B→C+E的化学方程式 。
(5)如果n(A): n(B)为6:1,则B可能的化学式为 。
36. A.B.C.D.E是中学化学常见单质,构成它们的元素的原子序数分别为α、B. C.D.е;且3 (a+b) = 2 (a+c) = 3 (d-a);X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(图中反应物和产物中的H2O已略去):
(1)Y的电子式为 ,构成D单质的元素在周期表中位于 周期 族
(2)反应③的离子方程式为
E的氧化物与D在一定条件下反应的化学方程式为:
(3)固体N常温下即挥发,183℃升华,几乎溶于所有的有机溶剂和H2O中,据此判断
N为 型晶体。
(4)25℃时,PH=5的W和N的水溶液中由H2O电离出来的H+离子浓度之比为
37.已知A是一种由短周期元素组成的盐,H是引起温室效应的主要气体之一,Y是一种常见液体,E的相对分子质量比D大16,L、K均为白色沉淀,且K光照后无变化。它们存在如下转化关系(反应条件及部分产物已略去):
请回答下列问题:
⑴A的化学式是___________,Y的电子式是______ ____。
⑵反应①的化学方程式是_________________ ___________。
⑶反应②的离子方程式是_________________ ___________。
⑷将L加热后得到的固体物质在熔融条件下电解的化学方程式是________________ _。
38. A、B、C、D、均为中学化学常见的物质,它们间的反应关系如下图所示。
(1)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则B的化学式 。
有关反应的化学方程式为 。
(2)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液。
①A是NaHCO3时,该反应的离子方程式为:
。
②A是一种淡黄色固体,且A与B以物质的量之比为2:1相混合时,推知B的化学式为 。
(3)若A是碳化钙(CaC2),A与B的溶液反应时只生成气体C、CaCO3和水;C的燃烧热为1300kJ·mol-1,则B的化学式为 ;C燃烧的热化学方程式为 。
39.已知化合物A~M均为中学化学常见物质,它们之间存在如下图所示的转化关系。A、B、F、L均可形成原子晶体,其中B、F为非金属单质,D为金属单质,其余均为化合物;E、H、K均属于汽车尾气中的大气污染物,其中H是一种红棕色气体;I常温时为无色液体;A、F、L含有同种元素; A与B在高温下能发生反应,当B的用量不同时,反应物与生成物种类有如下图所示的转化关系①和②;C的稀溶液跟D发生反应时,也会因为D的用量不同,发生如下图所示的④、⑤反应,而生成不同的产物。
根据以上信息,完成下列填空:
(1)写出C、E、H的化学式C 、E 、H ;
(2)反应②中,氧化剂和还原剂的质量比为 ;
(3)B、F、L形成的原子晶体的熔点由高到低的顺序为(用化学式表示):
。
(4)从A~F中选择合适的物质,用离子方程式完成J和M的相互转化:
; 。
40.已知下列反应的框图中,B、E、F、I分别代表一种单质,A、C、D是氧化物,H、G是盐类,水作为反应物或产物时均略去不写,据图分析回答问题。
(1)B单质是 。
(2)说出反应②和③的实际应用的例子:②可应用于 ;③可应用于 ;
(3)写出反应③的化学方程式: ;
写出反应④的离子方程式: ;
写出反应⑤的离子方程式: 。
41.下图转化关系中的物质均为中学化学学过的物质。已知:A的焰色以应呈黄色;G是一种白色物质,微溶液于水;常温下,D、F均为气态单质,H、I为气态化合物;M是一种合成树脂,常用于制备塑料和合成纤维。
根据上述物质间的转化关系,填写下列空白:
(1)F的分子式为 ,H的电子式为 。
(2)反应①的离子方程式为 。
(3)反应⑤的化学方程式为 。
(4)向J、K的混合物中加入足量I的浓溶液,可得到F气体。反应的离子方程式为:
。
(5)实验室由C制得的气体H常有特殊难闻的臭味,可能的原因是
。
42.(14分)
物质A~J相互关系如下图,其中A为酸式盐,B为某二价主族金属元素的化合物,等物质的量的A、B与适量水充分混合恰好完全反应。常温常压下C、D、F、I均为气态,且I能使澄清石灰水变浑浊。反应④是工业上生产化合物J的重要方法,G是一种中学化学中常见的强酸。
(1)C的电子式是 ,E的化学式是 ,G的化学式是 。
(2)写出下列两物质反应的化学方程式:
B+H2O: ;
C+O2: 。
(3)A的溶液与过量NaOH溶液共热,发生反应的离子方程式为
。
43.下列图17所示反应有直接进行的,也有在溶液中进行的,其中部分产物已略去。
已知:A是固体单质;B、X、H为气体单质;D属于可溶于水的强电解质,一个D分子中含有18个电子。
(1)化学式:B为 ,F为 。
(2)用电子式表示D的形成过程为 。
(3)A是一种非常重要的工业产品。据统计,地球上每年由于腐蚀而消耗的A约占A年产量的10%。A发生腐蚀的主要原因是(填写下面的选项序号) ;
a.直接与氧气发生化学腐蚀
b.通过原电池反应发生腐蚀
c.因溶于水而消耗掉
若你选定选项a或c,请写出相应的化学方程式;若你选定选项b,请写出负极的电极反应式:
。
(4)已知H的密度比空气的密度大,则①中所涉及的反应的化学方程式为
,
。
(5)写出F与足量Y反应生成J的理由:
。
44. A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):
(1)若A是一种淡黄色单质固体,则B→C的化学方程式为 。
(2)若A是一种金属,C是淡黄色固体,则B的电子式为 。C物质与水反应的化学方程式为 。
(3)若C是红棕色气体,则A的化学式可能为 。
(4)若A、B、C均为单官能团有机物,则B中含有的官能团是 。
45.已知B是常见金属单质,E为常见非金属单质,H常温下为无色液体,C的浓溶液在加热时才与D反应。根据下列框图所示,试回答:
(1)L的化学式:__________F的电子式:__________
(2)反应①的离子方程式:______________________________
(3)反应②,工业上采取的反应条件:__________
(4)每生成lmolK,反应放出98.3kJ热,该反应的热化学方程式为:
____________________________________________________________
46.下图是中学化学常见的某些无机物相互转化的关系,图中Z是淡黄色固体,W是一种常见金属单质,D是红棕色固体。试剂X、A溶液、B溶液都是是单一物质的溶液,向它们的溶液中加入用硝酸酸化的硝酸银溶液,均产生白色沉淀。
请填写下列空白
①溶液M中溶质的主要成分是 (填分子式)
②B→D的化学方程式
③B→A的化学方程式
④黑色固体溶于X的离子方程式
⑤D→Y的化学方程式
⑥E的某种同素异形体近年来倍受关注,其分子式是 。
47.江苏省东临大海,利用海水等可制得多种化工产品。下图是以海水、贝壳等为原料制取几种化工产品的转化关系图,其中E是一种化肥,N是一种常见的金属单质。
试填写下列空白:
(1)N的化学式为: ;
(2)出反应①的化学方程式: ;
(3)由K溶液经如何处理才能制得N?
。
48.化合物A、B、C、D、E、F是中学化学的常见物质。这些化合物之间存在下图的关系。其中A和B的反应是一种重要的化工生产中的主要反应。
(1)在A、C、F中含有相同的元素是 。(填元素符号)
(2)化合物C可溶于水,其化学式为 ,水溶液呈 性,因为(用化学方程式或离子方程式表示) 。
(3)C的水溶液和D能否反应 ,其原因是 。
(4)该化工工业称为 。
49. A为两种固体化合物的混合物,以A为固体原料,可在实验室制备气体X,并模拟其工业制备过程。如图11所示,反应I和反应II均可生成气体X。
(1)混合物A的组成是 。
(2)工业制备X的反应为 (填I和II),其反应条件为 ,同时得到另一种气体产物的名称为 。
(3)写出实验室制备X反应的离子方程式 。
(4)工业生产X时,目前比较先进的设备为 ,
从安全方面考虑它可防止 。
50.已知物质转化关系如图18所示:
①若A为第三周期金属元素的单质,不与NaOH溶液反应;B为黑色固态的非金属单质。则反应的化学方程式为
②若A为第三周期金属元素的单质,X是红棕色粉末,化合物Y可溶于NaOH溶液。则每生成1mol B,反应中转移电子的数目为 mol;
③若X在常温下是无色液体,Y是具有磁性的黑色晶体,B是气态非金属单质。则A元素在周期表中的位置为 周期 族。该反应的化学方程式为 。
51.
在下图所示的转化关系中,A、B、C是中学化学中常见的物质,都含有同一种元素R,且所含元素均在短周期。回答下列问题。(说明:图中不含R的产物均已略去,反应②的产物之一是A)
(1)若A为气体单质,则A为__________________________。
(2)若A为两性无机化合物,由A转化为B和C的离子方程式为____________________。
(3)若A是由非金属元素组成的盐,则由A转化成B(或B、C)的离子方程式为________
___________________________________。
(4)若A为酸性氧化物,A与NaOH溶液反应有三种情况(只生成B、只生成C、同时生成B和C),则A为__________________________。
(5)若A可由家庭生活中两种常见的有机物合成,则A转化成B和C的化学方程式为_____________________ __________________。
52.由白色和黑色固体组成的混合物A,可以发生如下框图所示的一系列变化:
(1)写出反应③的化学方程式:__________________________________ __。
反应④的离子方程式:________________________________________________。
(2)操作②中的名称是________,在操作②中所使用的玻璃仪器的名称是____________。
(3)下列实验装置中可用于实验室制取气体G的发生装置是____________;为了得到纯
净干燥的气体G,可将气体通过c和d装置,c装置中存放的试剂是____________,
d装置中存放的试剂是____________。
(4)气体G有毒,为了防止污染环境,必须将尾气进行处理,请写出实验室利用烧碱溶液吸收气体G的离子方程式:____________________________________;下列e~i装置中,通常用来吸收气体G的装置是____________。
(5)J是一种极易溶于水的气体,为了防止倒吸,下列e~i装置中,可用于吸收J的是____________________________________。
53.甲、乙、丙是由短周期元素形成的三种常见单质,A、B、C是三种常见的化合物,其中B在常温下呈液态,各物间的转化关系如图:
请回答下列问题:
(1)A的化学式为: B的电子式为:
(2)写出甲和B反应的离子方程式
(3)1molA与足量B反应时转移的电子为 mol
(4)单质乙和丙被应用于燃料电池中,如图所示,两个电极均由
多孔性碳构成,通入的两种单质由孔隙逸出并在电极表面放
电。则a是电池的 极,b电极上的电极反应式为
。
54.根据下列框图关系填空。已知反应①、③是工业生产中的重要反应,D、E常温下为气体、X常温下为五色液体,H与E相对分子质量之间的关系为:Mr(H)-Mr(E)=34,又知C的焰色反应呈黄色。
(1)化合物B中所包含的化学键有___________________
(2)反应④的离子方程式:________________________________
反应⑤的化学方程式:________________________________
(3)已知每生成16gE,放出106.5kJ热量,则反应①的热化学方程式为:
______________________________________
55.在下列物质间的转化关系中,反应③为电解,每个框中的字母只代表一种物质。
试回答:
(1)A的化学式_____________________.
(2)反应①的化学反应式________________________,_____________________________;
简述能生成A物质的原因____________________________________.
(3)反应②的化学反应式____________________________________,反应的现象是______________________________________.
(4)反应③中加入NaOH溶液的原因是____________________________________.
2006年理综复习模拟无机框图推断试题(50题)答案
1.答案:(1)(NH4)2S
(2)H2SO4(3)HNO3
(4)H2S+Cl2=2HCl+S↓, 8NH3+3Cl2=N2+6NH4Cl
2.答案:①NaCl;②H2S,高温、催化剂;③CH3CH2OH
3. (2)①4KCl+MnO2+2H2SO4(浓)====Cl2↑+MnCl2+2K2SO4
②2KCl+H2SO4(浓)====2HCl↑+K2SO4
4.答案:(1) Na+[::]2-Na+, SO3
(2)2Na2O2+2H2O=4NaOH+O2;2Na2SO3+O2=2Na2SO4
5.
答案:(1) , ::C::, Na+[:::]2-Na+
(2)HSO4-= H++SO42-, CO32-+H2O=HCO3-+OH-
(3) ①2H++CO32-= CO2↑+H2O;
②2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
6. 答案:(1)NaHCO3,CaCO3
(2)2Mg+CO2======2MgO+C
7.答案:(1)H2
(2)H:CC:H;2HC≡CH+5O2 =2CO2+2H2O(3)C+H2O——→CO+H2;CuO
8.答案:(1)Al Al(OH)3 Fe2+
(2)2A1+2OH—+2H2O=2AlO2—+3H2 ↑ 2Al2O3===4A1+3O2↑
2Al+Fe2O3====2Fe+Al2O3 4Fe(OH)2+O2+H2O==4Fe(OH)3
9.答案:(1)Fe Fe3O4
(2)Fe3O4+4H2SO4= Fe2(SO4)3+FeSO4+4H2O
4Fe(OH)2+O2+H2O==4Fe(OH)3↓
(3) H2O Al2O3
10.答案:(1) Al2O3
(2) (NH4)2SO4和K2SO4
(3) AlO2—+CO2+2H2O=Al(OH)3↓+HCO3—
11.答案:(1)A1 O2
(2) Al2O3+2NaOH=2NaAO2+H2O
(3) AlO2—+CO2+2H2O=Al(OH)3↓+HCO3—
或2AlO2—+CO2+2H2O=2Al(OH)3↓+CO32—
一种单质跟NaOH溶液反应生成一种化合物和氢气,还可联想到Si,如果单质A是Si,则化合物乙是Na2SiO3,化合物丁是H2SiO3,化合物甲是SiO2,从而反推出单质B是O2故本题还可能是另一组答案。
(1)Si O2
(2)Si+2NaOH+H2O =Na2SiO3+2H2↑
(3) SiO32—+CO2+H2O=H2SiO3↓+CO32— (CO2过量生成HCO3—)
12.答案:
13.答案:(1)A是(NH4)2S Y是O2 Z是H2O
(2)E是HNO3 E是H2SO4
(3)NH4++OH-=NH3·H2O或NH4++OH-NH3↑+H2O
S2-+2H+=H2S↑
14.答案:(1)X: NH4HCO3或(NH4)2CO3; B:H2O; F:NO2; G:HNO3。
(2)A→D:2CO2+2Na2O2=2Na2CO3+O2
G→E:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
15.答案:
16.答案:(1)Fe;Cl2;H2
(2)4Fe(OH)2+O2+2H2O===4Fe(OH)3
(3)2Fe2++Cl2===2Fe3++2Cl-
17.答案:(1)A:Na2SO3 B:BaCl2
(2)①:2Cl-+2H2O2OH—+H2↑+Cl2↑
②:BaSO3+C12+H2O=BaSO4↓+2H++2Cl—
③:SO2+C12+2H2O=4H++2C1—+SO42—
18.答案:NH4HCO3或(NH4)2CO3 NH3 O2
4HNO3+C==CO2↑+4NO2↑+2H2O
19.(6分,每空1分)(1)NH3,HNO3; NH4NO3 N2O+2H2O
(2)SO3;AB;H 2S2O7或H2SO4·SO3或2SO3·H2O
20.(12分)
(1)NH4HCO3或(NH4)2CO3 NH3 NO2(写分子式)
(2)①2CO2+2Na2O2=2Na2CO3+O2
②4NH3+5O2 4NO+6H2O
③3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O
21.⑴ X Cl2 (2分)Y H2O2 (2分)
⑵ MnO2 + 4H++ 2Cl- Mn2++Cl2↑+2H2O(2分)
Al2O3 +6H+=2Al3++3H2O(2分) ⑶ 2H2O2 2 H2O +O2↑(2分)
23.(7分)
(1)FeS2(1分) O3 (1分)
(2)Na+[ ]2-Na+ (1分)
(3)①2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ …………………………(2分)
②Na2CO3+SiO2 Na2SiO3+CO2↑ …………………………(2分)
24.(1)(4分)Br2,Fe;(2)(2分)2Al+Fe2O3 2Fe+Al2O3;
(3)(2分)H2SO4(浓)+2HBr Br2+SO2↑+2H2O
25.(本题共14分)(1)①X是:O2、U是:H2S (每空1分)
②Na2CO3+H2S=NaHCO3+NaHS(2分) 总反应为:2H2S+O2 2H2O+2S↓;(2分)
RNO反应前后不变,起到催化剂的作用,是一条绝色工艺流程。(2分)
(2)①SiO2+2C Si+2CO(2分) ②光导纤维(2分)
③SiO2+2OH-=SiO+H2O(2分)
26.(1)FeCl2 FeS (2)①SO2+2H2S 3S↓+2H2O 2: 1
②2NaCl+2H2O 2NaOH+H2↑+Cl2↑ 单线桥略
(3)Al2O3+2OH— 2AlO2—+H2O
27.(16分)(1)H: O: O:H (2分) H2O2 H++HO2— HO2— H++O22— (2分,写出第一步即可得分;若写成H2O2 2H++O22—不给分)
(2)H2O2+H2SO3 H2SO4+H2O(2分)(3)HNO3(或NH3·H2O或NH4NO3)(1分)
抑制(1分) 硝酸电离产生H+,抑制水的电离(2分) (或抑制NH3·H2O电离产生OH—,抑制水的电离。或促进NH4NO3在水中完全电离出的NH4+与水电离出的OH—结合成NH3·H2O,促进了水的电离。) (4)①负(1分)2H2-4e—+4OH— 4H2O(2分) (或H2-2e—+2OH— 2H2O或H2-2e— 2H+,均给分)②正(1分)
O2+4e—+2H2O 4OH—(2分)
28.(1) Fe2O3 (2) ①③④
3) Al(CH3)3 + 3H2O = 3CH4 ↑+ Al(OH)3 ↓ 2Al + 2OH- + 2H2O = 2AlO2- + 3H2 ↑
29.(1)四;VIII (2):O::C::O: (3)3Fe3O4+8Al 4Al2O3+9Fe
(4)2Al+2OH-+2H2O=2AlO2-+3H2↑ (5)3Fe+4H2O(g) Fe3O44H2↑
(6)镁带剧烈燃烧,放出耀眼的光,瓶壁出现白色固体和黑色颗粒:
2Mg+CO2 2MgO+C (每空1分,共8分)
30.(每空2分,共10分)(1) 三角锥形
(2)2Mg+CO2 2MgO+C; 4NH3+5O2 4NO+6H2O
(3)NH4++HCO3-+2OH-+2OH NH3↑+CO+2H2O
31.(共16分)
(1)O3(2分) (2)能(2分),它们与O2反应生成的化合物B、N为气体(2分)
(3) (2分)
(4)Br2+SO2+2H2O=2HBr+H2SO4(2分);品红溶液或酸性高锰酸钾溶液(2分,写对一
种即可)
(5)①2SO2+O2 2SO3(2分)
②C+2H2SO4(浓) CO2↑+2SO2↑+2H2O(2分)
32.(15分)(1)Na2O2(2分) H :O: H(2分)
(2)2Na+2H2O====2Na++2OH-+H2↑(3分)
(3)1(2分)
(4)负极:2H2—4e-+4OH-====4H2O(3分)
正极:O2+4e-+2H2O===4OH-(3分)
33.(8分)(1)3种, (2)Al3++3NH3·H2O=Al(OH)3↓+3NH4+ (3)先加足量的稀硝酸充分反应后,溶液变蓝;再向黑色固体中加入足量的浓硝酸,生成的气体水先后通入饱和石灰水中,产生白色浑浊。
34.(7分)
(1): O : : C : : O :(1分) (2)Mg C(2分)
(3)C+4HNO3(浓) CO2↑+4NO2↑+2H2O(2分)
(4)2NO2 N2O4(2分)
35.(16分)
(1)Fe(OH)3;HCl(每空1分)
(2)溶液变为红色(1分);红褐色(1分),Fe3++3H2O 沸水 Fe(OH)3(胶体)+3H+(2分);
先有红褐色沉淀生成,后沉淀逐渐溶解,得到棕黄色溶液(2分)。
(3)(NH4)2Fe(SO4)2(2分)。
(4)每个离子方程式均为2分,写化学方程式每个扣1分
②2NH4++Fe2++4OH-微热2NH3↑+Fe(OH)2↓+2H2O
③Cl2+2OH-=Cl-+ClO-+H2O
⑤2Fe2++Cl2=2Fe3++2Cl-
36.(1) (2分) Fe(OH)3 (2分)
(2)Fe+2Fe3+=3Fe2+ (3分)
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑ (3分)
(4)2HCl+NaClO=NaCl+Cl2↑+H2O (3分)
(5)NaClO3 (2分)
37、(17分)⑴ (2分) 三 (1分) ⅢA(1分)
⑵ Al3++3AlO2-+6H2O = 4Al(OH)3↓ (3分)
Fe2O3+2Al ==== 2Fe + Al2O3 (3分)(Fe2O3若写成FeO或Fe3O4并配平也可以)
⑶ 分子 (3分) ⑷ 1∶104 (4分)
38.(10分)(1)NH4Al(SO4)2 (4分,各2分)
(2)4NH3+5O2 4NO+6H2O(2分)
(3)Al3++3AlO2-+6H2O 4Al(OH)3↓(2分) (4)2Al2O3 4Al+3O2↑
39.(15分)
(1)(NH4)SO4 (2分)
(NH4)2SO 4 +Ba(OH)2=BaSO4↓+2NH3↑+2H2O (3分)
(2)①Al3++3HCO3-====Al(OH)3↓+3CO2↑ (3分)
②Al2(SO4)3 (2分)
(3)Ca(HCO3)2 (2分)
2C2H2(g)+5O2(g)====4CO2+2H2O(1) △H=-2600kJ·mol-1 (3分)
40.(8分) (1)HNO3、CO、NO2 (2)1:2 (3)C>SiC>Si
(4) 3Fe2++4H++NO3- = 3Fe3++2H2O+NO或2Fe3++Fe=3Fe2+
41.(1)Al(2)某些金属冶炼或某些场合焊接钢轨或定向爆破时熔断钢筋。(说明:只要答出任意一点或其它合理答案均给2分) 潜艇中(太空舱中或高原等条件下)的供氧(3)2NaO2+2CO2=2Na2CO3+O2 Al2O3+2OH—=2AlO2-+H2O
2AlO2—+3H2O+CO2=2Al(OH)3↓+CO32-
42.(16分)(1)Cl2; H : C C : H(各2分共4分)
(2)2Cl-+2H2O Cl2↑+H2↑+2OH-
(3)nCH2=CH [ CH2—CH ]n
(4)ClO-+Cl-+2H+=Cl2↑+H2O
(5)气体H中混有PH3、H2S等杂质(或C中含有的硫
化物、磷化物等杂质与水反应生成PH3、H2S,混入
气体H中)
43.(14分)
(1)(7分) (3分),CaCO3(2分),HNO3(2分)
(2)(4分。每空2分)CaC2+2H2O→Ca(OH)2+C2H2↑
4NH3+5O2 4NO+6H2O
(3)(3分)NH4++HCO3-+2OH- ====CO+NH3↑+2H2O
44.(共16分,每空2分)
(1)H2;FeCl2……各2分
(3)b;Fe-2e-=Fe2+……各2分
(4)2Na2O2+2H2O=4NaOH+O2↑……2分
FeCl3+3NaOH=Fe(OH)3↓+3NaCl……2分
(5)Na2O2具有氧化性,且与水反应生成碱,故Fe2+在此条件下可被氧化生成Fe(OH)3…2
45.(1)2SO2+O2 2SO3(2分)
(2)Na+[:O:]2-Na+ 2Na2O2+2H2O=4NaOH+O2↑ (各3分,共6分)
(3)N2或NH3(2分)(写出一个即可,其它合理答案参照给分)
O
(4)—C—H或—CHO,或醛基(2分)
46(10分,每格2分)
(1)Cu(OH)2;过氧化钠电子式(略)
(2)2Cu2++2H2O 2Cu↓+O2↑+4H+
(3)常压 催化剂,400-5000C (答催化剂,加热也可)
(4)SO2 (g)+1/2O2 SO3(g);=-98.3kJ/mol
47.(14分)①Cl2(2分)
②FeCl3+3H2O Fe(OH)3+3HCl; 2Fe(OH)3 Fe2O3+3H2O(3分)
③2FeCl3+Fe 3FeCl2(2分)
④Fe3O4+8H+ 2Fe3++Fe2++4H2O(3分)
⑤2Al+Fe2O3 Al2O3+2Fe(2分)
⑥O3(2分)
48.⑴Mg(2分); ⑵NaCl(饱和)+NH3+CO2+H2O==NaHCO3↓+NH4Cl(4分);
⑶MgCl2溶液必须在氯化氢气体中进行蒸发结晶制得MgCl2晶体,熔融后电解才能制取金属镁(4分)。
49.(14分)(1)Na (2)Na2SiO3 碱性 SiO32- + 2H2O H2SiO3 + 2OH-
(3)能反应,H2CO3的酸性强于H2SiO3,可以由强酸制得弱酸(4)硅酸盐工业
(每空2分)
50.(1)KClO3和MnO2 或KClO3和KMnO4(2分)
(2)II(2分) 通电(或电解)(2分) 氢气(2分)
(3)MnO2 +2Cl-+4H+=Mn2++Cl2↑+2H2O (2分)
(4)离子交换膜电解槽(2分) 阴阳两极产生的H2和Cl2混合爆炸(2分)
51.①2Mg+CO2 2MgO+C ……………………2分
②3 ……………………2分
③四;Ⅷ;3Fe+4H2O Fe3O4+4H2
52. (15分)
(1) (3分) (2) (3分)
(3) (3分)
(4) (3分)
(5)
(3分)
53.(16分)(1)Na2O3(3分) H : O : H(3分)
(2)2Na+2H2O 2Na++2OH-+H2↑(3分)
(3)1(2分)
(4)正(2分),4OH-+2H2-4e- 4H2O(3分)
54、(每空3分)(1)离子键、非极性键(或共价键)
(2)Fe203+6H+=2Fe3++3H20, Fe2(S04)3+6NaOH =2Fe(OH)3↓+3Na2S04
(3)FeS2(s)+ 02=Fe2O3 (s) +2SO2(g); △H=-852kJ/mol
(未注明状态扣1分,写成FeS给2分)
55、(12分)(1)Mg(OH)2(2分)
(2)Mg(HCO3)2 MgCO3 + CO2 + H2O (1分) MgCO3 + H2O Mg(OH)2 + CO2 (1分)Mg(OH)2 比 MgCO3 更难溶(2分)
(3)Mg + CO2 MgO + C (2分) 发出耀眼的白光(1分) 有黑色颗粒和白色粉末生成(2分)
(4)增强水的导电性(1分)
通电
高温
A
B
C
E
+
I
M
+NaOH
C
+
D
F
+
J
H
G
+
F
+
B
+
H2O
E
气体F
气体L
B溶液
R
单质Q
单质M
红褐色沉淀
D
A溶液
B溶液
C溶液
黑 色
沉淀D
等物质的量混合
+O2
高温
稀盐酸
NaClO溶液
Al粉
高温
△
E
B
A
B
C
D
M
N
P
Q
N
C
X
X
Q
X
X
△
X
电解
Y
A
C
A
Z
W
D
②
K
D
H
A
N
E
E
C
M
③
①
E
E+F
G+H+I
J+K+I
E+L
I+K+M
A
B
C
D
①
②
③
④
⑤
A
B
+
C
D
+
高温
H2O + D + F
E + F
盐酸
盐酸
气体C
ycy
△
点燃
点燃
通电
高温
OH—
空气
催化剂
△
△
MnO2
高温
RNO
高温
高温
点燃
催化剂
加热
点燃
△
催化剂
高温或△
△
△
:
:
Na+[ :O: H ]-
高温
催化剂
△
电解
电解
一定条件
(各3分)
Cl
Cl
催化剂
△
△
. .
. .
△
△
高温
高温
Page 1
同课章节目录
