新课标-化学反应的速率和限度[上学期]
文档属性
| 名称 | 新课标-化学反应的速率和限度[上学期] |  | |
| 格式 | rar | ||
| 文件大小 | 155.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-12-19 11:57:00 | ||
图片预览





文档简介
课件16张PPT。第二章 碱金属第一节 钠物理性质
银白色,质软,密度小于水
[少量Na煤油保存,Li用蜡密封] 化学性质
㈠与氧气的反应㈡与水的反应㈢与硫,氯,硫酸铜容液、盐酸的反应4Na + O2 = 2Na2O 2Na + O2 = Na2O2 点燃现象: 金属钠浮在水面反应:2Na + 2H2O = 2NaOH + H2 熔成闪亮的小球 向各个方向游动 发生嘶嘶的响声溶液变成红色密度比水小反应放热,钠熔点低有气体生成反应剧烈 产物呈碱性解释:与盐酸的反应
2Na+2HCl=2NaCl+H2↑与硫的反应与氯气的反应2Na + Cl2 = 2NaCl 2Na + S = Na2S 与硫酸铜反应
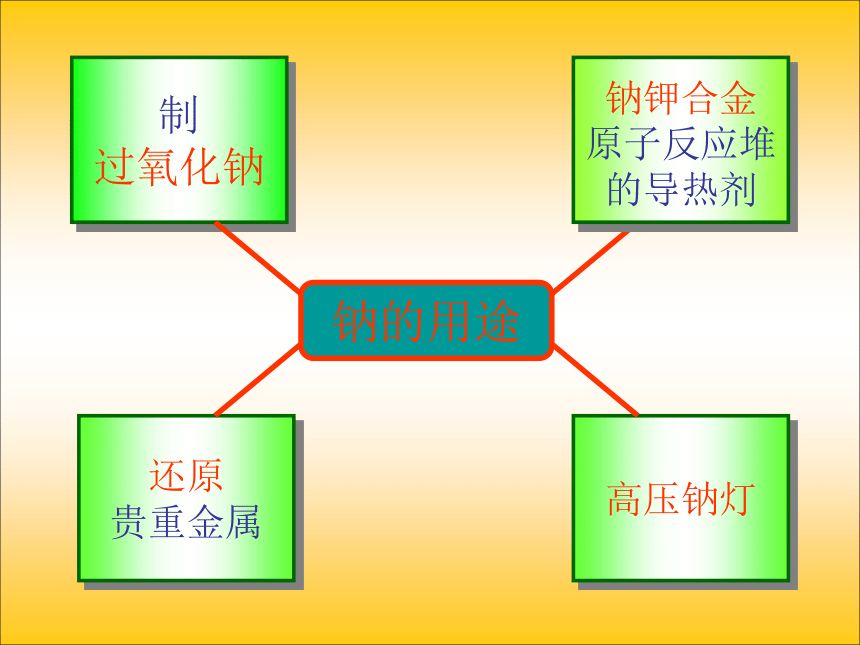
2Na + 2H2O = 2NaOH + H2 ↑ CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2Cu(OH)2 = CuO +H2O △ 点燃研磨钠的用途制
过氧化钠还原
贵重金属
钠钾合金
原子反应堆
的导热剂
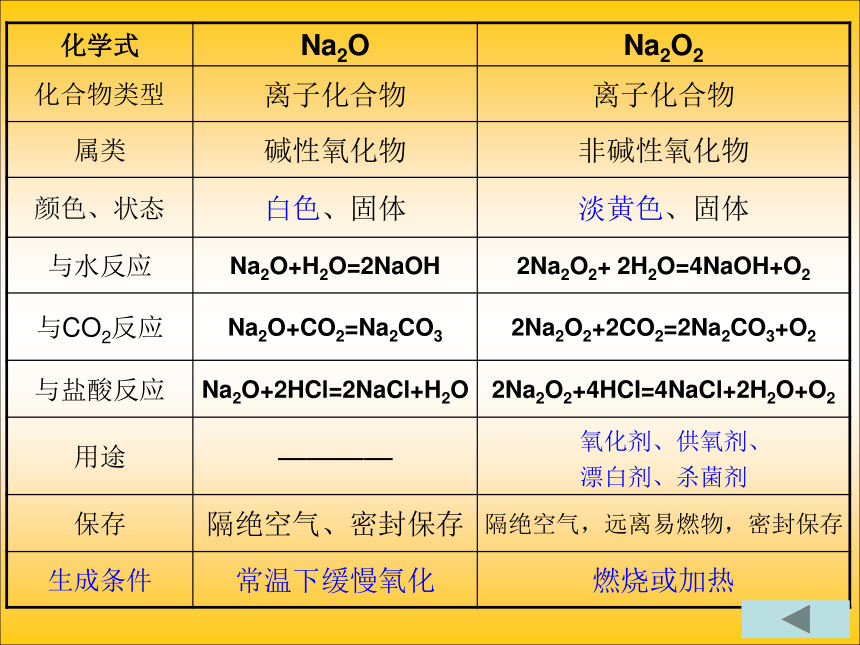
高压钠灯第二节 钠的化合物一、过氧化钠 1、与水反应: 2Na2O2+2H2O=4NaOH+O2↑ 2、与CO2反应:2Na2O2+2CO2=2Na2CO3 +O2 ↑(有强氧化性、漂白性)二、碳酸钠和碳酸氢钠 1、与酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2 ↑碳酸钠与碳酸氢钠的比较白色粉末 细小白色晶体 纯碱、苏打 小苏打 106 84Na2CO3 NaHCO3 Na2CO3+2HCl=2NaCl+H2O+CO2 ↑ NaHCO3+HCl=NaCl+H2O+CO2 ↑制玻璃、肥皂等 发酵粉、胃药等 2. Na2CO3与H+的分步反应
CO32- + H+ = HCO3-
HCO3- + H+= H2O + CO2↑ 3、CO32-和HCO3-的检验(1)当某溶液滴加盐酸放出无色、无味的使澄清石灰水变浑浊的气体,则原溶液中含有CO32-(或HCO3-离子)(2)若进一步确证是CO32-还是HCO3- ,再取原试液滴加BaCl2溶液,如有沉淀则含有CO32- ,若没有沉淀,则含有HCO3- 。
CO32- + Ba2+ = BaCO3↓知识结构框架图原
子
结
构
特
征最外层上电子数相等均有1个电子从锂到铯原子序数依次递增
电子层数依次增多相同点:递变性:第三节 碱金属元素银白色,铯略带金色都比较柔软,有延展性较小,其中锂、钠、钾的密度比水的小于水很强随电荷数增加,密度增大,钾反常随电荷数增加,熔点降低随电荷数增加,沸点降低一、物理性质:二、化学性质2.与水的反应
2Na+2H2O====2NaOH+H2↑
2K+2H2O====2KOH+H2↑
2Rb+2H2O====2RbOH+H2↑ 点燃4Li+O2====2Li2O钠在空气中缓慢氧化的过程及现象(优化45页)
NaO→NaOH→Na2CO3.10H2O→Na2CO3Li氧化物,Na过氧化物,K超氧化物 从上到下,与氧气反应越来越剧烈从上到下,与水反应越来越剧烈1、与氧气的反应:三、俗称:
NaOH:苛性钠,火碱,烧碱;
NaCl:食盐;Na2SO4:芒硝;NaHCO3小苏打;
Na2S2O3:大苏打,海波。
Na2CO3:苏打,纯碱;四、侯氏制碱法 五、焰色反应 1、含义:某些金属或其化合物灼烧时使火焰呈现出特殊的颜色
2、操作:(略)
3、结论:
钠:黄色 钾:紫色(透过蓝色钴玻璃观察) 4、应用: 离子检验,物质鉴别。 有A、B、C、 D四种物质的溶液,在进行焰色反应实验时,火 焰都呈黄色,它们之间可发生如右图所示的转化,则这四种物质分别为:A 、B 、C 、D 。 END
银白色,质软,密度小于水
[少量Na煤油保存,Li用蜡密封] 化学性质
㈠与氧气的反应㈡与水的反应㈢与硫,氯,硫酸铜容液、盐酸的反应4Na + O2 = 2Na2O 2Na + O2 = Na2O2 点燃现象: 金属钠浮在水面反应:2Na + 2H2O = 2NaOH + H2 熔成闪亮的小球 向各个方向游动 发生嘶嘶的响声溶液变成红色密度比水小反应放热,钠熔点低有气体生成反应剧烈 产物呈碱性解释:与盐酸的反应
2Na+2HCl=2NaCl+H2↑与硫的反应与氯气的反应2Na + Cl2 = 2NaCl 2Na + S = Na2S 与硫酸铜反应
2Na + 2H2O = 2NaOH + H2 ↑ CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2Cu(OH)2 = CuO +H2O △ 点燃研磨钠的用途制
过氧化钠还原
贵重金属
钠钾合金
原子反应堆
的导热剂
高压钠灯第二节 钠的化合物一、过氧化钠 1、与水反应: 2Na2O2+2H2O=4NaOH+O2↑ 2、与CO2反应:2Na2O2+2CO2=2Na2CO3 +O2 ↑(有强氧化性、漂白性)二、碳酸钠和碳酸氢钠 1、与酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2 ↑碳酸钠与碳酸氢钠的比较白色粉末 细小白色晶体 纯碱、苏打 小苏打 106 84Na2CO3 NaHCO3 Na2CO3+2HCl=2NaCl+H2O+CO2 ↑ NaHCO3+HCl=NaCl+H2O+CO2 ↑制玻璃、肥皂等 发酵粉、胃药等 2. Na2CO3与H+的分步反应
CO32- + H+ = HCO3-
HCO3- + H+= H2O + CO2↑ 3、CO32-和HCO3-的检验(1)当某溶液滴加盐酸放出无色、无味的使澄清石灰水变浑浊的气体,则原溶液中含有CO32-(或HCO3-离子)(2)若进一步确证是CO32-还是HCO3- ,再取原试液滴加BaCl2溶液,如有沉淀则含有CO32- ,若没有沉淀,则含有HCO3- 。
CO32- + Ba2+ = BaCO3↓知识结构框架图原
子
结
构
特
征最外层上电子数相等均有1个电子从锂到铯原子序数依次递增
电子层数依次增多相同点:递变性:第三节 碱金属元素银白色,铯略带金色都比较柔软,有延展性较小,其中锂、钠、钾的密度比水的小于水很强随电荷数增加,密度增大,钾反常随电荷数增加,熔点降低随电荷数增加,沸点降低一、物理性质:二、化学性质2.与水的反应
2Na+2H2O====2NaOH+H2↑
2K+2H2O====2KOH+H2↑
2Rb+2H2O====2RbOH+H2↑ 点燃4Li+O2====2Li2O钠在空气中缓慢氧化的过程及现象(优化45页)
NaO→NaOH→Na2CO3.10H2O→Na2CO3Li氧化物,Na过氧化物,K超氧化物 从上到下,与氧气反应越来越剧烈从上到下,与水反应越来越剧烈1、与氧气的反应:三、俗称:
NaOH:苛性钠,火碱,烧碱;
NaCl:食盐;Na2SO4:芒硝;NaHCO3小苏打;
Na2S2O3:大苏打,海波。
Na2CO3:苏打,纯碱;四、侯氏制碱法 五、焰色反应 1、含义:某些金属或其化合物灼烧时使火焰呈现出特殊的颜色
2、操作:(略)
3、结论:
钠:黄色 钾:紫色(透过蓝色钴玻璃观察) 4、应用: 离子检验,物质鉴别。 有A、B、C、 D四种物质的溶液,在进行焰色反应实验时,火 焰都呈黄色,它们之间可发生如右图所示的转化,则这四种物质分别为:A 、B 、C 、D 。 END
