铁、铜及其化合物的应用[上学期]
图片预览






文档简介
课件16张PPT。铁、铜及其化合物的性质一、铁、铜的存在1.铁以化合态形式存在于自然界,游离态的铁来自陨石。
铁的存在:磁铁矿、赤铁矿
2.铜主要以化合态存在于自然界,
铜的存在:黄铜矿、孔雀石
铜有少量的以游离态形式存在自然界二、铁铜的物理性质:1.银白色,有金属光泽;
2.具有良好的延展性;
3.是电和热的良导体;
4.密度是7.86g/cm3
5.熔点15350C,沸点是27500C
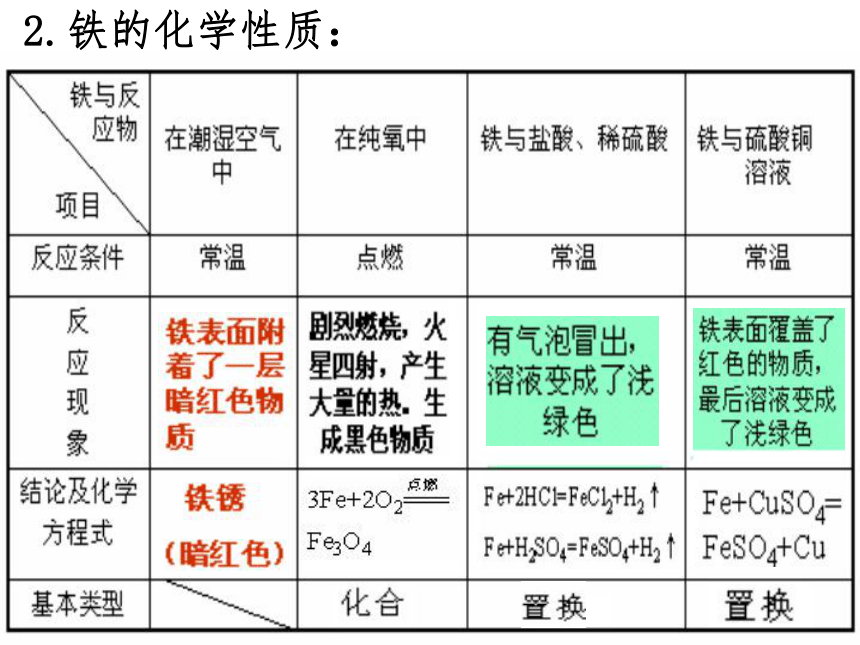
特性:能被磁体吸引,具铁磁性建材;炊具;铸件;作催化剂;制具有特性的铁合金;制磁铁等。1.纯铜呈紫红色; 2.熔点1083.4℃,沸点2567℃; 3.密度8.92g/cm3;质软; 4.具有良好的延展性; 5.具有良好的导热、导电性;广泛用于电气工业;制铜合金;作微量元素肥料;作各种仪表的零件 铁铜的性质1、铁、铜的物理性质铁:银白色金属光泽,质软,有良好的导电性、导热性、延展性。(具金属的通性) 粉末黑色,能被磁石吸收铜:紫红色金属光泽,具金属的通性。粉末为紫红色。2、铁、铜的化学性质P72交流与讨论三、铁、铜的化学性质①与非金属反应:Fe 2Fe+3Br2= 2FeBr3 产物Fe的价态活泼不活泼Cu 产物Cu 的价态+2、+3+3+2+2+1②与盐溶液反应Fe+Cu2+ == Fe2+ + CuCu+2Ag+ == Cu 2+ + 2Ag铜与硝酸银溶液反应③铁与水的反应3Fe+4H2O(g) === Fe3O4+4H2④铁与酸的反应Fe+2H+ = Fe2++H2↑Fe+4HNO3(稀)==Fe(NO3)3+NO↑+2H2O钝化 钝化:空气中:Mg、Al 浓酸中:Al、Fe常温2.铁的化学性质:与水反应小结: 铁的化学性质
铁是一种变价金属(+2、+3),与弱氧化剂反应时呈较低价态,如:I2、S、H2SO4、CuSO4等。
与强氧化剂反应呈较高价态,如:F2、Cl2、Br2、HNO3、O2等。Fe2+和Fe3+离子的检验①Fe3+的检验:
a目测:黄色溶液
b滴入氨水或烧碱等碱性溶液:
现象:红褐色沉淀。方程式:
Fe3++3OH-==Fe(OH)3↓(红褐色)
c加KSCN溶液:
现象:溶液呈血红色
Fe3+ + SCN-== [Fe(SCN)]2+
黄色 无色 血红色Fe3+ + 3SCN - = Fe(SCN)3可溶血红色注意: Fe3+ 遇SCN - 显血红色
Fe2+ 遇SCN –不变色用途:用KSCN溶液检验溶液中是否含有Fe3+ 实验Fe2+和Fe3+离子的检验② Fe2+的检验
a目测:浅绿色溶液
b滴入氨水或烧碱等碱性溶液:
现象:白色沉淀,在空气中立刻转化成灰绿色,最后变成红褐色。
4Fe(OH)2+O2+2H2O==4Fe(OH)3
白色 红褐色
实验
结论KSCN一、无明显变化二、加入KSCN
溶液后溶液呈
血红色实验结论(一)溶液变成血红色(二)加铁粉后
溶液由黄色变成
浅绿色加KSCN
溶液后无明显变化实验结论亚铁化合物既具有氧化性又具有还原性,遇较强氧化剂时被氧化成三价铁的化合物
+3价铁离子只具有氧化性,遇较强还原剂时会被还原成亚铁化合物。写出+3价铁与铜反应的化学方程式 试一试1.实验室配制的FeSO4溶液久置是否会变质?为什么?
如何鉴定它已经变质?
2.如何防止FeSO4溶液变质?
铁的存在:磁铁矿、赤铁矿
2.铜主要以化合态存在于自然界,
铜的存在:黄铜矿、孔雀石
铜有少量的以游离态形式存在自然界二、铁铜的物理性质:1.银白色,有金属光泽;
2.具有良好的延展性;
3.是电和热的良导体;
4.密度是7.86g/cm3
5.熔点15350C,沸点是27500C
特性:能被磁体吸引,具铁磁性建材;炊具;铸件;作催化剂;制具有特性的铁合金;制磁铁等。1.纯铜呈紫红色; 2.熔点1083.4℃,沸点2567℃; 3.密度8.92g/cm3;质软; 4.具有良好的延展性; 5.具有良好的导热、导电性;广泛用于电气工业;制铜合金;作微量元素肥料;作各种仪表的零件 铁铜的性质1、铁、铜的物理性质铁:银白色金属光泽,质软,有良好的导电性、导热性、延展性。(具金属的通性) 粉末黑色,能被磁石吸收铜:紫红色金属光泽,具金属的通性。粉末为紫红色。2、铁、铜的化学性质P72交流与讨论三、铁、铜的化学性质①与非金属反应:Fe 2Fe+3Br2= 2FeBr3 产物Fe的价态活泼不活泼Cu 产物Cu 的价态+2、+3+3+2+2+1②与盐溶液反应Fe+Cu2+ == Fe2+ + CuCu+2Ag+ == Cu 2+ + 2Ag铜与硝酸银溶液反应③铁与水的反应3Fe+4H2O(g) === Fe3O4+4H2④铁与酸的反应Fe+2H+ = Fe2++H2↑Fe+4HNO3(稀)==Fe(NO3)3+NO↑+2H2O钝化 钝化:空气中:Mg、Al 浓酸中:Al、Fe常温2.铁的化学性质:与水反应小结: 铁的化学性质
铁是一种变价金属(+2、+3),与弱氧化剂反应时呈较低价态,如:I2、S、H2SO4、CuSO4等。
与强氧化剂反应呈较高价态,如:F2、Cl2、Br2、HNO3、O2等。Fe2+和Fe3+离子的检验①Fe3+的检验:
a目测:黄色溶液
b滴入氨水或烧碱等碱性溶液:
现象:红褐色沉淀。方程式:
Fe3++3OH-==Fe(OH)3↓(红褐色)
c加KSCN溶液:
现象:溶液呈血红色
Fe3+ + SCN-== [Fe(SCN)]2+
黄色 无色 血红色Fe3+ + 3SCN - = Fe(SCN)3可溶血红色注意: Fe3+ 遇SCN - 显血红色
Fe2+ 遇SCN –不变色用途:用KSCN溶液检验溶液中是否含有Fe3+ 实验Fe2+和Fe3+离子的检验② Fe2+的检验
a目测:浅绿色溶液
b滴入氨水或烧碱等碱性溶液:
现象:白色沉淀,在空气中立刻转化成灰绿色,最后变成红褐色。
4Fe(OH)2+O2+2H2O==4Fe(OH)3
白色 红褐色
实验
结论KSCN一、无明显变化二、加入KSCN
溶液后溶液呈
血红色实验结论(一)溶液变成血红色(二)加铁粉后
溶液由黄色变成
浅绿色加KSCN
溶液后无明显变化实验结论亚铁化合物既具有氧化性又具有还原性,遇较强氧化剂时被氧化成三价铁的化合物
+3价铁离子只具有氧化性,遇较强还原剂时会被还原成亚铁化合物。写出+3价铁与铜反应的化学方程式 试一试1.实验室配制的FeSO4溶液久置是否会变质?为什么?
如何鉴定它已经变质?
2.如何防止FeSO4溶液变质?
